不同规格黄鳝补体溶血活性和T淋巴细胞数量的比较研究
2012-11-22彭本英陈建文龚超龙袁汉文长江大学动物科学学院湖北荆州434025
彭本英,陈建文,龚超龙,袁汉文 (长江大学动物科学学院,湖北 荆州 434025)
不同规格黄鳝补体溶血活性和T淋巴细胞数量的比较研究
彭本英,陈建文,龚超龙,袁汉文 (长江大学动物科学学院,湖北 荆州 434025)
为了解不同规格黄鳝(Monopterusalbus)免疫能力的强弱,将其按体长与体重分为3种规格,其中小规格组体长(34.12±0.12)cm、体重(33.52±2.91)g,中等规格组体长(38.75±1.89)cm、体重(60.57±18.89)g,大规格组体长(54.02±1.84)cm、体重(158.74g±19.31)g。通过建立标准溶血曲线,以兔红细胞为指示细胞,测得小规格组血清中总补体溶血活性ACH50较小,为7.01U/ml;中规格组为8.29U/ml,大规格组为9.02U/ml。通过玫瑰花环试验检测了黄鳝血液中T淋巴细胞的数量,结果显示,小规格组黄鳝血液形成的玫瑰花环百分率为28.7%,中规格组为31.3%,大规格组为33.7%。由此表明,随着黄鳝规格的加大,血清中总补体溶血活性增强,T淋巴细胞数量增加,即黄鳝的免疫能力不断提高。
黄鳝(Monopterusalbus);补体溶血活性;T淋巴细胞;玫瑰花环;兔红细胞
鱼类也存在类似哺乳动物的补体系统,在先天性免疫和适应性免疫中均起着重要作用。鱼类补体直接参与机体防御,其生物学活性影响机体抵抗微生物的能力、免疫反应细胞间的通讯联系、免疫复合物的形成和持续时间等[1]。鱼类补体的调节作用能增强体液和细胞介导的特异性免疫[2]。动物T淋巴细胞表面具有结合异种动物红细胞的受体称为E受体,在体外一定条件下,能与绵羊、兔等动物的红细胞结合,形成以T细胞为中心、红细胞环绕在周围,宛似一朵玫瑰花样的花环,故取名为E玫瑰花环试验。凡能与红细胞形成E花环的淋巴细胞称E花环形成细胞。T淋巴细胞是对绵羊红细胞SRBC具有高度亲和力的T细胞亚群,它与T细胞的体内外功能活性密切相关,能更敏感地反映机体细胞免疫的水平和动态变化,是目前检测细胞免疫水平最为简便快速的方法之一[3-4]。
黄鳝(Monopterusalbus)是我国特有的经济鱼类之一,具有较高的经济价值和食用价值。其肉质细嫩、营养丰富,除食用价值外还有一定的药用价值[5]。近年来,黄鳝的人工养殖获得了迅速发展,但对黄鳝的免疫机制了解甚少,这严重制约了黄鳝养殖的免疫预防和病害防治。对黄鳝补体溶血活性和T淋巴细胞数量进行研究,不仅可丰富鱼类免疫学研究内容,而且可以了解不同大小黄鳝免疫力的强弱,以利用生物技术进行疾病防治,这对促进黄鳝的健康无公害养殖具有积极意义。
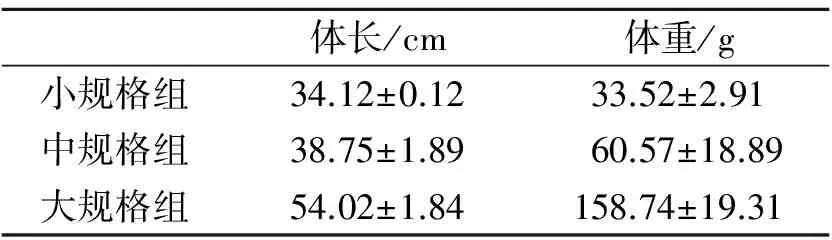
表1 3种规格黄鳝的体长与体重
1 材料与方法
1.1 材料
受试黄鳝购于湖北省荆州市钟鼓楼市场,大小不一,试验前于实验室暂养饲养7d,试验时按体长与体重分为3种规格进行试验。3种规格标准详见表1。
1.2 总补体溶血活性测定
采用心脏取血法获得兔红细胞,并用等体积的阿氏液保存。在显微镜下计数兔红细胞数量,并用EGTA-Mg-GVB冲洗3遍后,将血液稀释至2×108/ml备用。采取3种规格的黄鳝血液,室温静置,收集血清。
由预备试验确定实验血清的适宜比例,正式试验时先将实验血清用EGTA-Mg-GVB准确稀释至适宜浓度,再在1~6#试验管中加入不同体积的EGTA-Mg2+-GVB,使每只离心管中最终溶液体积均为350μl,最后将200μl兔红细胞加入每个离心管中;同时设置100%溶血管和0%溶血的空白对照管。具体如表2。
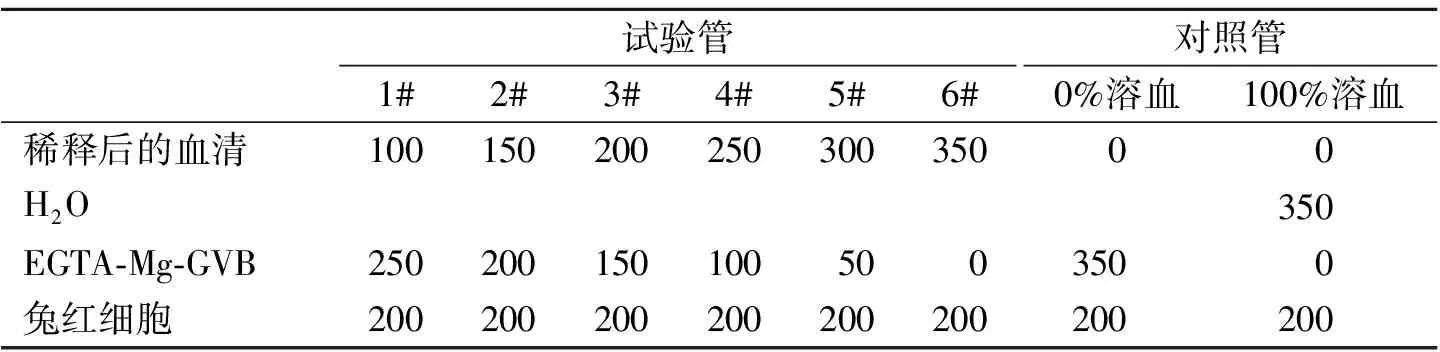
表2 试验管与对照管血清与兔红细胞等的用量 μl
反应体系在22℃水浴中维持90min,期间不时摇动,然后冰浴2min终止反应,且在1500r/min低温离心5min,以0%溶血对照管作为空白对照,用酶标仪在405nm波长测定光密度值(D)。
将所测相应样品的光密度除以100%溶血对照管的光密度求得相应样品的溶血度(Z)。然后,以Z/(1-Z)的对数值为横坐标,以血清用量的对数值为纵坐标,制得标准溶血曲线。因50%溶血(Z=0.5)的Z/(1-Z)值等于1,故可由横坐标为1处在直线上求得在纵坐标上相应的截距,此即产生50%溶血的待测血清的实际用量K,再由以下公式求得血清中总补体溶血活性ACH50。
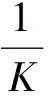
1.3 玫瑰花环试验
分别抽取3种规格的黄鳝血液,按照文献[6]的方法分离黄鳝淋巴细胞,将采集好的兔红细胞和黄鳝白细胞按一定比例稀释。取0.3ml胎牛血清于1ml的EP管中,再加入0.3ml兔红细胞和0.1ml黄鳝淋巴细胞,混匀;37℃水浴锅中反应25min后,500r/min离心5min;制备玫瑰花环制片,先后利用利用瑞氏液和吉姆萨氏液染色,洗片后在油镜下进行观察。观察时计数100个淋巴细胞,凡吸附3个或更多家兔红细胞的单核细胞为T淋巴细胞,并计算其所占的比例(%)。
2 结果与分析
2.1 不同规格黄鳝血清中总补体溶血活性比较
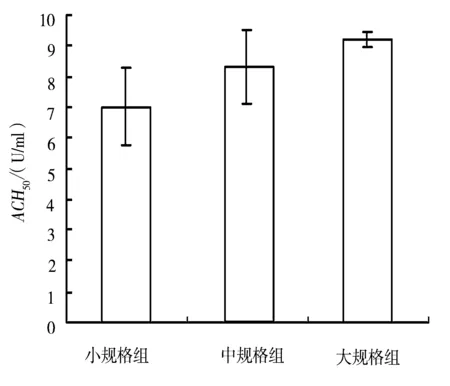
图1 3种规格黄鳝的总补体溶血活性
由图1可以看出,小规格黄鳝的总补体溶血活性平均为7.01U/ml,中等规格黄鳝补体的溶血活性为8.29U/ml,大规格的黄鳝总补体的溶血活性平均为9.20U/ml。可见,随着黄鳝规格的增大,其血清中的补体溶血活性不断增强。但是由标准差值可以看出,在小规格和中等规格阶段黄鳝血清中总补体的溶血活性差异较大,而大规格黄鳝的变化差异就相对小的多。小规格黄鳝和中等规格黄鳝大多可以视为处于生长期的黄鳝,而大规格黄鳝则完全已经成熟,达到上市要求。由此可见,规格较大的黄鳝其血清中总补体的溶血活性就相对较高,其抗病能力就越强。
3.2 不同规格黄鳝的T淋巴细胞数量比较
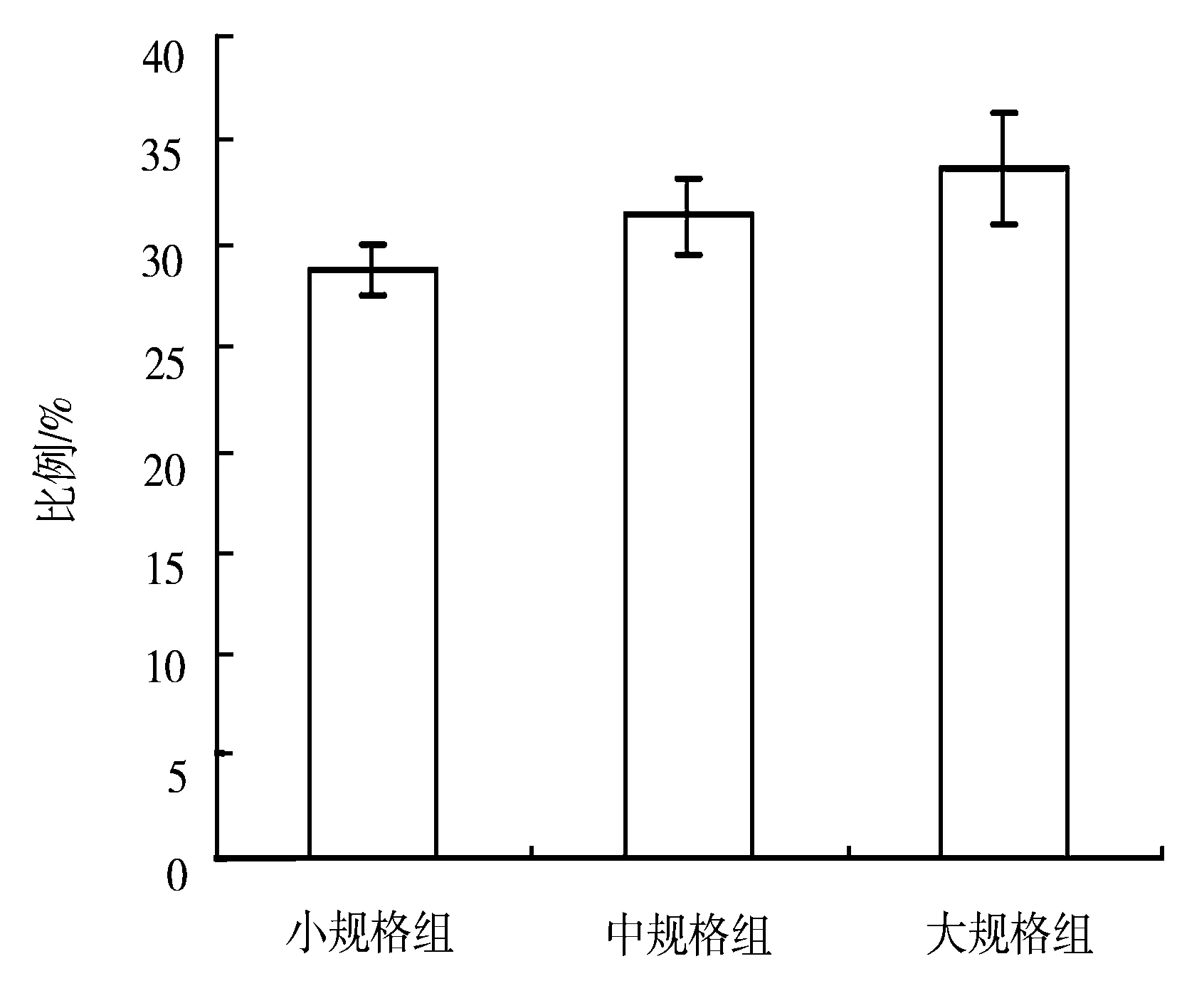
图2 3种规格黄鳝中T淋巴细胞形成玫瑰花环的比例
由图2可见,不同规格黄鳝形成玫瑰花环比例不同,大规格组黄鳝有33.7%的淋巴细胞能吸附3个以上的兔红细胞,形成玫瑰花环,这样的细胞为T淋巴细胞,而中规格组黄鳝有31.3%的淋巴细胞能形成玫瑰花环,小规格组黄鳝形成玫瑰花环的比例最低,仅28.7%。这说明随着黄鳝规格的不断增加,黄鳝血清中能形成玫瑰花环的T淋巴细胞数量也随之增加。
3 讨论
补体(Complement,C)是先天免疫防御中重要的体液功能分子,在被病原体或者抗原抗体复合物等多种物质激活后,能诱导炎症反应和抗体的形成、介导病原体的清除[7]。自1894年Pfeiffer发现溶菌现象以来,对补体的研究己经有100多年的历史。鱼类补体的研究起步比较晚,系统研究是20世纪80年代以后才开始的[8]。研究表明,鱼类补体可以通过激活旁路途径高效溶解多种脊椎动物如兔、绵羊、山羊、狗和人类血液中的红细胞[6],鱼类补体具有较低的反应温度、较高的溶血活性以及成分的多态性[9],其中鱼类旁路途径溶血活性比哺乳动物的ACH50值高5~10倍,说明旁路途径在鱼类先天性免疫中具有更重要的作用。但鱼类补体可能对被溶解靶细胞的敏感性存在种类特异性差异[10]。通过旁路途径鱼类补体可以间接地裂解多种动物红细胞,鱼类补体的这种性质显示鱼类可能具有较宽范围的识别外源物种的能力,这种识别非己成分的能力可能归因于鱼类的一些补体成分存在的多种亚型[11]。本研究将脊椎动物血清补体溶血活性标准测定方法应用到黄鳝血清研究中,得出不同规格的黄鳝血清溶血活性的差异,证明在黄鳝中有补体的存在。在文昌鱼体液中也出现补体样的溶血活性,其补体C3浓度为1.17mg/ml,其含量与人及狗血清中的C3浓度基本相当。此结果说明,文昌鱼体液中存在着类似于脊椎动物替代途径补体样的溶血活性[12]。
淋巴细胞是鱼类的主要免疫细胞,其中T淋巴细胞是承担细胞免疫的活性细胞,当接受信息后,产生返祖、分裂,形成致敏淋巴细胞,可以发挥对靶细胞(微生物、肿瘤细胞等)的攻击,同时将信息传递给B淋巴细胞,发挥协同作用[13]。鱼类T淋巴细胞的分离与纯化技术已经很成熟。本研究结果表明,不同规格黄鳝T淋巴细胞数量并不一样,揭示不同规格黄鳝免疫能力具有差异。
[1]张 静,詹 勇,苏 彬. 鱼类补体系统的研究进展[J].中国饲料,2008,(5):23-26.
[2]张 颖,刘洪柏,卢彤岩,等.鱼类补体系统的研究进展[J].水产学报,2005,29(6):842-847.
[3]李春子,关晓清,周学章,等.应用E-玫瑰花环试验检测动物T细胞[J].延边大学医学学报,2001,24(1):30-32.
[4]王秋婵,胡庭俊,王延璞,等.用E-玫瑰花环法检测117例健康牛羊猪外周血T淋巴细胞值[J].畜牧与兽医,1998,(3):14-16.
[5]舒妙安,马有智,张建成.黄鳝肌肉营养成分的分析[J].水产学报,2000,(4):15-19.
[6]Sunyer J O,Tort L.Natural hemolytic and bactericidal activities of sea breamSparusaurataserum are effected by the alternative complement pathway[J].Vet Immunol Immunopathol,1995,45:333-345.
[7]Gasque P,Jones J,Singhrao S K,et al.Identification of an astrocyte cell population from human brain that expresses perforin,a cytotoxic protein implicated in immune defense[J].J Exp Med,2004,187:451-460.
[8]Dodds A W,Day A J.The phylogeny and evolution of the complement system[J].Immunol Med,l993,20:39-44.
[9]Magnadottir B.The spontaneous haemolytic activity of cod serum:heat insensitivity and other characteristics[J].Fish Shellfish Immunol,2000,10:731-735.
[10]Claire M H,Lambris J D.The complement system in teleosts [J].Fish Shellfish Immunol,2002,12:399-420.
[11]Sunyer J O,Tort L.Natural hemolytic and bactericidal activities of sea breamSparusaurataserum are effected by the alternative complement pathway[J].Vet Immunol Immunopathol,1995,45:333-345.
[12]王长法.文昌鱼体液和鱼类血清补体溶血系统比较研究[D].青岛:中国海洋大学,2003.
[13]陈全震,李亚南,邵健忠,等.鱼类外周血淋巴细胞的分离技术[J].中国水产科学,1999,6(4):26-30.
10.3969/j.issn.1673-1409(S).2012.09.007
S917
A
1673-1409(2012)09-S022-03
2012-08-10
彭本英(1968-),女,湖北荆州人,实验师,主要从事动物免疫学研究。
