康莱特对HepG2细胞凋亡及其Caspase-3和Survivin表达影响
2012-11-21金鑫姚良苹卢云李昌生
金鑫,姚良苹,卢云,李昌生
(1 枣庄矿业集团中心医院普外科,山东 枣庄 277011; 2 青岛大学医学院附属医院肝胆外科; 3 潍坊寿光市人民医院)
原发性肝癌(HCC)是世界范围内常见的恶性肿瘤之一[1]。多数病人常伴有不同程度的肝硬化,难以承受手术切除或经动脉化学栓塞治疗,且全身化疗毒副作用大。因此,尽管近年来HCC的综合治疗有了很大的进展,但总的说来HCC病人的预后还是没有明显的改善。随着人们对肿瘤细胞生物学和分子生物学研究的不断深入,基因治疗已经成为21世纪肿瘤治疗的新方法。本实验采用康莱特作用于人肝癌Hep G2细胞,通过检测Hep G2细胞抑制率及其凋亡相关蛋白半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)和存活素(Survivin)的表达情况,初步探讨康莱特在基因水平诱导Hep G2肝癌细胞凋亡的机制。现将结果报告如下。
1 材料和方法
1.1 材料及其来源
Hep G2肝癌细胞株购自中国科学院上海细胞库,为贴壁细胞。RPMI-1640培养基和二甲基亚砜(DMSO)均购自美国GIBCO公司。细胞凋亡检测试剂盒购自深圳晶美生物工程有限公司。Mouse Ig G1/Ig G1和FITC/PE试剂盒购自北京市晶美基因谷科技有限公司。Caspase-3鼠抗人单克隆抗体购自美国Santa Cruz Biotechnol ogy公司。Survivin鼠抗人单克隆抗体购自R&D Systems Inc。
1.2 Hep G2肝癌细胞的培养
贴壁Hep G2肝癌细胞用含体积分数0.10标准胎牛血清的细胞培养基RPMI-1640培养至对数生长期,待80%细胞汇合后,加入2.5 g/L的胰蛋白酶液1~2 mL消化,反复吹打瓶底壁细胞,形成细胞悬液;吸取1/20细胞悬液,接种于新的培养瓶内并加入适量新鲜培养液;放入培养箱中继续培养。
1.3 MTT法检测Hep G2细胞抑制率
取对数生长期细胞移入96孔培养板,细胞密度1×108/L,每孔加细胞悬液200μL。培养箱中培养24 h后,吸弃孔内原培养液,加含体积分数0.005、0.010、0.015、0.020康莱特注射液的 RPMI-1640培养液200μL。各药物分别设4个平行复孔,另设1个空白对照孔。分别培养12、24、48 h,每孔加入5 g/L MTT液20μL。继续培养4 h后终止培养,弃上清液,加入DMSO 150μL终止反应。采用酶标仪于490 n m波长处测定吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率(%)=(1-A药物/A对照)×100%。
1.4 流式细胞仪测定细胞凋亡情况
调节细胞密度为1×108/L,并置于6孔培养板中。培养24 h后弃上清液,用含体积分数0.005、0.010、0.015、0.020的康莱特体外培养 Hep G2细胞,每种浓度设平行4孔(即每种浓度重复4次),继续培养24 h后收集细胞,并设空白对照。用4℃预冷的PBS洗细胞2次,用250μL结合缓冲液重新悬浮细胞,调节其密度为1×109/L;取100μL的细胞悬液置于5 mL流式管中,加入Annexin V/FITC 5μL和20 mg/L碘化丙锭溶液10μL;混匀后于室温避光孵育15 min;在反应管中加PBS 400μL,流式细胞仪检测细胞凋亡情况。
1.5 流式细胞仪检测Caspase-3和Survivin表达
调节细胞密度为1×108/L,并置于6孔培养板中;培养24 h后弃上清液,分别加入含体积分数0.005、0.010、0.015、0.020康莱特注射液的 RPMI-1640培养液200μL,每种浓度设平行4孔(即每种浓度重复4次),并设空白对照;继续培养48 h后收集约1010/L细胞到流式管内,离心5 min;弃去上清液,PBS重悬细胞,使其密度为1010/L,加入终止液孵育10 min;康莱特组加入Caspase-3和Survivin荧光抗体均为20μL,对照组加入同型对照Mouse Ig G1/Ig G1和FITC/PE 20μL,置于避光的冰盒内震荡孵育30 min;每管加2 mL PBS,2 000 r/min离心10 min,取上清液500μL,以40 g/L多聚甲醛重悬。流式细胞仪检测Caspase-3和Survivin表达。
1.6 统计分析
2 结 果
2.1 康莱特对肝癌细胞Hep G2增殖的抑制作用
同一时间下,随着康莱特剂量升高,其细胞生长抑制率显著升高,组间比较差异有显著性(P<0.01);同一剂量下,随着康莱特作用时间延长,其细胞生长抑制率显著升高,不同时间点比较差异有显著性(P<0.01)。见表1。
表1 不同浓度康莱特对肝癌细胞Hep G2抑制率的影响(χ/%,±s)
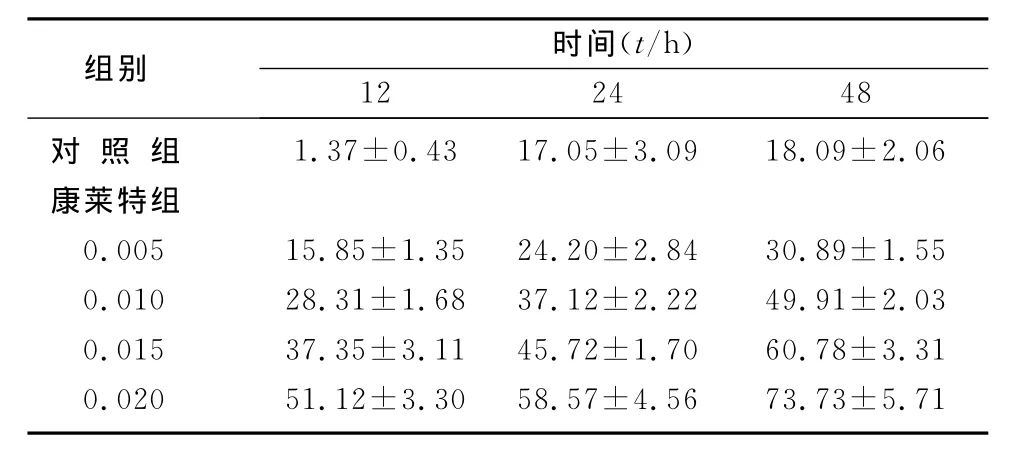
表1 不同浓度康莱特对肝癌细胞Hep G2抑制率的影响(χ/%,±s)
组别 时间(t/h)12 24 48对 照 组 1.37±0.43 17.05±3.09 18.09±2.06康莱特组0.005 15.85±1.35 24.20±2.84 30.89±1.55 0.010 28.31±1.68 37.12±2.22 49.91±2.03 0.015 37.35±3.11 45.72±1.70 60.78±3.31 0.020 51.12±3.30 58.57±4.56 73.73±5.71
2.2 Hep G2细胞凋亡及Caspase-3、Survivin蛋白的表达
随着康莱特剂量的增加,其细胞凋亡率逐渐升高(P<0.01)。体积分数0.005、0.010、0.015、0.020康莱特组Hep G2细胞Caspase-3、Survivin蛋白表达水平与对照组比较,差异均有显著性(P<0.01)。见表2。
表2 康莱特诱导Hep G2细胞凋亡及对Caspase-3和Survivin表达的影响(χ/%,±s)
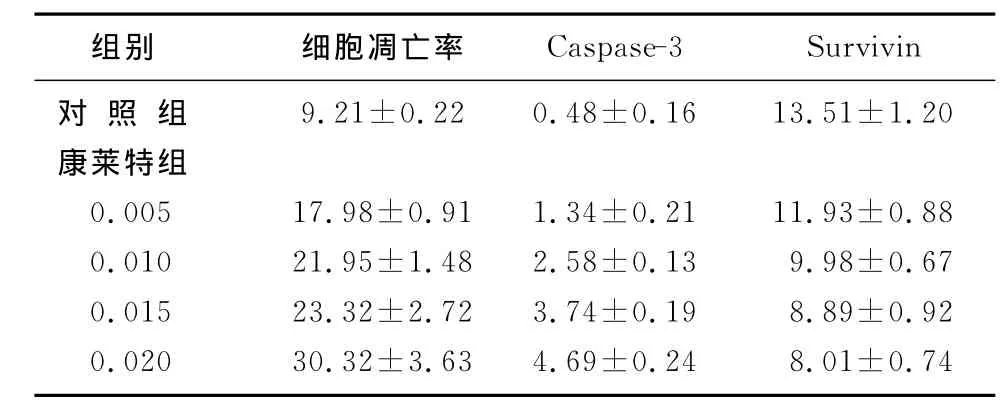
表2 康莱特诱导Hep G2细胞凋亡及对Caspase-3和Survivin表达的影响(χ/%,±s)
组别 细胞凋亡率 Caspase-3 Survivin对 照 组 9.21±0.22 0.48±0.16 13.51±1.20康莱特组0.005 17.98±0.91 1.34±0.21 11.93±0.88 0.010 21.95±1.48 2.58±0.13 9.98±0.67 0.015 23.32±2.72 3.74±0.19 8.89±0.92 0.020 30.32±3.63 4.69±0.24 8.01±0.74
3 讨 论
肝细胞性肝癌为最常见的肝脏恶性肿瘤,特别是在东亚地区尤其明显[2]。近些年来,人们已经逐渐认识到肿瘤的发生发展不仅是细胞增殖失控、分化异常的结果,而且与细胞凋亡失衡有关[3]。
实验结果表明,康莱特的作用主要是阻滞细胞周期G2+M时相,从而减少细胞有丝分裂,使肿瘤细胞的增殖受到抑制,并可激活某些促细胞凋亡发生因子,进一步导致细胞凋亡[4]。已有的研究结果表明,该制剂对多种肿瘤细胞有显著的抑制作用[5]。本研究结果也显示,康莱特不仅能够有效抑制肝癌细胞增殖,呈现浓度、时间依赖性,而且还能诱导细胞凋亡,促使Caspase-3蛋白表达增加,Survivin蛋白表达减少。
众所周知,Caspase-3为与细胞凋亡密切相关的蛋白酶家族,其抑制作用与其浓度密切相关。目前认为Caspase-3是Caspase家族中引发细胞凋亡蛋白酶级联反应中的“核心”。该蛋白可切割染色体DNA,直接导致细胞凋亡,也可以裂解特异性的天冬氨酸底物,诱导细胞凋亡蛋白酶级联反应[6]。同时,某些基因如抑制凋亡蛋白(IAPs)家族则能够通过影响Caspase-3的激活,对细胞凋亡起调控作用。
Survivin是新近发现的IAPs家族成员之一,被认为是迄今发现的最强的细胞凋亡抑制因子,其具有抑制细胞凋亡、促进细胞增殖和调节细胞有丝分裂的重要作用[7]。它在胚胎发育过程中出现,在终末分化的成人组织和癌旁正常组织中无表达(胸腺除外),而在转化细胞株和人体内几乎所有的恶性肿瘤中均有明显表达,且其表达还与肿瘤的发生和发展、组织分化程度以及预后均密切相关,是许多肿瘤预后影响因子之一[8]。SHIN 等[9]的研究结果表明,Survivin主要通过抑制Caspase级联反应下游共同通路中的Caspase-3和Caspase-7发挥其抗细胞凋亡作用。
本实验结果显示,随康莱特浓度的增加,Survivin蛋白表达显著抑制,Caspase-3蛋白的表达显著增高,Hep G2细胞凋亡也明显升高。其原因可能是:康莱特一方面直接激活Caspase-3基因,促进Caspase-3蛋白的表达,引起细胞凋亡;另一方面通过抑制Survivin蛋白的表达,从而降低Survivin对Caspase-3的负调节作用,间接促进Hep G2细胞凋亡。现阶段研究表明,Survivin可能通过以下机制影响Caspase-3的表达:Survivin直接抑制Caspase-3、Caspase-7,从而阻断细胞凋亡过程;Survivin结合周期蛋白激酶CDK4,间接抑制Caspase-3活性,阻碍线粒体释放细胞色素C,进而阻断细胞凋亡;Survivin通过Thr[34]位点磷酸化来调节Caspase的促细胞凋亡作用[10];Survivin与第二个线粒体源的Caspase激活物(SMAC)结合保护IAPs对Caspase的抑制作用[11]。
现已知Survivin的表达呈细胞周期依赖性,即于S期表达增强,G2/M期达到最高水平,而G0/G1期表达下调,且在G2/M期时,高表达的Survivin与Caspase-3、Caspase-7一起定位于中心体微管上,可以防止Caspase-3、Caspase-7被激活而引起细胞凋亡。因此,干扰Survivin和微管蛋白的反应,可致Survivin抗凋亡活性丧失,细胞 G2/M 期凋亡[12]。本实验提示,康莱特干预后,可能通过影响Survivin周期依赖性表达的差异,阻滞肝癌细胞的G2+M期,间接引起Hep G2细胞凋亡。
总而言之,本实验结果显示,康莱特作用后,随着Survivin表达减弱,Caspase-3表达增强,细胞增殖抑制,细胞凋亡率增高。提示康莱特可能通过干预Survivin的表达,减弱其对Caspase-3的负调控作用,或直接激活Caspase-3来影响肝癌细胞的增殖与凋亡,但具体的作用机制尚需进一步探索。
[1]吴阶平,裘法祖.黄家驷外科学[M].6版.北京:人民卫生出版社,1999:1223-1233.
[2]MICHIELSEN P P,FRANCQUE S M,VAN DONGEN J L.Viral hepatitis and hepatocell ular carcino ma[J].World J Surg Oncol,2005,3:27.
[3]DANBARA N,YURI T,TSUJITA-KYUTOKU M,et al.Enterolactone induces apoptosis and inhibits growth of Colo 201 hu man colon cancer cells bot h in vitro and in vivo[J].Anticancer Res,2005,25(3B):2269-2276.
[4]王俊杰,俞莉章,申文江,等.薏苡仁提取物体外对肾癌细胞系放射敏感性的影响及作用机制探讨[J].癌症,1999,18(6):680-682.
[5]冯斌,刘继红,陈黎.康莱特注射液对晚期恶性肿瘤的姑息治疗[J].中国肿瘤临床,1999,26(3):238-240.
[6]WEBER G F,MENKO A S.The canonical intrinsic mitochondrial death pathway has a non-apoptotic role in signaling lens cell differentiation[J].J Biol Chem,2005,280(23):22135-22145.
[7]REED J C,REED S I.Survivin cell-separation anxiety[J].Nat Cell Biol,1999,1(8):E199-200.
[8]赵光兵,宋修岐,孙少杰.胃癌组织Survivin和VEGF-C的表达及意义[J].青岛大学医学院学报,2009,45(10):465-467.
[9]SHIN S,SUNG B J,CHO Y S,et al.An anti-apoptotic pr otein hu man Survivin is a direct inhibitor of caspase-3 and caspase-7[J].Biochemistr y,2001,40(4):1117-11123.
[10]O’CONNOR D S,GROSSMAN D,PLESCIA J,et al.Regulation of apoptosis at cell division by p34cdc2 phosphorylation of surviving[J].Pr oc Natl Acad Sci USA,2000,97(24):13103-13107.
[11]SUZUKI A,ITO T,KA WANO H,et al.Survivin initiates procapase 3/p21 co mplex for mation as a result of interaction with CDK4 to resist Fas-mediated cell deat h[J].Oncogene,2000,19(10):1346-1353.
[12]GIODINI A,KALLIO M J,WALL N R,et al.Regulation of microtubule stabilityand mitotic progression by survivin[J].Cancer Res,2002,62(9):2462-2467.
