新型葫六环联脲桥联双核钆(Ⅲ)配合物的合成、晶体结构及其热稳定性
2012-11-21张桂玲罗绪强
张桂玲, 曾 加, 罗绪强
(1. 贵阳学院 实验中心,贵州 贵阳 550005; 2. 贵州师范学院 资源环境与灾害研究所,贵州 贵阳 550018)
葫六环联脲(Q6,亦称六元瓜环)是由6个甘脲和12个亚甲基桥接起来的大环化合物,由Behend 等[1]于1905年合成,晶体结构于1981年由Freeman等[2]确定。Q6拥有疏水性的内部空腔,在其空腔两端环绕有多个羰基,可成为阳离子的键合位点,通过离子偶极作用和与脲羰基的氢键作用键合客体分子,对多种有机阳离子、金属离子具有较强的选择性包结配位能力,在分子识别、超分子催化以及分子组装等领域具有广阔的应用前景。
钆是一种银白色的稀土金属元素,常以化合态的形式赋存于硅铍钆矿、铌钆矿及其他矿物中,具良好的超导电性能、高磁矩等特殊性能,在原子能、微波、影视等领域用途广泛。但钆作为中心原子形成配合物时,其f轨道配位的高交换率使得配合物的分离特别困难,尤其是在水溶液中[3,4]。研究表明,大环配体与稀土离子的配位能通过增加热力学的稳定性解决这种动力学的不稳定[5~9]。
为进一步探索稀土金属与大环化合物之间的相互作用,扩展其应用领域,特别是在生物和医药等领域应用前景,本文以钆离子[Gd(Ⅲ)]为客体,Q6为主体,设计并合成了一个新型葫六环联脲桥联双核钆(Ⅲ)配合物——{[Gd(H2O)6]2[Q6(H2O)]}Cl6·4H2O(1),其结构经单晶X-射线衍射,IR和元素分析表征。用TG-DTG-DSC研究了1的热稳定性,结果表明,1具有良好的热稳定性。
1 实验部分
1.1 仪器与试剂
Bruker Smart-1000 CCD型单晶X-射线衍射仪;Nicolet Nexus 470型红外光谱仪(KBr压片);TGDTA92型热分析仪(N2,流量40 mL·min-1, 升温速率10 ℃·min-1); Elementar Vario EL 型元素分析仪。
Q6参照文献[10]方法合成;GdCl3·6H2O自制;其余所用试剂均为分析纯。
1.2 1的合成
在反应瓶中加入Q6996 mg(10 mmol)的 2 mol·L-1盐酸(20 mL)溶液,搅拌下缓慢滴加GdCl3·6H2O 373 mg(20 mmol)的水(10 mL)溶液,滴毕,回流反应4 h。过滤,滤液于室温静置缓慢蒸发,一个月后得无色晶体1,产率76%。 IRν: 3 371, 1 724, 1 490, 1 420, 1 327, 1 237, 1 181, 964, 802, 758, 676, 634 cm-1; Anal.calcd for C36H70N24O29Cl6Gd2: C 23.62, H 3.85, N 18.37; found C 23.49, H 3.61, N 18.64。
1.3 晶体结构测定
将单晶1置衍射仪上,于293 K用石墨单色化的Mo Kα射线收集衍射数据。1的晶体结构解析采用直接法,结构解析用Shelxl-97程序完成。对全部非氢原子坐标由数轮差值Fourier合成确定,通过全矩阵最小二乘法对F2进行修正收敛得到全部非氢原子的坐标及各向异性参数。
2 结构与讨论
2.1 结构解析
1的分子结构图见图1,氢键堆集图见图2和图3;主要晶体学数据见表1,主要键长和键角数据见表2,氢键数据见表3。
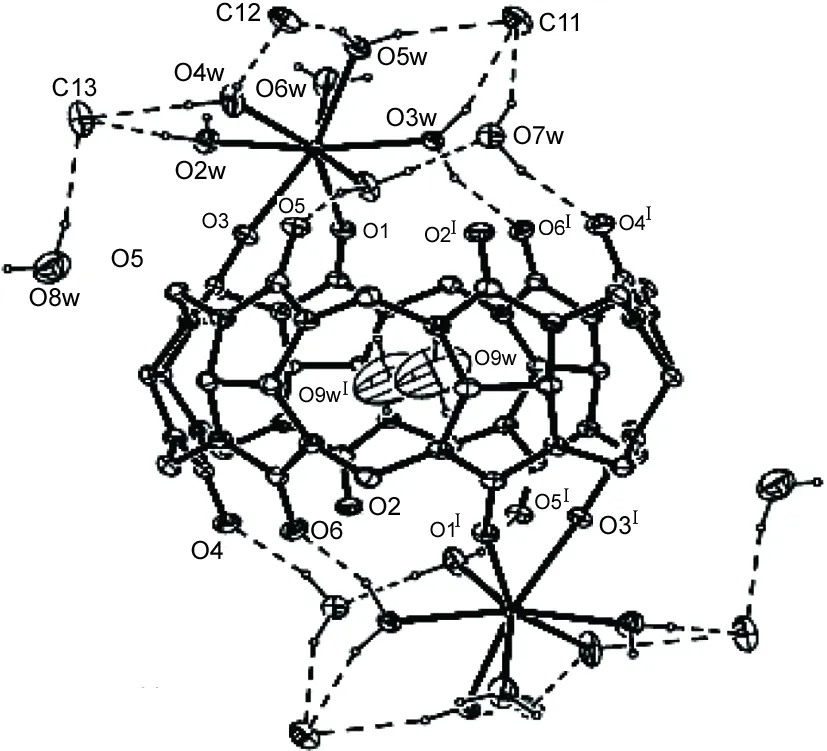
图1 1的分子结构图Figure 1 Molecular structure of 1
从图1可见,1为中心对称结构,Q6作为双二齿配体贡献出两对相邻的羰基氧原子与Gd(Ⅲ)配位,两个与六个水分子配位的Gd(Ⅲ)分别覆盖Q6的两个端口,Gd(Ⅲ)与八个氧原子配位呈现出一种稍变形的四方反棱柱构型,O1, O3, O1W, O2W和O3W, O4W, O5W, O6W分别占据一个四方底面。一个客体水分子位于Q6空腔内,由于Q6的空腔体积相对于水分子来说太大,水分子在空腔内占据了两个不同的位置。在与Gd(Ⅲ)配位之后,Q6内的空腔体积为107 Å3,远远小于Q6自身体积(164 Å3)。在Q6每个端口旁边均有两个结晶水分子和三个氯离子。两个Gd(Ⅲ)之间的距离为10.662 7(26) Å。 Gd(Ⅲ)到两个与其配位原子所定义的两个底面的距离分别为1.237 6(17) Å和1.349 6(20) Å。 Gd(Ⅲ)与Q6的两个羰基氧原子键合,键长分别为2.366 Å(O1-Gd1)和2.395 Å(O3-Gd1)。六个配位水氧原子与Gd(Ⅲ)的平均键长为2.386 Å, Gd(Ⅲ)距Q6端口处六个氧原子所定义平面的距离为1.747 6(19) Å。
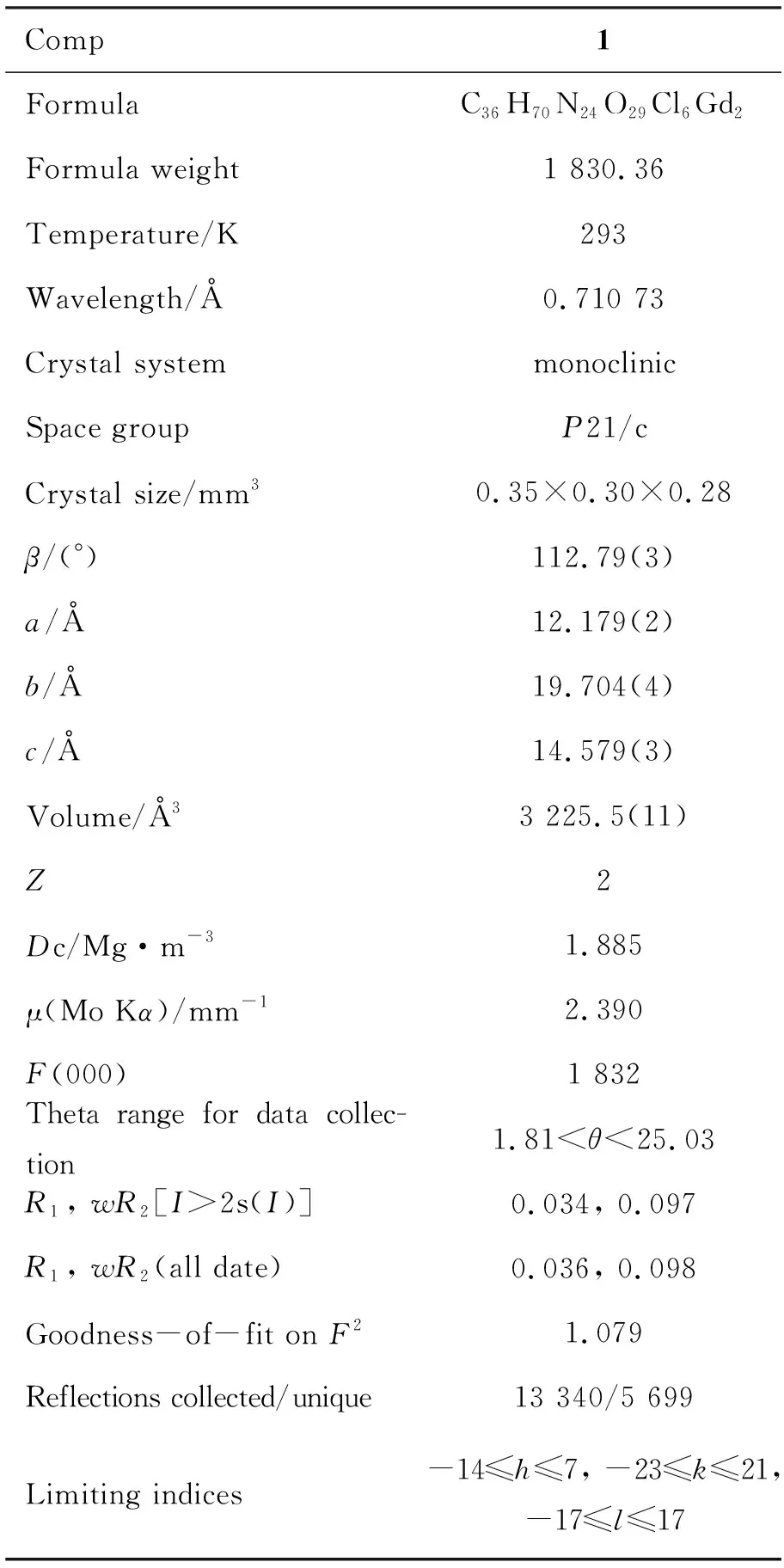
表1 1的晶体学数据Table 1 Crystal data of 1
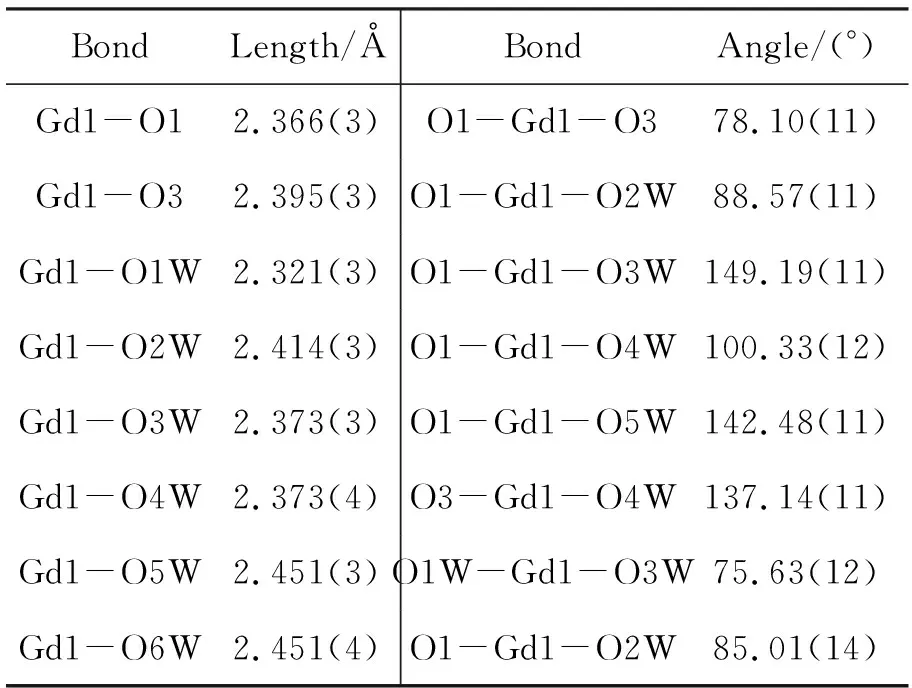
表2 1的主要键长和键角Table 2 Selected bond lengths and bond angles of 1
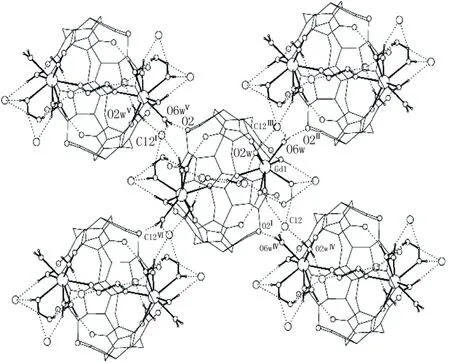
图2 1分子中的氢键堆积图(平行于boc)Figure 2 Hydrogen bonds of 1(parallelling to the boc plane)
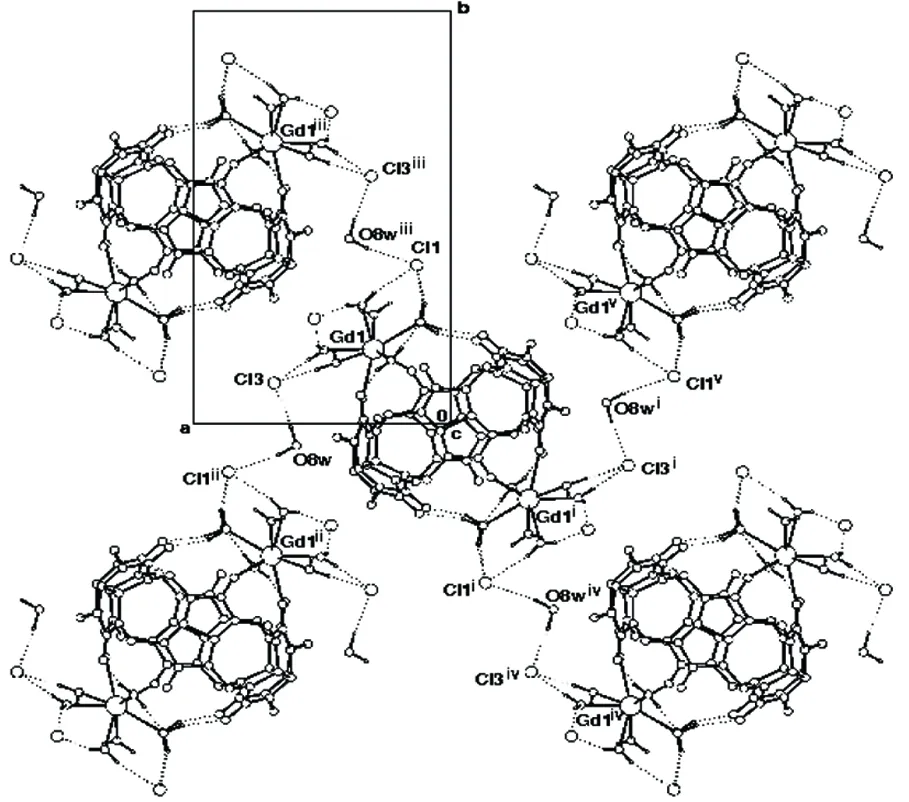
图3 1分子中的氢键堆积图(平行于aob)Figure 3 Hydrogen bonds of 1(parallelling to the aob plane)
从图2和图3可见,每个1通过Q6上未配合的氧原子O2,配位水分子和氯离子Cl2之间形成的氢键和其它四个配合物相连形成平行于boc平面的超分子结构(氢键数据见表3)。晶格水分子在这个三维超分子化合物的形成过程中发挥了重要的作用,结晶水O8w与C11, C13间, C11, C13和配位水之间分别形成的氢键将1连成平行于aob平面的超分子结构,进而形成三维超分子结构。
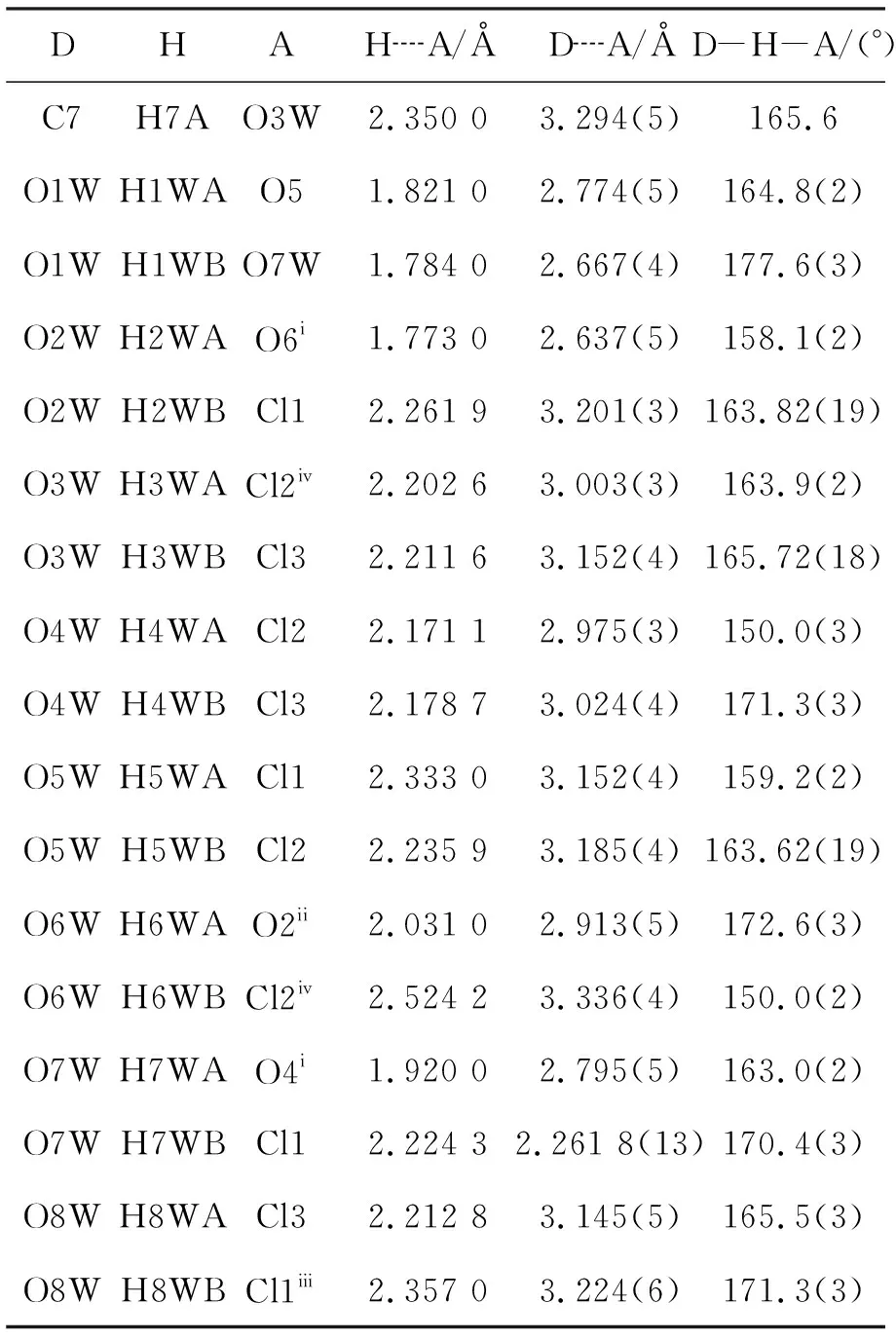
表3 1的氢键键长和键键角Table 3 Hydrogen bond lengths and bond angles of 1
i-x, -y, -z+1;ii-x, y+1/2, -z+3/2;iii-x+1, y-1/2, -z+3/2;ivx, -y+1/2, z+1/2
2.2 1的热稳定性
1的TG-DTG-SC曲线见图4。由图4可见,1在119.8 ℃~757.5 ℃的热分解分为五个阶段。第一阶段失重温度为119.8 ℃~272.6 ℃,失重量16.76%,与失去1的17个水分子的理论失重量(16.73%)相当;第二阶段失重温度为272.6 ℃~450.0 ℃,失重量2.77%,与失去一个氯离子、一个亚甲基理论失重量2.70%一致,此时瓜环分子开始分解,出现一个缺口,实验结果表明,Q6很稳定,在温度近272.6 ℃才开始分解;第三阶段失重温度为450.0 ℃~493.5 ℃,失重量17.22%,与1失去五个氯离子和一个苷脲分子(C4H2O2N4)的理论失重量(17.23%)相一致,此时,环状的瓜环分子开始解环,成为片状;第四阶段失重温在493.5~546.3 ℃,失重量为20.43%,与失去七个亚甲基、两个苷脲分子理论失重量(20.45%)一致,在这阶段,残余分子陆续分裂成小分子片;第五阶段失重温度为546.3 ℃~757.5 ℃,失重量24.06 %,与1失去四个亚甲基和三个苷脲分子去掉三个氧原子的理论失重量(23.07%)相一致。最后残余物为Gd2O3。热重实验值与理论计算值相吻合,各条曲线间相互对映,实验结果真实可靠。
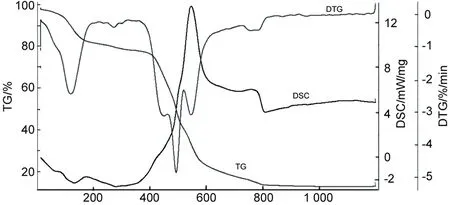
Temperature/℃图4 1的TG-DTG-DSC曲线Figure 4 TG-DTG-DSC curves of 1
[1] Behrend R, Meyer E, Rusche F.Ueber Condensation-sprodukteaus glycolurilund formaldehy[J].Ann Chem,1905,339:1-37.
[2] Freeman W A, Mock W L, Sh il N Y.Cucurbituril[J].J Am Chem Soc,1981,103(24):7367-7368.
[3] Alleyne B D, Williams A R, Hall L A. Lanthanide(Ⅲ) methylsquarates:Synthesis and X-ray structures[J].Inorg Chem,2001,40:1045-1051.
[4] He Zh, Gao E Q, Wang Z M,etal. Coordination polymers based on inorganic lanthanide(Ⅲ) sulfate skeletons and an organic isonicotinateN-oxide connector: segregation into three structural types by the lanthanide contraction effect[J].Inorg Chem,2005,44:862-874.
[5] Tsukube H, Shinoda S.Lanthanide complexes in molecular recognition and chirality sensing of biological substrates[J].Chem Rev,2002,102:2389-2404.
[6] Kaltsoyannis N, Scott P. The Felements[M].Oxford University Press,New York:1999.
[7] Zhang G L, Wu Z Y, Li Y T,etal. Synthesis and crystal structure of a binuclear gadolinium(Ⅲ) complex bridged by cucurbit[6]uril[J].Chin Chem Lett,2006,17(1):93-96.
[8] 张桂玲,罗绪强. 以瓜环为主体的金属离子配合物研究新进展[J].化工技术与开发,2008,37(5):26-30.
[9] Buschmann H J, Jansen K, Schollmeyer E. Cucurbit[6]uril as ligand for the complexation of lanthanide cations in aqueous solution[J].Inorg Chem Commun,2003,6:531-534.
[10] Kim J, Jung I S, Kim S Y,etal. New cucurbit homologues:Syntheses,isolation,characterization,and X-ray crystal structures of cucurbit[n]uril(n=5,7,and 8)[J].J Am Chem Soc,2000,122(3):540-541.
