植物耐盐性研究进展
2012-11-20崔世友夏礼如邱海荣
崔世友,夏礼如,邱海荣
(江苏沿江地区农科所,江苏省南通市耐盐植物公共技术服务平台,江苏南通226541)
植物耐盐性研究进展
崔世友,夏礼如,邱海荣
(江苏沿江地区农科所,江苏省南通市耐盐植物公共技术服务平台,江苏南通226541)
土壤盐渍化是全球农业面临的主要非生物逆境之一。盐胁迫中一连串的事件增加了磷脂酶D(PLD)的活性,接着产生高量的磷脂酸(PA),PA与MPK6结合并增强其活性,激活的MPK6可与SOS1结合并使其磷酸化;该过程将SOS、MAPK和PLD信号途径整合在一起。在植物耐盐性研究中,人们常常假设盐逆境下过多的Na+引起生长和产量的下降,对耐氯研究重视不够。从盐逆境信号转导途径的整合与耐氯性等方面综述了植物耐盐性研究的进展。
盐逆境;信号转导;耐氯性
面对不断增长的人口,要维持目前的粮食供应水平,到2025年和2050年全球粮食产量需分别增加38%和57%[1]。大多数可耕地已经用于种植,通过耕地面积的扩张增产粮食几乎是不可能的,因此目标是增加单位面积的产量。据估计,世界耕地面积的15%因土壤侵蚀以及理化性状变劣而退化,包括土壤盐渍化[1]。近年来发展盐土农业得到了各国广泛的重视[2-3],笔者从盐逆境信号转导途径和耐氯性研究2个方面介绍了植物耐盐性研究的新进展。
1 盐逆境信号转导途径的整合
植物防卫盐分的一种主要方法是将其从细胞中排除,通过液胞的区隔化或从质膜外流。拟南芥SOS1蛋白是一种Na+/H+逆转运蛋白[4],可被由SOS2蛋白激酶(SnrK3类蛋白)与SOS3(Ca2+感受蛋白)组成的蛋白复合体所激活。盐逆境增加了胞内Ca2+浓度,进而激活SOS3,随后与SOS2结合并激活之,SOS3/SOS2复合体激活SOS1,产生Na+的外运。转基因植物中SOS1蛋白的过表达增加了植物的耐盐性[5]。
盐逆境也激活了促分裂素原活化蛋白激酶(MAPK)信号传导途径,该途径包括蛋白激酶的一系列级联,由生物或非生物逆境引发,也包含于发育过程中[6]。这些信号级联特性研究得最清楚的是酵母高渗透性甘油(High Osmolarity Glycerol Response 1,HOG1)途径,为应答超渗透条件传递甘油积累的信号,HOG1可使Na+/H+逆转运蛋白磷酸化,该逆转运蛋白的活性依赖于HOG1的存在[7]。在植物中,MAPK途径的组分在盐逆境下是上调转录或酶活性增强[8]。尤其是拟南芥的MPK6和MPK4[9],这些激酶可被上游的蛋白激酶MKK2部分地激活,其突变体是盐敏感的[10]。不过对盐逆境中MAPK信号的理解主要还是描述性的,该信号如何在植物盐逆境中实际发挥功能还远未真正了解。
第3个组分是磷脂酶D(PLD),在拟南芥和其他植物中,PLD酶由一个多基因家族编码,已知盐逆境诱导该家族一些成员的表达。与质膜有关的PLD酶从磷脂酰胆碱释放磷脂酸(phosphatidic acid,PA),PA是许多不同逆境如活性氧的产生和诱导气孔关闭应答的第二信使。此外,PLD突变体是盐分过敏感的[11]。在PA与MAPK信号之间也存在关联,因为在动物细胞中,增加PA浓度可激活MAPK激酶激酶(MAPKKK)Raf1。在植物中,PA与乙烯组成性三重应答(Constitutive Triple Response 1,CTR1)结合并抑制其活性,后者是乙烯信号传导中的MAPKKK[12],PA在大豆伤害诱导MAPK的激活中也起作用[13]。
为将这些不同的信号整合在一起,Yu等[14]开展了一系列研究。首先通过生理分析以确认plda1突变体和mpk6突变体确实是盐敏感的,盐处理诱导拟南芥的PLD活性,进而研究了盐处理后所产生PA的特性。因为PA可与许多不同的蛋白结合,包括MAPK信号途径的组分[15]。在一个关键性的实验中,研究了重组MPK6蛋白是否确实与不同形式固定的PA结合。研究者发现MPK6特异性地与那些PA分子的结合,且盐分处理后得到强化;实验还表明脱落酸信号蛋白ABI1也与PA结合[16]。此外,还发现这些特定形式的PA会刺激激免疫沉淀MPK6激酶活性,这些生化发现通过遗传方面的研究而得到进一步证实,MPK6激酶活性通过盐处理而得到增强,而在plda1突变体中则未增强。外源PA和盐分添加给plda1和mpk6突变体,PA挽救了盐敏感的plda1表型而不是mpk6表型,这些结果表明因PLD而产生的PA对于MPK6所赋予的耐盐性是重要的[14]。
通过以上一系列的实验建立了盐逆境、PLD活性和MPK6活性间可信的联系,研究者以此做了进一步的推论:在酵母中,假如HOG1将Nha1 Na+/H+逆转运蛋白磷酸化,MPK6同样地与Na+/H+逆转运蛋白SOS1互作吗?对于重组的SOS1蛋白和重组的以及免疫沉淀MPK6,研究者发现MPK6也与磷酸化的SOS1互作,而在来自盐逆境植株的MPK6免疫沉淀以及将PA添加到对照植株的免疫沉淀中时,其磷酸化得到增强。
由此可将盐胁迫植物生物学的几个不同元素汇集在一起,盐胁迫中一连串的事件增加了PLD活性(也许是通过增强钙的浓度)[17],接着产生高量的PA,PA与MPK6结合并增强其活性,激活的MPK6可与SOS1结合并使其磷酸化。不过还有许多问题没有澄清,如通过MPK6使SOS1磷酸化对于增强逆转运蛋白活性是足够的且必须的吗?其中还含有其他MAP激酶吗?SOS2/SOS3与MPK6之间是什么关系?需要回答的一个主要问题是PA如何增强MAPK6活性?MAPK活化可接受的模型是上游的MAPKK使其激活域的苏氨酸和酪氨酸残基磷酸化,不过,Yu等的实验则是添加PA至来自非胁迫植株免疫沉淀的MPK6后而增强MPK活性[14];可能MPK6已经处于磷酸化状态,而PA旨在加强该激酶的活性构象。更为复杂的事实是,尽管MKK9是MPK6的上游激活子,但mkk9突变体幼苗是耐盐的[18]。很明显,其中的一些重要的细节缺失了,但是Yu等的工作在整合植物逆境生物学中3个分离的元素中向前迈出了重要的一步[19]。
NaCl进入植物细胞刺激了胞内Ca的增加,这触发了通过蛋白激酶SOS2和钙受体SOS3对质膜SOS1的刺激,磷脂酶D(PLD)活性也因Ca2+而增强,产生磷脂酸(PA),PA与MPK6结合并增加其活性,MPK6可使SOS1磷酸化,可能增强了SOS1活性并导致Na+从细胞中外流。
2 盐逆境中Cl-害的研究
了解作物耐高浓度NaCl的机制有助于改良盐土下的作物产量。盐逆境渗透阶段在有毒离子大量积累前即可延迟出叶、抑制叶片扩展、促进叶片衰老[20-21],不过这可能是一种瞬间效应,长期暴露于高盐分,一旦Na+和Cl-积累至高浓度时就会加重伤害。Na+和Cl-的离子平衡是减轻高等植物NaCl逆境的重要机制。人们常常假设盐分下过多的Na+引起生长和产量的下降[22-25],进而对Na+离子进入细胞的机制进行了大量的研究,耐盐性的排Na+机制已在分子水平上得到认识[26-28]。不过,在盐逆境下生长的植物组织中常常发现高浓度的Cl-[29-30],而对盐逆境中过多Cl-的可能毒性却关注很少。
2.1 盐逆境中Cl-害和Na+害具有同等重要性
尽管Cl-在盐土中是一种主要的阴离子,但是对高浓度Cl-对耐盐性的重要性以及耐Cl-机制的了解,比对Na+运输少很多[31-32]。既然Na+和Cl-在胞质中积累到高浓度就会产生代谢毒性,则在研究中就应给予同样的关注[21,32-34],。
氯是高度植物必需的微量营养之一,调节胞质中的酶活性,在光合作用水的光解过程中起活化剂的作用,并参与根和叶的细胞分裂,以及细胞和液泡内外的渗透调节和膨压维持,作为一种抗衡阴离子(counter anion)在细胞内外的流动直接决定了胞内外pH梯度、膜电势和相关电生理过程的变化[33-34]。
高浓度Cl-的对植物有毒,其临界毒性浓度对敏感物种为4~7mg·g-1,而对耐Cl-物种则为15~50mg·g-1[33-34]。Cl-转运体的控制和茎排Cl-与许多物种的耐盐性有关,尤其是豆科植物如三叶草[35-36]、苜蓿[37]、大豆[38]和莲[39]以及多年生树木如柑桔和葡萄[40-41]。在芸豆中发现叶片严重失绿和光合作用下降[42],高浓度Cl-引起生长速率下降。有关大豆的研究表明该物种对高浓度Cl-敏感[43-44]。研究表明豆科植物耐盐性的一个重要的生理机制是茎排氯,7个豆科Lotus物种茎中氯含量与以LD50(50%植株死亡的天数)所表示的耐盐性间相关密切,决定系数达0.65[45]。
Slabu等[46]认为生长于高浓度NaCl下的蚕豆,Na+是主要的毒性离子,因为其干扰K+的吸收,打断了有效的气孔调节,产生非生产性水分丢失以及坏死;而Cl-由于叶绿素降解而诱发失绿毒性症状。但该研究并未测定植物生长参数以检测Na+和Cl-的相对重要性。
根据大量小麦和鹰嘴豆田间试验的分析,Dang等[47]认为土壤中的Cl-浓度在减少生长和产量中比Na+更重要,所估测的表土临界Cl-浓度(定义为生长或产量减少10%时的浓度)为490mg Cl-·kg-1土。他们发现随着表土盐分水平的增加,普通小麦、硬粒小麦和鹰嘴豆最年轻成熟叶中Cl-浓度的变化比Na+浓度的变化大[48],表明Cl-毒性对生长比Na+毒性相对更重要。
高Na+和高Cl-都能减少蚕豆的生长,但植物对Cl-比对Na+更敏感。生长和光合作用的减少在NaCl逆境下更大,其效应主要为加性。高NaCl浓度的盐分可通过高浓度的Na+和高浓度Cl-的积累而同时减少生长,但2种离子的效应有差异,高Cl-浓度由于叶绿素降解而减少光合能力和量子产量,其原因可能来自高Cl-浓度对PSII的结构影响;而高Na+则是干扰了K+和Ca2+营养的吸收,扰乱了有效的气孔调节,光合作用和生长下降。这些结果表明Cl-毒性在盐逆境下生长和产量降低中的重要性可能被低估了[21]。在随后的大麦研究中也得到了类似的结果[49]。
2.2 Cl-吸收中的转运体

CCC:阳离子氯离子共运子;CHX:阳离子/H+交换子;CLC:电压门控Cl-通道;CNGC:换核苷门控通道;GLR:谷氨酸类受体;HKT:高亲和性K+转运子,KCO:K+外向整流通道;KHX:K+/H+交换子;KIR:Shaker类K+内向整流子;KOR:Shaker类外向整流子;KUP/HAK:K+吸收通透酶;NHX:Na+/H+交换子;NSCC:非选择性阳离子通道;TPK:二孔K+通道。图1 水稻盐逆境期间Na+、K+和Cl-稳态平衡中的主要基因家族[51]
由于细胞质膜存在内负外正的膜电势,因此植物细胞对Cl-的吸收和液泡对Cl-的分隔是逆电化学势梯度的主动运输过程,需要消耗一定的能量。一般认为Cl-进入细胞需依赖质膜上运输蛋白(Cl-/2H+共运子)或借助于阴离子(Cl-)通道才能完成。Cl-进入液泡常与其膜上质子泵H+-ATPase和H+-PPase驱动的H+跨膜转运相伴随,并通过其膜上的Cl-/H+逆转运子来完成,或通过阴离子(Cl-)通道来实现[34,50]。图1列出了水稻盐逆境期间Na+、K+和Cl-稳态平衡中的主要基因家族。
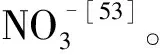
第二类潜在的Cl-转运体为阳离子氯共运子(cation chloride cotranspoters,CCCs),在拟南芥中由一个基因编码,在水稻中则由2个基因编码。AtCCC在根和茎组织中表达,可能为2Cl-:K+:Na+共转运体。拟南芥中AtCCC功能缺失导致根:茎Cl-比的改变,但Cl-的净吸收增加,从而拮抗AtCCC在该离子吸收中的作用[55]。这样,Cl-吸收的确切机制以及其中的蛋白仍是需要回答的2个问题。
2.3 Cl-通道在液胞Cl-区隔化中的作用

土根边界Na+的吸收主要通过非选择性阳离子通道如CNGCs和来自HKT家族的载体完成,在盐生植物中K+如AKT1也吸收Na+。AtHKT1;1控制茎秆中Na+的积累和Na+从韧皮部返回,HKt2;1介导水稻中Na+的高亲和吸收,也参与木质部Na+的承载,HKT1;5位于水稻韧皮部髓细胞,减少木质部Na+浓度进而减少茎中Na+的承载,Na+外流进入液胞和质外体通过逆转运系统如液胞膜上的NHX1和质膜上的SOS1进行,其机制在物种间具有保守性。SOS1也与其他的逆转运如CHXs一起介导木质部Na+的承载。氯的吸收和运输仍未清楚,氯通道(CLCs)可能在氯区隔化进液胞中起作用,氯阴离子共运子(CCCs)可能介导木质部Cl-的承载,Cl-吸收系统的机制和特征未知。
[1]Wild A.Soils,land and food:managing the land during the twenty-first century[M].Cambridge,UK:Cambridge University Press,2003.
[2]Rozema J,Flowers T.Crops for a salinized world[J].Science,2008,322:1478-1480.
[3]Fedoroff N V,Battisti D S,Beachy R N,et al.Radically rethinking agriculture for the 21st century[J].Science,2010,327:833-834
[4]Wu S J,Ding L,Zhu J K.SOS1,a genetic locus essential for salt tolerance and potassium acquisition[J].Plant Cell,1996,8:617-627.
[5]Shi H,Lee B H,Wu S J,et al.Overexpression of a plasma membrane Na+/H+antiporter gene improves salt tolerance inArabidopsisthaliana[J].NatureBiotechnology,2002,21:81-85.
[6]Rodriguez MC,Petersen M,Mundy J.Mitogen-activated protein kinase signaling in plants[J].Annual Review of Plant Biology,2010,61:621-649.
[7]Proft M,Struhl K.MAP kinase-mediated stress relief that precedes and regulates the timing of transcriptional induction[J].Cell,2004,118:351-361.
[8]Nakagami H,Pitzschke A,Hirt H.Emerging MAP kinase pathways in plant stress signalling[J].Trends in Plant Science,2005,10:339-346.
[9]Ichimura K,Mizoguchi T,Yoshida R,et al.Various abiotic stresses rapidly activate Arabidopsis MAP kinases ATMPK4 and ATMPK6[J].Plant Journal,2000,24:655-665.
[10]Teige M,Scheikl E,Eulgem T,et al.The MKK2 pathway mediates cold and salt stress signaling in Arabidopsis[J].Molecular Cell1,2004,5:141-152.
[11]Bargmann B O,Munnik T.The role of phospholipase D in plant stress responses[J].Current Opinion in Plant Biology,2006,9:515-522.
[12]Testerink C,Larsen P B,van der Does D,et al.Phosphatidic acid binds to and inhibits the activity ofArabidopsisCTR1[J].Journal of Experimental Botany,2007,58:3905-3914.
[13]Lee S,Hirt H,Lee Y.Phosphatidic acid activates a wound-activated MAPK inGlycinemax[J].Plant Journal,2001,26:479-486.
[14]Yu L,Nie J,Cao C,et al.Phosphatidic acid mediates salt stress response by regulation of MPK6 inArabidopsisthaliana[J].New Phytologist,2010,188:762-773.
[15]Testerink C,Dekker H L,Lim Z Y,et al.Isolation and identification of phosphatidic acid targets from plants[J].Plant Journal,2004,39:527-536.
[16]Zhang W,Qin C,Zhao J,et al.Phospholipase D alpha 1-Derived phosphatidic acid interacts with ABI1 phosphatase 2C and regulates abscisic acid signaling[J].Proceedings of the National Academy of Sciences,USA,2004,101:9508-9513.
[17]Pappan K,Zheng S,Wang X.Identification and characterization of a novel plant phospholipase D that requires polyphosphoinositides and submicromolar calcium for activity inArabidopsis[J].Journal of Biological Chemistry,1997,272:7048-7054.
[18]Alzwiy IA,Morris P C.A mutation in theArabidopsisMAP kinase kinase 9 gene results in enhanced seedling stress tolerance[J].Plant Science,2007,173:302-308.
[19]Peter C Morris.Integrating lipid signalling,mitogen-activated protein kinase cascades and salt tolerance[J].New Phytologist,2010,188:640-643.
[20]Rajendran K,Tester M,Roy S J.Quantifying the three main components of salinity tolerance in cereals[J].Plant,Cell and Environment,2009.32:237.
[21]Tavakkoli E,Rengasamy P,Mcdonald G K.High concentrations of Na+and Cl-ions in soil solution have simultaneous detrimental effects on growth of faba bean under salinity stress[J].Journal of Experimental Botany,2010,61:4449-4459
[22]Kingsbury R,Epstein E.Salt sensitivity in wheat.A case for specific ion toxicity[J].Plant Physiology,1986,80:651-654.
[23]Chi Lin C,Huei Kao C.Relative importance of Na+,Cl-,and abscisic acid in NaCl induced inhibition of root growth of rice seedlings[J].Plant and Soil,2001,237:165-171.
[24]Tsai Y C,Hong C Y,Liu L F,et al.Relative importnace of Na+and Cl-in NaCl-induced antioxidant systems in roots of rice seedlings[J].Physiologia Plantarum,2004,122:86-94.
[25]Hong C Y,Chao Y Y,Yang M Y,et al.Na+but not Cl-or osmotic stress is involved in NaCl-induced expression of glutathione reductase in roots of rice seedlings[J].Journal of Plant Physiology,2009,166:1598-1606.
[26]Amtmann A,Sanders D.Mechanisms of Na uptake by plant cells[J].Advances in Botanical Research,1998,29:75-112.
[27]Tester M,Davenport R.Na+tolerance and Na+transport in higher plants[J].Annals of Botany,2003,91:503-527.
[28]Apse M P,Blumwald E.Na+transport in plants[J].FEBS Letters,2007,581:2247-2254.
[29]Gorham J.Salt tolerance in the Triticeae:ion discrimination in rye and triticale[J].Journal of Experimental Botany,1990,41:609-614.
[30]Kingsbury R,Epstein E.Salt sensitivity in wheat.A case for specific ion toxicity[J].Plant Physiology,1986,80:651-654.
[31]Britto D T,Ruth T J,Lapi S,et al.Cellular and whole-plant chloride dynamics in barley:insights into chloride-nitrogen interactions and salinity responses[J].Planta,2004,218:615-622.
[32]Teakle N L,Tyerman S D.Mechanisms of Cl transport contributing to salt tolerance[J].Plant,Cell and Environment,2010,33:566-589.
[33]Xu G,Magen H,Tarchitzky J,et al.Advances in chloride nutrition of plants[J].Advances in Agronomy,2000,68:97-150.
[34]White P J,Broadley M R.Chloride in soils and its uptake and movement within the plant:a review[J].Annals of Botany,2001,88:967-988.
[35]Winter E.Salt tolerance of Trifolium alexandrinum L.II.Ion balance in relation to its salt tolerance[J].Australian Journal of Plant Physiology,1982,9:227-237.
[36]Rogers M E,Noble C L,Pederick R J.Identifying suitable forage legume species for saline areas[J].Australian Journal of Experimental Agriculture,1997,37:639-645.
[37]Sibole J V,Cabot C,Poschenrieder C,et al.Efficient leaf partitioning,an overriding condition for abscisic acid-controlled stomatal and leaf growth responses to NaCl salinization in two legumes[J].Journal of Experimental Botany,2003,54:2111-2119.
[38]Luo Q,Yu B,Liu Y.Differential sensitivity to chloride and sodium ions in seedlings of Glycine max and G.soja under NaCl stress[J].Journal of Plant Physiology,2005,162,1003-1012.
[39]Teakle N L,Flowers T J,Real D,et al.Lotus tenuis tolerates the interactive effects of salinity and waterlogging by ‘excluding’ Na+and Cl-from the xylem[J].Journal of Experimental Botany,2007,58:2169-2180.
[40]Romero-Aranda R,Moya J L,Tadeo F R,et al.Physiological and anatomical disturbances induced by chloride salts in sensitive and tolerant citrus:beneficial and detrimental effects of cations[J].Plant,Cell and Environment,1998,21:1243-1253.
[41]Moya J L,Gomez-Cadenas A,Primo-Millo E,et al.Chloride absorption in salt-sensitive Carrizo citrange and salt-tolerant Cleopatra mandarin citrus rootstocks is linked to water use[J].Journal of Experimental Botany,2003,54:825-833.
[42]Hajrasuliha S.Accumulation and toxicity of chloride in bean plants[J].Plant and Soil,1980,55:133-138
[43]Lauchli A,Wieneke J Z.Studies on growth and distribution of Na,K and CI in soybean varieties differing in salt tolerance[J].Pflanzenernaehrung Bodenkunde,1979,142:3-13.
[44]Parker M B,Gascho G J,Gaines TP.Chloride toxicity of soybeans grown on atlantic coast flat woods soils[J].Agronomy Journal,1983,75:439-443.
[45]Sanchez D H,Pieckenstain F L,Szymanski J,et al.Comparative functional genomics of salt stress in related model and cultivated plants identifies and overcomes limitations to translational genomics[J].PLOS one,2011,6 (2),e17094
[46]Slabu C,Zörb C,Steffens D,et al.Is salt stress of faba bean (Viciafaba) caused by Na+or Cl-toxicity?[J].Journal of Plant Nutrition and Soil Science,2009,172:644-650.
[47]Dang Y P,Dalal R C,Mayer D G,et al.High subsoil chloride concentrations reduce soil water extraction and crop yield on vertisols in north-eastern Australia[J].Australian Journal of Agricultural Research,2008,59:321-330.
[48]Dang Y P,Dalal R C,Routley R,et al.Subsoil constraints to grain production in the cropping soils of the north-eastern region of Australia:an overview[J].Australian Journal of Experimental Agriculture,2006,46:19-35.
[49]Tavakkoli E,Fatehi F,Coventry S,et al.Additive effects of Na+and Cl-ions on barley growth under salinity stress[J].Journal of Experimental Botany,2011,62(6):2189-2203
[50]Hasegawa P M,Bressan R A,Zhu J K,et al.Plant cellular and molecular responses to high salinity[J].Annu Rev Plant Physiol Mol Biol,2000,51:463-499.
[51]Mian A A,Senadheera P,Maathuis F J M.Improving crop salt tolerance:anion and cation transporters as genetic engineering targets[J].Plant Stress,2011,5(Special Issue 1):64-72
[52]Flower T J,Colmer T D.The mechanism of salt tolerance in plant[J].New Phytologist,2002,179:945-963.
[53]Hechenberger M,Schwappach B,Fisher W N,et al.A family of putative chloride channel fromArabidopsisand functional complementation of a yeast strain with aCLCgene disruption[J].Journal of Biological Chemistry,1996,271:33632-33638.
[54]Diédhiou C J,Golldack D.Salt-dependent regulation of chloride channel transcript in rice[J].Plant Science,2006,170:793-800.
[55]Colmenero-Flores J M,Martinez G,Gamba G,et al.Identification and functional characterization of cation-chloride cotransporters in plant[J].The Plant Journal,2007,50:278-292.
[56]De Angeli A,Thomine S,Frachisse J M,et al.Anion channels and transporters in plant cell membranes[J].FEBS Letters,2007,581:2367-2374.
[57]Diédhiou C J.Mechanisms of salt tolerance:sodium,chloride and potassium homeostasis in two rice lines with differenct tolerance to salinity stress[D].Germany:University of Bielefeld,2006.
[58]Li W Y F,Wong F L,Tsai S N,et al.Tonoplast-located GmCLC1 and GmNHX1 from soybean enhance NaCl tolerance in transgenic bright yellow (BY)-2 cells[J].Plant,Cell and Environment,2006,29:1122-1137.
[59]Nakamura A,Fukuda A,Sakai S,et al.Molecular cloning,functional expression and subcellular localization of two putative vacuolar voltage-gated chloride channels in rice (OryzasativaL.)[J].Plant Cell Physiology,2006,47:32-42.
2012-08-22
江苏省自主创新基金项目。
崔世友(1964-),男,江苏海安人,博士,研究员,研究方向为分子遗传与作物育种、盐土农业。
10.3969/j.issn.1673-1409(S).2012.10.005
Q945.78
A
1673-1409(2012)10-S017-06
