拟南芥角果角度相关基因SPA的分子鉴定与功能分析
2012-11-14张盛春阳成伟
张盛春, 阳成伟
(华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广东广州 510631)
拟南芥角果角度相关基因SPA的分子鉴定与功能分析
张盛春, 阳成伟*
(华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广东广州 510631)
利用T-DNA插入突变的方法从拟南芥中筛选得到1个角果果柄生长角度变小的突变体,克隆得到该突变基因为SPA基因,并利用PCR和RT-PCR方法验证了T-DNA的插入位点;将SPA基因转入spa突变体后,互补植株角果角度恢复到野生型水平.推测SPA基因可能在调控角果角度方面具有重要功能.
拟南芥; 角果角度;SPA基因; TAIL-PCR
角果是来自于植物茎尖分生组织的一种侧生器官[1].花梗或者角果果柄与花序轴茎之间的角度对植物花序的形态特征至关重要,不仅能影响观赏植物的美观,更有可能影响植物的产量[2].
目前在模式植物拟南芥中已有一些与花梗发育的相关基因被分离鉴定,比如说POL和PLL1基因通过与ERECTA基因相互作用调控花柄的长度[3];AtEXP10介导花梗的离层形成[4];AtMYB13基因能够使花梗末端形成弯钩[5].但是对于调控果柄角度基因的分离和鉴定非常少.KNAT1基因缺失突变后产生向下生长的角果[6].生长素信号突变体axr6的角果与花序轴的夹角为明显的锐角[7]. 一般情况下,野生型角果与花茎之间的角度约为60°,拟南芥G蛋白ROP2基因过量表达则能达到90°或者90°以上,而抑制突变体则全部要小于60°[8].肌动蛋白丝成束蛋白基因VILLIN2和VILLIN3双突变体vln2vln3的角果角度变小[9].侧生器官边界基因BOP1和BOP2蛋白通过LBD来调控角果角度,BOP1和BOP2过量表达植株的角果向下生长[10],而bop1bop2双突变体的角果则直立向上生长,与花序轴茎的夹角明显小于野生型的[11].芸薹属植物与拟南芥同属十字花科,目前对有关芸薹属植物如油菜的基因组的了解还不清楚,因此拟南芥的分子生物学研究对芸薹属作物的应用基础研究至关重要.
作者在研究前期以农杆菌介导植物表达载体pCAMBIA1300转化野生型拟南芥,利用T-DNA插入突变体的方法构建了拟南芥突变体库.在该突变体库中作者发现了1个花柄/果柄与花序轴夹角变小的突变体spa,相对应的基因被命名为SPA(Small Pedicel Angle,SPA).本论文利用分子生物学方法分离鉴定SPA,并对其功能进行了验证,为从模式植物拟南芥中发掘角果角度相关基因奠定基础,为作物改良提供基因资源具有重要意义.
1 材料与方法
1.1植物材料
拟南芥(ArabidopsisthalianaL.) 为Columbia-0生态型,SPA基因号为At2g26140. 种子先用体积分数为70%乙醇溶液表面消毒30 s后,加入质量分数为10% 次氯酸钠消毒10 min,无菌水冲洗4~5次后均匀铺种于MS平板.4 ℃保湿黑暗冷藏3 d.打破休眠后,移至培养房中培养,10 d后移至土壤中生长,培养温度为22±2 ℃, 光暗周期为16 h光照/8 h黑暗,光照强度为120~150 μmol/(m2·s).
1.2 转基因拟南芥的获得
采用改造过的植物表达载体pCAMBIA1390,利用引物5′- AGTTCTAGAATGGCTTGGAGGCGCATC-3′和5′- ACTGGATCCTTACGATACTGGCGCCATGTC-3′,把SPA基因的CDS连接到T载体克隆后,测序正确的基因片段利用XbaⅠ和BamHⅠ双酶切后,与相同酶切后的植物表达载体连接.以pCAMBIA1390质粒为对照,连接后的质粒转化农杆菌LBA4404,采用花粉管浸泡法转化拟南芥,潮霉素筛选转基因植株并用PCR进行检测,单位点插入的纯合转基因株系用于后续实验.
1.3半定量RT-PCR
利用TRIzol试剂 (Invitrogen)提取总RNA后,用DNAaseⅠ(Takara) 处理以消除基因组DNA的污染.定量后取等量的RNA利用PrimeScriptTM反转录试剂盒(Takara)进行cDNA第一链合成,再取等量的cDNA为模板进行PCR反应,反应26个循环,取15 μL PCR产物电泳检测.
检测目的基因SPA的引物为5′- AGTTACTGGAGCTGTGGGTGGTG -3′和5′- TTTGCCAATTCCTCTGTCCTCG-3′;内参Actin基因的引物为5′ -GTATGTGGCTATTCAGGCTGT-3′和5′ -CTGGCGGTGCTTCTTCTCTG-3′.
1.4 Tail-PCR及PCR验证
拟南芥基因组DNA用经典的CTAB 法提取.利用刘耀光等[12]所使用的TAIL-PCR方法克隆突变体T-DNA 插入区侧翼序列,所使用的特异引物序列、随即引物序列以及PCR的反应程序均与文献中的一致.
PCR验证时在T-DNA上所选用的特异序列为左边界引(LB):5′-ATCCAGTACTAAAATCCAGATCCCCCG-3′,在插入位点左边侧翼序列即左边基因组序列上所设选的基因组引物为左侧基因组引物 (LG), 在插入位点右边侧翼序列即右边基因组序列上所设选的基因组引物为右侧基因组引物(RG),分别将LB、LG、RG 3条引物进行两两组合,以野生型和突变体DNA为模板进行PCR反应.
1.5 角果角度测定
采用量角器测量花梗/果柄与花序轴之间的角度,拍照并测定相关数据.每次对每种基因型植物测量32棵不同植株,测量每棵植株的所有角果,3次生物学重复.
2 结果与分析
2.1 突变体的表型分析
在野生型植株中,角果的生长角度一般呈60°左右,即为斜生型角果(图1A).在spa突变体中,除开花序轴最下面即最先长出的5个角果角度与野生型植株基本一致外,其它角果与花序轴之间的角度明显变小,部分角果与花序轴平行,突变体角果与花序轴之间的夹角平均只有30°左右,呈典型的平生型角果(图1B, C).

α:角果与花序轴之间的夹角;Col:野生型植株;spa:突变体植株
2.2 突变体基因的鉴定
作者利用TAIL-PCR的方法寻找T-DNA在拟南芥基因组中的插入位点.通过设计T-DNA边界特异引物以及兼并引物,2轮PCR反应后得到了清晰的目的条带(图2A中第2条泳道中的产物),切胶回收后测序,得到的序列片段进行BLAST比对分析后发现目前片段中一部分为T-DNA序列,而另一部分为一个蛋白酶基因DNA的序列(即为SPA基因).与T-DNA特异序列相连的DNA片段从SPA基因5′-UTR区域的前5个碱基开始,表明T-DNA插入在SPA基因的启动子区域.
为了更进一步确定该T-DNA的确切插入位点,设计了T-DNA左边界的特异引物(LB,Left Board),以及可能插入位点两侧的基因组DNA引物.分别利用T-DNA的左边界引物与左侧基因组引物(LG,Left Genomic primer)、T-DNA的左边界引物与右侧基因组引物(RG,Right Genomic primer)以及左、右侧基因组引物对野生型与突变体的基因组进行扩增.如果T-DNA确实插入在该位置的话,则在野生型植株中只有左、右侧基因组引物能够扩增出相应大小的基因片段条带;而在突变体中则T-DNA的左边界引物与左侧基因组引物能扩增出相应的目的片段,但是由于T-DNA比较大,使左、右侧基因组引物对以及T-DNA的左边界引物与右侧基因组引物均在突变体中扩增不出DNA片段.结果表明,野生型植株中确实只有左、右侧基因组引物对能够扩增出预期大小的目的片段(图2B泳道3),spa突变体除开左、右侧基因组引物对外(图2B泳道6),另外2组引物均能扩增出预期大小的目的片段(图2B泳道4和5),说明spa突变体中T-DNA确实插入在SPA基因的启动子区域,并且有2个相同的T-DNA反向串联插入在该位置,从而导致T-DNA的左边界引物与右侧基因组引物也能够在突变体中扩增出相应的DNA片段.
在研究拟南芥功能基因过程中,T-DNA插入在基因上游启动子调控区域时一般会导致基因表达量的降低或者增加.利用RT-PCR检测了野生型和突变体中SPA基因的表达结果的表明,突变体中SPA基因的表达量相对于野生型植株明显下调,只能检测到非常微量的表达(图2C),相当于SPA基因的功能缺失突变体,说明spa突变体的表型可能是由于T-DNA插入到SPA基因启动子区域导致SPA基因表达的下调所引起的.

图2A中M为分子标准;1为第1轮TAIL-PCR产物;2为第2轮TAIL-PCR产物.图2B中Col为野生型植株;spa为突变体植株;1和4为LB与LG引物对的产物;2和5为LB与RG引物对的产物;3和6为LG与RG引物对的产物.
2.3SPA基因表达
花梗/角果果柄与花序轴之间的角度变化这一表型与花序轴以及果柄的结构和功能均有关,RT-PCR分析了SPA基因在相关组织器官表达.结果显示,SPA基因在花序轴、果柄以及角果中的均有表达,表达量较高(图3),表明SPA基因的表达与功能具有明显的相关性.

图3 SPA基因表达
2.4 SPA基因的功能互补
利用SPA基因的CDS序列构建好互补载体并转化spa突变体植株,筛选纯合后,对野生型、突变体以及互补转基因植株(SPA-spa)中的SPA基因表达量进行了检测,结果显示在spa突变体的互补植株中,SPA基因的表达水平恢复到了野生型水平(图4),表明互补植株能够用于下一步的表型分析.
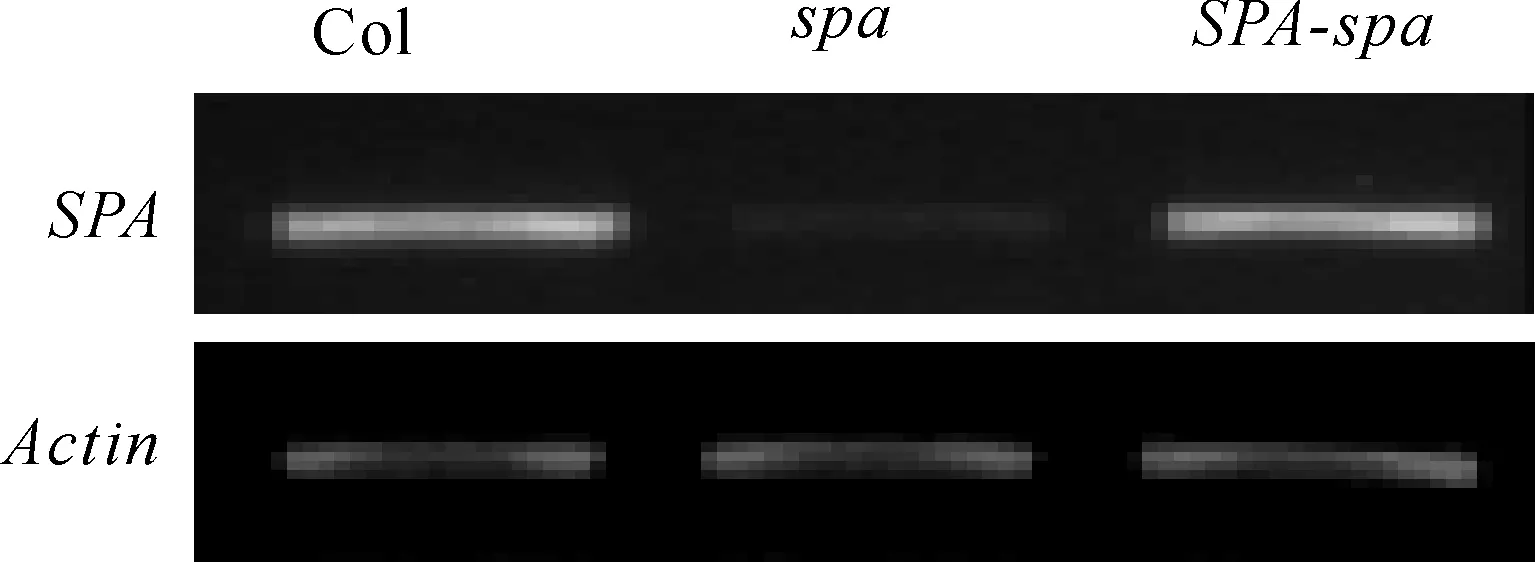
Col:野生型植株;spa:spa突变体;SPA-spa:spa突变体互补植株
进一步对野生型植株、spa突变体以及互补植株的角果角度进行了统计分析.结果显示SPA基因转入到spa突变体后,能够使突变体角果角度从原来的30°左右恢复到野生型的60°左右(表1),表明spa突变体中角果与花序轴夹角变小的表型确实是由于SPA基因的表达缺失所引起的.
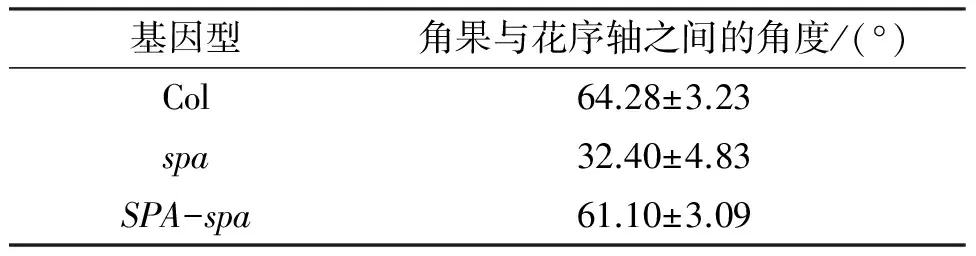
表1 SPA基因恢复spa突变体角果夹角大小Table 1 SPA gene rescues the silique angle of the spa mutant
3 讨论
油菜在终花期以后,叶片枯萎脱落,主要靠绿色的角果进行光合作用,籽粒灌浆的干物质有一半以上由角果皮制造提供[13].因此,维持角果果皮的光合效率对提高粒数、粒重有重要的意义.角果的生长角度对其光能吸收具有重要影响,主要由果柄所决定.果柄由花柄发育而成,成熟时果柄与花序轴所成角度的大小以及角果在果柄上的生长状态与产量密切相关.因此,拟南芥角果生长角度相关基因SPA的发现与鉴定对芸薹属作物如油菜的产量具有重要意义,能够为培育理想角果角度的油菜品种提供分子基础.
目前调控拟南芥角果与花序轴角度基因分离鉴定还较少,相关的机理研究还不够深入.已有的研究主要集中在KNOX(knotted-like homeobox)基因KNAT1对角果调控中的功能.拟南芥中KNOX基因家族分为2大类,其中STM,KNAT1,KNAT2以及KNAT6属于第一类.KNAT1在调控花序轴发育过程中起重要作用,其同源基因BREVIPEDICELLUS(BP)基因的突变体bp-1和bp-2的花梗以及角果均向下生长,主要是由于花梗远轴面表皮细胞和周皮细胞的细胞分化、伸长以及细胞数目受到严重的抑制,而近轴面得细胞则基本正常生长,因此导致了花梗两侧的不对称生长,从而使花梗生长方向向下[6].BOP1和BOP2在bp突变体中失去作用后能够恢复bp突变体角果向下生长的表型,bop1bop2bp-1三突变体的角果角度与野生型植株的基本一致,表明BP基因通过BOP1和BOP2的作用来调控花梗的角度[11].同样,在bp突变体中敲除KNAT6基因后即bpknat6双突变体能够部分恢复bp突变体角果的角度,而同时敲除KNAT6和KNAT2后,bpknat2knat6突变体的角果角度能够完全恢复到野生型的大小,表明KNAT2和KNAT6在BP基因的下游起作用[14].另外,knat6功能缺失突变体能够恢复BOP2基因过量表达植株角果角度向下生长的表型,表明BOP1和BOP2基因是通过KNAT6基因起作用[11].因此目前拟南芥中调控角果果柄/花梗与花序轴主茎之间角度的分子生物学通路BREVIPEDICELLUS(BP)-BOP1/BOP2-KNAT6一条串联途径比较清楚,这条发育途径受到其他调控基因的调节未见报道.BOP2基因还能够促进木质素的形成,从而使花序轴以及花梗中的细胞分化提前,影响了次生壁的形成,从而导致了过量表达植株角果果柄的支撑力不够从而往下垂[11],而BP基因在调控木质素形成过程中的功能与BOP2基因相反[15].
本文鉴定得到的SPA基因是一个新的调控角果生长角度的基因,通过功能互补实验验证了SPA基因的功能缺失对角果生长具有重要作用,后续研究将研究spa突变体花梗/果柄的木质素合成是否受到影响,以及其近轴面、远轴面的表皮细胞和周皮细胞的分裂、伸长以及分化是否受到影响,从细胞生物学角度探究spa突变体中角果角度变小的细胞生物学机制.另外,研究已知的与角果角度相关的基因如BP、BOP1、BOP2等在spa突变体中的表达,并把spa与角果角度相关突变体如bp、bop1、bop2等进行杂交,从分子生物学角度和遗传学角度为阐明SPA基因调控角果角度的机制提供证据.
[1] DOUGLAS S J, RIGGS C D. Pedicel development in Arabidopsis thaliana: Contribution of vascular positioning and the role of the BREVIPEDICELLUS and ERECTA genes[J]. Dev Biol, 2005, 284:451-463.
[2] WANG Y, LI J. Molecular basis of plant architecture[J]. Annu Rev Plant Biol, 2008, 59: 253-279.
[3] SONG S K, CLARK S E. POL and related phosphatases are dosage-sensitive regulators of meristem and organ development in Arabidopsis[J]. Dev Biol, 2005, 285: 272-284.
[4] CHO H T, COSGROVE D J. Altered expression of expansin modulates leaf growth and pedicel abscission in Arabidopsis thaliana[J]. Proc Natl Acad Sci U S A, 2000, 97: 9783-9788.
[5] KIRIK V, KOLLE K, WOHLFARTH T, et al. Ectopic expression of a novel MYB gene modifies the architecture of the Arabidopsis inflorescence[J]. Plant J, 1998, 13: 729-742.
[6] VENGLAT S P, DUMONCEAUX T, ROZWADOWSKI K, et al. The homeobox gene BREVIPEDICELLUS is a key regulator of inflorescence architecture in Arabidopsis[J]. Proc Natl Acad Sci U S A, 2002, 99: 4730-4735.
[7] HOBBIE L, MCGOVERN M, HURWITZ L R, et al. The axr6 mutants of Arabidopsis thaliana define a gene involved in auxin response and early development[J]. Development, 2000, 127: 23-32.
[8] LI H, SHEN J J, ZHENG Z L et al. The Rop GTPase switch controls multiple developmental processes in Arabidopsis[J]. Plant Physiol, 2001, 126: 670-684.
[9] VAN DER HONING H S, KIEFT H, EMONS A M, et al. Arabidopsis VILLIN2 and VILLIN3 are required for the generation of thick actin filament bundles and for directional organ growth[J]. Plant Physiol, 2012, 158: 1426-1438.
[10] HA C M, JUN J H, NAM H G, et al. BLADE-ON-PETIOLE 1 and 2 control Arabidopsis lateral organ fate through regulation of LOB domain and adaxial-abaxial polarity genes[J]. Plant Cell, 2007, 19: 1809-1825.
[11] KHAN M, XU M, MURMU J, et al. Antagonistic interaction of BLADE-ON-PETIOLE1 and 2 with BREVIPEDICELLUS and PENNYWISE regulates Arabidopsis inflorescence architecture[J]. Plant Physiol, 2012,158: 946-960.
[12] LIU Y G, CHEN Y. High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J]. Biotechniques, 2007, 43: 649-650, 652, 654.
[13] LENG S H, ZHU G R, DENG X L.Studies on the sources of the dry matter in the seed of rapeseed[J]. Acta Agron Sin, 1992, 18: 250-257.
[14] RAGNI L, BELLES-BOIX E, GUNL M, et al. Interaction of KNAT6 and KNAT2 with BREVIPEDICELLUS and PENNYWISE in Arabidopsis inflorescences[J]. Plant Cell, 2008, 20: 888-900.
[15] MELE G, ORI N, SATO Y, et al. The knotted1-like homeobox gene BREVIPEDICELLUS regulates cell differentiation by modulating metabolic pathways[J]. Genes Dev, 2003, 17: 2088-2093.
IdentificationandFunctionAnalysisoftheSiliqueAngleGeneSPAinArabidopsis
ZHANG Shengchun, YANG Chengwei*
(Guangdong Provincial Key Lab of Biotechnology for Plant Development, College of Life Sciences, South China Normal University, Guangzhou 510631, China)
A decreased silique pedicel angle mutant was obtained by the T-DNA insertion method inArabidopsis(Arabidopsisthaliana). The mutantSPAgene was cloned using the TAIL-PCR method, and the insertion site was verified by the PCR and RT-PCR. After transformed with theSPAgene, the silique angle of thespamutant can be rescued to the size of the wild type plants. These results suggest thatSPAmay play important roles in regulating plant silique angle.
2012-03-20
国家自然科学基金项目(30900789)
*通讯作者,yangchw@scnu.edu.cn
1000-5463(2012)03-0107-05
J653
A
10.6054/j.jscnun.2012.06.023
Keywords:Arabidopsisthaliana; silique angle;SPAgene; TAIL-PCR
【责任编辑 成 文】
