Toll样受体9和低氧诱导因子1α在胰腺癌中的表达及其意义
2012-11-06吴汉青王博范平吴河水
吴汉青 王博 范平 吴河水
·论著·
Toll样受体9和低氧诱导因子1α在胰腺癌中的表达及其意义
吴汉青 王博 范平 吴河水
目的研究Toll样受体9(TLR9)和低氧诱导因子1α(HIF-1α)在胰腺癌组织中的表达,探讨其临床意义。方法采用实时定量PCR法、蛋白质印迹法及免疫组织化学法检测30例胰腺癌组织及其相邻癌旁组织、10例正常胰腺组织中TLR9和HIF-1α的表达,分析两者表达的相关性、与肿瘤临床病理特征的关系以及对患者生存时间的影响。结果胰腺癌TLR9 mRNA及HIF-1αmRNA表达量分别为正常胰腺组织的2.32(1. 41~3.22)倍和2.26(1.62~2.89)倍,癌旁组织表达量分别为正常胰腺组织的1.23(1.18~1.28)倍和1.36(1.17~1.55)倍,胰腺癌的表达量显著高于癌旁组织(t=2.642,P=0.023;t=4.076,P=0.001)。胰腺癌组织TLR9和HIF-1α蛋白阳性表达率分别为73.3%(22/30)和70.0%(21/30),癌旁组织分别为33.3%(10/30)和36.7%(11/30),正常胰腺组织分别为20%(2/10)和10%(1/10),呈递减趋势(χ2=13.99,P=0.001;χ2=13.15,P=0.001)。胰腺癌组织TLR9 mRNA与HIF-1α mRNA表达呈正相关(r=0.537,P=0.003),TLR9和HIF-1α蛋白阳性表达率亦呈正相关(r=0.511,P=0.001)。胰腺癌组织TLR9和HIF-1α表达与肿瘤分化程度、TNM分期、淋巴结转移呈正相关,与患者的生存时间呈负相关。结论胰腺癌组织TLR9和HIF-1α基因均高表达,且与肿瘤细胞的恶性生物学行为及患者预后差有关。
胰腺肿瘤; Toll样受体9; 低氧诱导因子1α
Toll样受体9(Toll-like receptor,TLR9)为TLR家族重要成员,能够刺激B细胞和树突状细胞分泌大量的细胞因子和趋化因子,参与多种恶性肿瘤的发生、发展过程[1]。TLR9不仅表达于免疫细胞,也表达于多种肿瘤细胞[2]。低氧诱导因子1(hypoxia-inducible factor 1,HIF-1)是最重要的低氧信号传递因子,调控一系列促进血管生成、细胞存活、糖酵解、细胞增殖、肿瘤浸润的基因表达[3]。本研究检测胰腺癌组织TLR9和HIF-1α的表达,探讨它们在胰腺癌发生、发展中的作用。
资料与方法
一、临床资料
收集华中科技大学同济医学院附属协和医院胰腺外科中心2008年12月至2010年8月接受手术治疗并经病理证实的30例胰腺癌组织及距肿瘤边缘1~2 cm处的癌旁胰腺组织。10例正常胰腺组织标本取自其他原因需行胰腺部分切除的非肿瘤患者,且经术后病理证实。40例患者中男19例,女11例;年龄39~75岁,平均57岁。30例胰腺癌患者术前均未行放疗及化疗,术后常规化疗,定期随访,随访截止日期为2011年12月31日。28例获得完整随访,失访2例。
二、TLR9、HIF-1α mRNA检测
参照Trizol试剂盒(Sigma公司)说明书提取组织总RNA。根据GenBank人TLR9 mRNA设计引物序列。TLR9上游为5′-GCCCAAATCCCTCATATCCC-3′,下游为:5′-AACAGTTGCCGTCCATGAATAG-3′,扩增产物113 bp;HIF-1α上游为5′-TGAAGT-GTACCCTAACTAGCCG-3′,下游为5′-AATCAGCACCAAGCAGGTCATAG-3′,扩增产物158 bp。内参β-actin上游为5′-GTCCACCGCAAATGCTTCTA-3′,下游为5′-TGCTGTCACCTTCACCGTTC-3′,扩增产物190 bp。引物由上海生工技术服务有限公司合成。用ReverTra Ace(Toyobo公司)逆转录合成cDNA。采用实时PCR检测TLR9、HIF-1α mRNA。反应程序:50℃ 2 min,95℃ 2 min,然后95℃ 15 s,58℃ 15 s, 72℃ 45 s,40个循环,最后72℃延伸10 min。通过PCR仪(HONGSHI公司)自带软件获取检测样本的△CT(CT目的基因-CTβ-actin),以10例正常胰腺组织的△CT均值作为对照,计算△△CT(△CT癌或癌旁组织-△CT对照组织),通过公式2-△△CT计算mRNA扩增倍数。
三、TLR9、HIF-1α蛋白检测
常规提取组织蛋白,采用蛋白质印迹法检测TLR9、HIF-1α蛋白表达。兔抗人TLR9单抗1∶750稀释,鼠抗人HIF-lα单抗(cell signaling公司)1∶500稀释。最后ECL发光,X胶片曝光、显影、定影。采用自动电泳凝胶成像分析软件(Band scan v5.0)进行图像扫描和分析。
对固定的组织常规包埋、切片,采用免疫组织化学试剂盒(武汉博士德公司)检测TLR9和HIF-1α,按说明书操作。用PBS代替一抗作为阴性对照。细胞质呈现棕黄色颗粒为阳性。由病理科医师双盲法阅片,根据着色强度和阳性细胞百分比进行半定量分析。无着色为0分,黄色为1分,棕黄色为2分,黄褐色为3分;无阳性细胞为0分,阳性细胞<25%为1分,25%~49%为2分,≥50%为3分。两个分值相加,0~3分为低表达,≥4分为高表达。
四、统计学处理
结 果
一、TLR9、HIF-1α mRNA表达
正常胰腺组织TLR9、HIF-1α mRNA低表达。胰腺癌及癌旁组织TLR9 mRNA的表达量分别是正常胰腺组织的2.32(1.41~3.22)倍及1.23(1.18~1.28)倍; HIF-1α mRNA的表达量分别是正常胰腺组织的2.26(1.62~2.89)倍及1.36(1.17~1.55)倍。胰腺癌组织的表达均显著高于癌旁组织(t=2.642,P=0.023;t=4.076,P=0.001)。胰腺癌组织TLR9 mRNA与HIF-lα mRNA表达呈正相关(r=0.537,P=0.003)。
二、TLR9、HIF-1α蛋白表达
蛋白质印迹法显示,胰腺癌、癌旁组织、正常胰腺组织TLR9蛋白表达量分别为0.815±0.092、0.511±0.067、0.133±0.076;HIF-1α蛋白表达量分别为0.923±0.084、0.413±0.077、0.112±0.059。癌组织的表达量显著高于癌旁组织及正常胰腺组织(图1)。

图1 TLR9及HIF-1α蛋白表达
免疫组化法显示,TLR9蛋白主要表达于癌细胞的胞质内,HIF-1α蛋白表达于胞质和胞核。癌旁及正常胰腺组织见少量胰腺腺泡细胞TLR9及HIF-1α蛋白弱表达 (图2)。正常胰腺组织、胰腺癌旁组织和胰腺癌组织的TLR9阳性表达率分别为20%(2/10)、33.3%(10/30)和73.3%(22/30);HIF-1α阳性表达率分别为10%(1/10)、36.7%(11/30)和70.0%(21/30)。从正常、癌旁到胰腺癌组织,TLR9及HIF-1α的阳性表达率呈递增趋势,各组间差异有统计学意义(χ2值分别为13.99、13.15,P=0.001)。在胰腺癌组织中,TLR9和HIF-1α蛋白阳性表达率呈正相关(r=0.511,P=0.001)。

图2TLR9(上)及HIF-1α(下)在胰腺癌组织(a)、癌旁组织(b)及正常胰腺组织(c)中的表达(免疫组化 ×200)
三、TLR9、HIF-1α表达与临床病理特征的关系
TLR9、HIF-1α的表达与肿瘤部位及肿瘤大小无关(P值均>0.05),而与淋巴结转移、肿瘤分化程度和临床TNM分期有关(P值均<0.05,表1)。
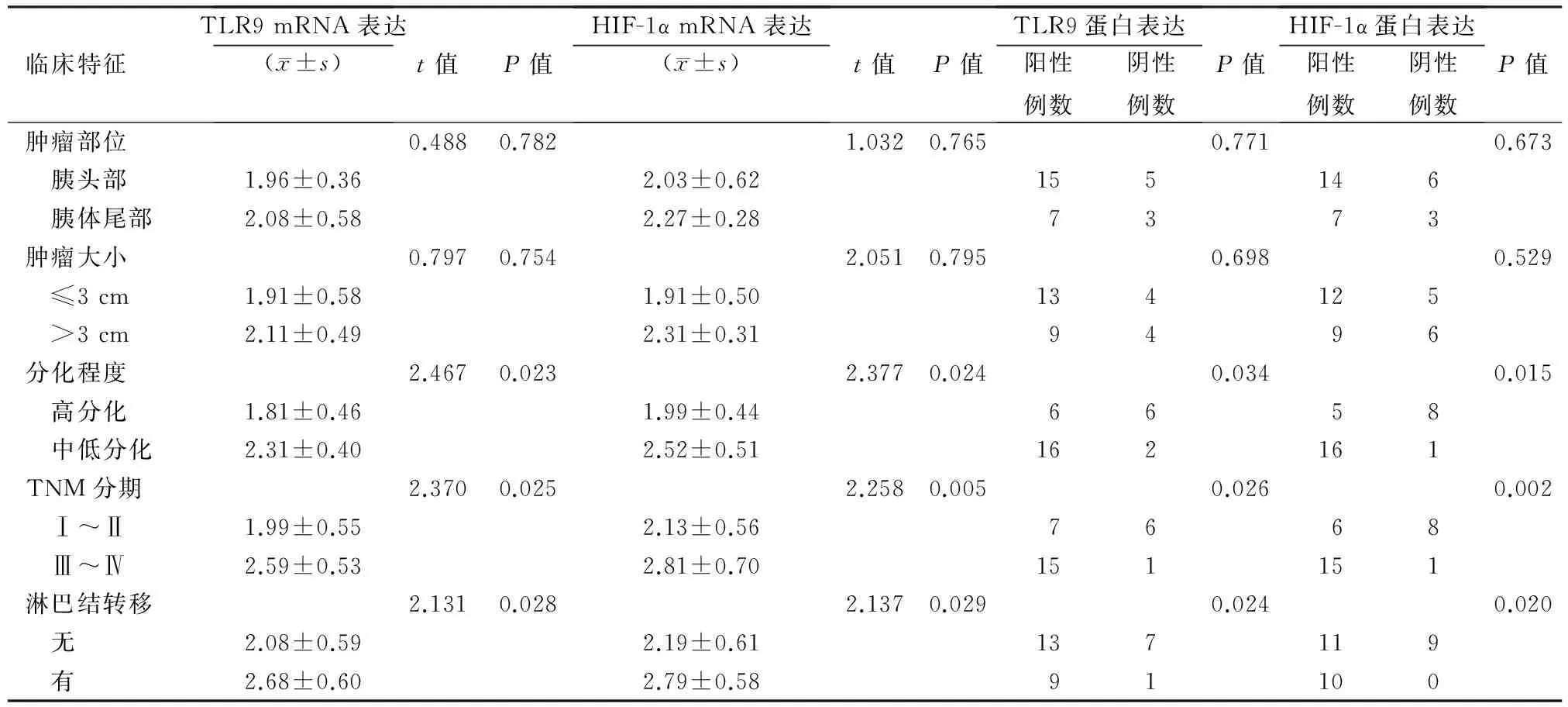
表1 胰腺癌组织中TLR9及HIF-1α的表达与临床病理特征的关系
四、TLR9、HIF-1α表达与患者生存时间的关系
TLR9阳性患者平均生存期为14.5个月(95%可信区间13.7~15.4);阴性患者平均为21.5个月(95%可信区间20.2~22.9),显著长于阳性患者(χ2=16.89,P<0.05,图3)。HIF-1α阳性患者平均生存期为14.8个月(95%可信区间13.8~15.8);阴性患者平均为21.8个月(95%可信区间20.3~23.4),生存期显著长于阳性患者(χ2=17.55,P<0.05,图3)。

图3TLR9及HIF-1α表达阳性及阴性患者的生存曲线
讨 论
1997年Medzhitov等首次发现了人类的第一种Toll同源变体(即TLR4),后又发现并确认了10种人的TLR家族蛋白,分别命名为TLR1~TLR11。TLR9特异性识别的病原体相关分子模式为细菌和病毒DNA中的CpG序列或人工合成的寡脱氧核苷酸(CpG-oligodeoxynucleotides)[2],在介导外源CpG DNA激活先天免疫过程中有重要的生物学意义。TLR9除了抗感染作用,还与自身免疫紊乱及恶性肿瘤的发生、发展有密切关系[4-5]。
本研究结果显示,胰腺癌组织、癌旁胰腺组织及正常组织中均有TLR9 mRNA和蛋白的表达,但癌组织的表达最高,与Droemann等[6]在肺癌中的研究结果一致。胰腺癌组织中TLR9的高表达与肿瘤分化程度、TMN分期、淋巴结转移或远距离转移有关,提示TLR9参与胰腺组织的恶性转化过程。患者生存期分析结果还显示,TLR9阴性表达患者的生存时间显著长于阳性表达患者,推测胰腺癌TLR9信号通路的激活可促进癌细胞的增殖、浸润和转移,进而影响患者预后。
浸润性生长的肿瘤常缺乏足够的血供,在距离血管较远的肿瘤组织区域形成不同程度的低氧、营养物质缺乏以及代谢产物堆积[7]。肿瘤缺细胞感知周围的低氧环境,调节代谢以适应受限的氧供给,最重要的机制就是HIF-1α的活化,本研究结果显示,胰腺癌组织HIF-1α mRNA和蛋白高表达,与淋巴结转移、TNM分期呈正相关,且与患者预后差有关,与Sun等[8]和Kitada等[9]研究结果一致。提示胰腺癌中存在HIF-1α的高表达,并与胰腺癌的侵袭转移等恶性表型相关。
本研究结果还显示,胰腺癌组织TLR9和HIF-1α的表达呈正相关,表明TLR9信号通路和HIF-1α信号通路可能存在交叉,但具体的联系机制目前尚不明确。最初的研究认为,HIF-1α仅对低氧发生反应,但最近研究发现它也能受到诸如癌基因激活、肿瘤抑制基因失活等的调控。而且组织微环境内糖及氧代谢产物的增加也能稳定HIF-1α,这些肿瘤组织的遗传和生理的改变导致HIF-1活化[10]。因此推测在胰腺癌微环境内,由于组织缺血坏死等因素,坏死组织和细胞释放出热休克蛋白以及基质降解等产生多种TLR9内源性配体,持续激活TLR9信号通路,进而通过某种机制进一步活化HIF-1α,共同促进了胰腺癌的恶性进展。
[1] Jurk M, Vollmer J. Therapeutic applications of synthetic CpG oligodeoxynucleotides as TLR9 agonists for immune modulation. Bio Drugs, 2007, 21:387-401.
[2] Hemmi H, Takeuchi O, Kawai T, et al. A Toll-like receptor recognizes bacterial DNA. Nature, 2000, 408:740-745.
[3] Semenza GL. Targeting HIF-1 for cancer therapy.Nat Rev Cancer,2003, 3:721-732.
[4] Ishii KJ, Akira S. Innate immune recognition of, and regulation by, DNA. Trends Immunol, 2006, 27:525-532.
[5] Coussens LM, Werb Z. Inflammation and cancer. Nature, 2002, 420: 860-867.
[6] Droemann D,Albrecht D,Gerdes J,et al.Human lung cancer cells express functionally active Toll-like receptor 9.Respir Res,2005,6:1.
[7] Milosevic M,Fyles A,Hedley D,et al.The human tumor microenvironment:invasive(needle) measurement of oxygen and interstitial fluid pressure.Semin Radiat Oncol,2004,14:249-258.
[8] Sun HC, Qiu ZJ, Liu J, et al. Expression of hypoxia-inducible factor-1 alpha and associated proteins in pancreatic ductal adenocarcinoma and their impact on prognosis.Int J Oncol,2007, 30:1359-1367.
[9] Kitada T, Seki S, Sakaguchi H, et al.Clinicopathological significance of hypoxia-inducible factor-1 alpha expression in human pancreatic carcinoma.Histopathology,2003,43:550-555.
[10] Denko NC.Hypoxia,HIF1 and glucose metabolism in the solid tumour.Nat Rev Cancer,2008,8:705-713.
ExpressionandsignificanceofTLR9andHIF-1αinpancreaticcancer
WUHan-qing,WANGBo,FAN-ping,WUHe-shui.
DepartmentofEmergencySurgery,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
WUHan-qing,Email:wuhanqincat@163.com
ObjectiveTo investigate the expression and clinical significance of toll-like receptor 9 (TLR9) and hypoxia inducible factor 1α (HIF-1α) in pancreatic cancer.MethodsThe real-time RT-PCR technique, western blot method and immunohistochemical method were used to examine the expressions of TLR9 and HIF-1α in 30 samples of pancreatic cancer, para-cancerous tissues, and 10 samples of normal pancreatic tissues. The relationship between TLR9 and HIF-1α was determined, and the correlations between their expressions and clinicopathological parameters were measured, and the impact on survival was detected.ResultsThe levels of TLR9 mRNA and HIF-1α mRNA expression in human pancreatic cancer tissues was 2.32(1.41~3.22) and 2.26(1.62~2.89) folds as many as that in normal tissues. The levels of TLR9 mRNA and HIF-1α mRNA expression in para-cancerous tissues were 1.23(1.18~1.28) and 1.36(1.17~1.55) folds as many as that in normal tissues. The expressions in human pancreatic cancer tissues were significantly higher than those in para-cancerous tissues (t=2.642,P=0.023;t=4.076,P=0.001). The positive rates of TLR9 and HIF 1α protein were 73.3%(22/30) and 70.0%(21/30), and the corresponding values were 33.3%(10/30) and 36.7%(11/30) in para-cancerous tissues, while the corresponding values were 20%(2/10) and 10% (1/10) in normal tissues, which showed a decreasing trend (χ2=13.99,P=0.001;χ2=13.15,P=0.001). The expressions of TLR9 mRNA in human pancreatic cancer tissues was positively associated with HIF 1α mRNA (r=0.537,P=0.003). The expressions of TLR9 protein was also positively associated with HIF 1α protein (r=0.511,P=0.001). The expressions of TLR9 and HIF 1α were positively correlated with the degree of tumor differentiation, TNM staging and lymph node metastasis, but were negatively correlated with the survival.ConclusionsTLR9 and HIF-1α are over-expressed in pancreatic cancer and they are associated with malignant biological behavior and poor prognosis.
Pancreatic neoplasms; Toll-like receptor 9; Hypoxia-inducible factor 1α
10.3760/cma.j.issn.1674-1935.2012.06.008
国家自然科学基金(30200272)
430022 湖北武汉,华中科技大学同济医学院附属协和医院急诊外科(吴汉青),胰腺外科(王博、范平、吴河水)
吴汉青,Email:wuhanqincat@163.com
2012-08-28)
(本文编辑:吕芳萍)
