断奶仔猪马链球菌兽疫亚种感染的诊断及防治
2012-10-18洪厚成李润成贺名叶余兴龙
恭 烨 ,洪厚成 ,李润成 ,※,贺名叶 ,钱 幸 ,余兴龙
(1.湖南农业大学动物医学院,湖南 长沙 410128;2.湖南省平江县三阳乡畜牧兽医水产站,湖南平江 414500)
2011年5月份湖南某猪场发生疫情,根据兽医对该场发病情况的描述得知,一个月内此猪场陆续出现30~40日龄断奶仔猪四肢关节肿大,跛行,严重时后肢瘫痪不能行走,并伴有体温升高症状,该病起病急、病程短,有的猪突然死亡,发病断奶仔猪达189头,死亡40头,发病率达50%,病死率达到20%以上。对病猪剖检脏器未见明显病变。由于该猪场母猪每年免疫2 次链球菌疫苗,猪场兽医认为小猪对链球菌感染应该具备一定的抵抗力。因此,怀疑断奶仔猪为副猪嗜血杆菌感染,送检了4头关节严重肿大的病死小猪的前后肢进行实验室诊断,并试图找到控制疫情的方案。笔者就送检的断奶仔猪关节进行了剖解、涂片镜检、细菌分离鉴定、药物敏感性试验,并用分离细菌制备了灭活疫苗,有效的控制了该次疫情。现报告如下:
1 材料与方法
1.1 病料
4头病死小猪肿大的关节。
1.2 主要试剂
鲜血琼脂培养基、巧克力琼脂培养基购自郑州贝瑞特公司,PCR 试剂购自北京天根生化,氢氧化铝佐剂购自SIGMA 公司。
1.3 小猪四肢关节的解剖与病变组织涂片镜检
用手术刀切开小猪肿大的腿部关节,观察关节腔病变并取病变组织触片后美兰染色镜检。
1.4 细菌分离培养及PCR 鉴定
1.4.1 用接种环钩取关节腔内病变组织少许,分别划线接种鲜血琼脂培养基和巧克力琼脂培养基。然后将鲜血琼脂放到37℃恒温箱培养,巧克力琼脂放于烛缸后37℃培养,48h 后观察结果并取培养物涂片、革兰氏染色镜检。
1.4.2 培养物的PCR 鉴定
(1)细菌16S 通用引物的设计与合成
参照GeneBank 收录的不同细菌16SrRNA 序列。从最保守区设计了一对革兰氏阴性和革兰氏阳性菌的通用引物,引物序列为:上游引物:5′-AGYGGCGRACGGGTGAGTAA-3′;下游引物:5′-CCATTGTAGCACGTGTGTAGC-3′。扩增片段长度为1041bp
(2)以纯培养的细菌为模板,用设计的细菌16S通用引物进行PCR 扩增。按常规方法通过PCR 反应扩增菌株的16S rRNA 基因序列,PCR 退火温度为55℃。
(3)PCR 产物的纯化与序列测定。
PCR 产物的纯化按试剂盒说明书进行操作。将纯化的16S rRNA PCR 扩增产物送北京华大基因生物技术有限公司进行测序并将测出的序列进行Blast 分析确定细菌的种类。
1.5 分离细菌的药物敏感性试验
从固体培养基上挑取菌落接种血清肉汤培养基37℃震荡培养24h,然后用纸片扩散法进行药物敏感性实验。具体操作按常规进行。
1.6 细菌灭活疫苗的制备
1.6.1 挑取鉴定后的细菌菌落接种血清肉汤培养基600 mL,37℃震荡培养24h 后进行细菌计数。记数方法采用平板法,具体操作按常规进行。
1.6.2 取甲醛加入细菌培养液中直至甲醛浓度达到0.4%左右,然后将菌液放于37℃温箱灭活并每8h摇匀菌液1 次,48h 后挑取少量菌液接种鲜血琼脂培养基,37℃培养48h 后检测细菌灭活效果。
1.6.3 于灭活后的600mL 菌液中缓慢加入氢氧化铝佐剂,边加边进行震荡混匀,直至加完70mL 铝佐剂后再震荡20min,分装到灭菌的50mL 塑料瓶中,封口压盖,4℃保存。
1.6.4 随机挑取制备好的细菌疫苗3 瓶进行小鼠接种试验,0.5mL/鼠,共接种小鼠18 只。同时用少量疫苗接种鲜血琼脂和巧克力琼脂平板。分别采取有氧和厌氧培养,进行疫苗安全性评价。
1.7 灭活疫苗的临床应用
取制备的细菌疫苗接种生猪,母猪免疫2mL/头,15日龄的小猪免疫0.5mL/头。
2 结果
2.1 病料镜检
用手术刀切开小猪肿大的腿部关节(图1),观察关节腔病变并取病变组织触片后美兰染色镜检。关节腔病变见图2,由图2 可见关节外部的骨间韧带出现了化脓性病变。病变组织涂片镜检可看到成链的球状细菌。

2.2 分离培养
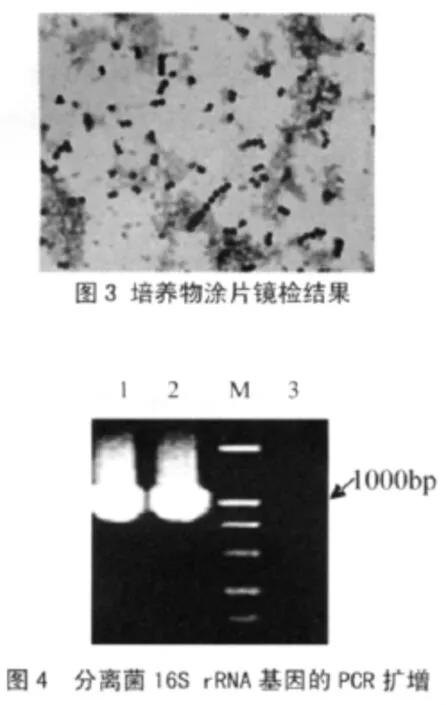
用关节腔内病变组织接种鲜血琼脂培养基和巧克力琼脂培养基,培养48h 后观察细菌生长形态。结果两种培养基均长出了相同形态的很纯的细菌。细菌菌落成透明的水滴状,鲜血琼脂培养基上有明显的β溶血特性;挑取菌落涂片、革兰氏染色镜检,结果见图3。由图3 可见大量革兰氏阳性、呈短链状的球状细菌。
2.3 培养物的PCR 鉴定结果
以纯培养的细菌为模板,用设计的细菌16S rRNA 通用引物扩增分离菌株的16S rRNA 基因序列,结果见图4,由图4 可见扩增出了预期大小的条带(1、2:分离菌,M:DNA 分子量标准,3:阴性对照)。
PCR 产物测序结果通过编辑后共得到778bp的准确序列。用序列进行BLAST 分析确定该细菌为马链球菌兽疫亚种。
2.4 分离细菌药物敏感性试验
从固体培养基上挑取菌落接种血清肉汤经12h 培养后用纸片扩散法进行药物敏感性实验。结果见表1。由表1 可见该菌对头孢类药物比较敏感。猪场方采用头孢类药物进行治疗,对于早中期病例同样也取得了很好的效果。
2.5 细菌灭活疫苗的制备
2.5.1 配苗用菌液细菌计数结果
挑取分离菌37℃震荡培养24h 后进行细菌记数,结果表明细菌培养液细菌浓度为5 ×1010CFU/mL
2.5.2 菌液灭活效果检验结果
取出经甲醛灭活的培养液,挑取少量接种血平板,37℃培养检测灭活效果。结果经48h 培养后,血平板没有任何细菌生长,表明链球菌均已灭活完全。
2.5.3 疫苗成品的安全性检验
将600mL 菌液中缓慢加入氢氧化铝佐剂配制成灭活疫苗,分装到灭菌的塑料瓶中并封口压盖。最后随机抽取其中3 瓶接种小鼠,同时用少量疫苗接种细菌培养基。结果接种疫苗的小鼠经观察7天没有任何异常反应;培养基平板上也没有细菌生长。
2.6 临床应用结果
母猪免疫2mL/头,15日龄小猪免疫0.5mL/头后均没有任何不良反应。并且经接种后该猪场仔猪只有零星猪只出现关节肿大症状,但并不严重,经治疗后既能得到康复。
3 讨论
3.1 马链球菌兽疫亚种为兰氏分群中的C 群链球菌,主要引起猪的链球菌病,能引起猪的脑膜炎、败血症、关节炎、心内膜炎、肺炎以及突发性死亡[1],危害集约化养猪业的发展,不仅给我国养猪业造成较大的危害,同时对养猪业的相关从业人员的健康具有潜在威胁。流行病学调查表明,除新出现的猪链球菌2 型外,马链球菌兽疫亚种仍是我国各地猪链球菌病的主要病原[2]。
3.2 本文对发病猪场30~40日龄断奶仔猪疫病进行了诊断与鉴定,最后确诊病猪为马链球菌兽疫亚种感染,对于此类疾病的诊断提供一定的参考价值。该场母猪虽然接种了链球菌疫苗,但30日龄断奶仔猪可能已没有母源抗体保护或母源抗体滴度低、保护性不强,而刚断奶仔猪母源抗体含量高有较强的保护性故不发病,亦或者母猪接种的疫苗菌株对该菌的交叉保护性不够,因而断奶仔猪感染了该链球菌并表现出发病。

?
3.3 由细菌鉴定结果可见该分离菌能引起断奶仔猪少见的关节韧带呈化脓性变化,多数病例以关节渗出、肿胀多见;在鲜血琼脂平板上为透明水滴状,有溶血特性的菌落,而非半透明菌落,这些临床致病表现和细菌生长特性方面与王继春鉴定的马链球菌兽疫亚种9802 株[3]存在一定的不同之处,本文通过培养分离菌制备灭活疫苗接种母猪和哺乳仔猪成功控制了病例的不断出现,这对指导生产实践具备一定的参考价值,特别是对于病原细菌血清型较多、相互间交叉免疫性不够的情况下,如:马链球菌马亚种,A、D 群链球菌与马链球菌兽疫亚种则基本上没有交叉保护性[4],用市场上通用的疫苗难以控制疾病时,通过分离本场的病原菌制备灭活疫苗来控制疫情能起到很好的辅助作用。 □
[1] 陆承平.兽医微生物学(第三版)[M].北京:中国农业出版社,2001:204~212.
[2] 姚火春,陈国强,陆承平.猪链球菌1998 分离株病原特性鉴定[J].南京农业大学学报,1999,22(2):67~70.
[3] 王继春,何家惠.猪链球菌2 型与马链球菌兽疫亚种生物学特性的初步比较[J].中国预防兽医学报.2000,22(SI):66~68.
[4] 范红结,陆承平.猪源马链球菌兽疫亚种灭活疫苗对小鼠的免疫效力评价[J].中国农业科学.2008,41(2):613~618.
