VEGF-siRNA在肾癌中的实验研究
2012-10-17隋玉东王晓民杨德君王科亮
隋玉东 王晓民 杨德君 王科亮
哈尔滨医科大学附属四院泌尿外科,黑龙江哈尔滨 150001
肾癌是泌尿系统中最常见的肿瘤,在治疗上通常采用的是手术治疗,但是在早期诊断时有大约30%的患者存在转移的现象,其转移的主要方式是血道转移和淋巴道转移[1]。肿瘤的转移是涉及很多因子的复杂过程,研究发现有很多因子参与转移过程,最值得关注的是血管内皮生长因子VEGF,其是通过旁分泌的方式释放,从而刺激肿瘤血管的生成,加快肿瘤的生长,VEGF不仅加快血管生长速度,也增加血管的通透性,Ferrara等[2]报道中提及肾癌的肿瘤的生长是通过自分泌和有通透性的作用。为了减少肾癌的远处转移和抑制肿瘤的生长速度,采用了对siRNA和血管内皮生长因子的研究,探讨肾癌的治疗前景。
1 材料与方法
1.1 实验体外过程
1.1.1 实验材料 肾癌细胞786-0由实验室自身提供,siRNA的设计:在Gene Bank查找编码人VEGF cDNA的序列,应用Ambion公司RNAi设计软件并参考有关文献,进行全基因组扫描和序列同源分析,设计针对VEGF mRNA不同剪接子的RNAi作用的公共靶点,上述由广东锐博合成所需的编码RNA,然后由该公司转导质粒中。
1.1.2 方法 siRNA的合成:广东锐博根据提供参考的碱基对5′-GATCCACCTCACCAAGGCCAGCACTTCAAGAGAGTGCTG GCCTTGGTGAGGTTTTTTTTGGAAGTCGACA-3′(有义链);3′-GTGGAGTGGTTCCGGTCGTGAAGTTCTCTCACGACCGGAA CCACTCCAAAAAAACCTTCAGCTGTTCGA-5′,合成目的 siRNA。
1.1.3 质粒的转导和提取 由广东锐博根据碱基序列合成所需的质粒,并由广东锐博将质粒转导大肠杆菌中,再放进摇箱进行摇晃,观察甘油菌的生长情况,同时加氨苄西林将非耐药的大肠杆菌杀死,使其含目的质粒的基因在大肠杆菌内大量繁殖。然后将质粒提取检测质粒,加入甘油进行保存。
1.1.4培养细胞 将实验室提供的肾癌786-0细胞系放置于人工培养液血清1640中,每24小时更换培养液,置于37℃温箱中进行繁殖、传代,冻存以备后期使用。
1.1.5 细胞分组和转染细胞 将培养的肾癌细胞进行分组,分为空白组、目的组、含空质粒组、其他干扰因子组四组,转染前24 h,进行细胞准备,实验前24 h接种细胞,每孔细胞0.8×105个,密度为50%,第2天细胞密度增加至75%左右时,进行细胞转染。
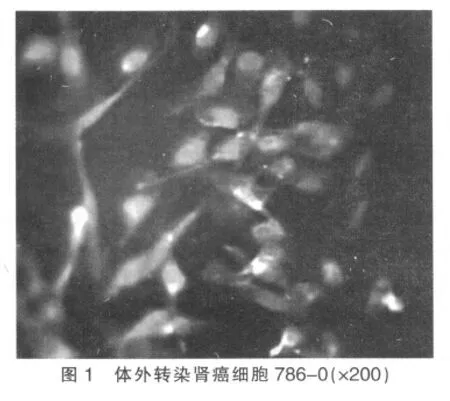
1.1.6 检验转染是否成功 将转染后的细胞进行传代繁殖,挑选状态好的细胞进行荧光下显像,观察细胞的形态以及分析是否转染成功,也可以通过RT-PCR技术检测是否转染成功。在图1中可以看出转染后的肾癌细胞呈现梭形,在荧光显微镜下能够看出荧光梭行肾癌细胞,结构完好,荧光显色均匀,未见肾癌细胞的破裂,转染成功。
1.1.7 WESTER-BLOT 此步骤是为了检验蛋白产生,具体步骤如下:①先将细胞在超声下均浆破碎;②加入1.5 mL的裂解液,震荡混匀,冰上孵育30 min,离心,将上清液弃去,加入Nonidet P40至浓度0.6%,摇匀,冰上孵育10 min,将沉淀悬浮于0.5 mL的loadingbuffer中,样品在冰上孵育30min,2000 r/min,4℃下离心10 min,将沉淀的蛋白分装,保存。将等量蛋白样品经10%SDS-J聚丙烯酰胺凝胶电泳分离,以湿转法移到NC膜上,转移缓冲液转移条件为电流1 A,将时间调制1 h,转移后的NC膜经3%BSA室温封闭3 h,加入适当稀释的一抗,在4℃下过夜,用洗涤液buffer洗膜3遍,加入相应的二抗,在37℃下反应2 h,洗膜,以NBT/BCIP显色,水洗终止反应。在图2中能够清楚看见,在蛋白电泳中出现蛋白条带阳性,间接表示转染后的肾癌细胞中有转染后VEGF蛋白表达。

1.1.8 细胞生长曲线 将肾癌细胞786-0制成细胞悬液接种于96孔板上,每孔浓度1×107/L,24 h后更换培养液,同时加入不同浓度的siRNA,每隔24 h取3孔做细胞计数,取平均值。
1.1.9 CCK-8法 很多实验应用MTT方法,但是CCK-8在实验中具有简便、安全、精确的优点。步骤:接种细胞悬液于96孔板内,经37℃、5%CO2培养箱培养至细胞贴壁,再分别加入不同浓度的Ki67 siRNA,,每一浓度做3个复孔,并以negative siRNA和空白做对照,37℃下5%CO2培养箱培养72 h,有另外几孔已知数量的活细胞以备制标准曲线。将CCK-8试剂解冻,每孔加入10 μL,注意不能有气泡,放置培养箱4 h。用酶标仪检测在450 nm波长的吸光度,参照对照比630 nm波长。根据公式抑制率=(1-实验组A值/阴性对照A值)×100%计算抑制率。
1.2 体内实验部分
1.2.1 小鼠分组 动物实验模型的建立与分组:给予正常的18只小鼠正常喂养,然后将小鼠标有数字,写在卡片上,放在暗箱中随机分组,将其分为3组,分别是目的组(VEGF),绿色荧光组(GPF),空质粒组(Control),每组 6 只小鼠,将小鼠进行同样饮食饲养,饲养天数为21 d。然后将体外培养好的带有目的基因的肾癌细胞,配制密度1.0×107个/mL,在每只小鼠的背部皮下注射细胞悬液约0.3 mL,然后正常喂养小鼠,其他两组依次按此法喂养。
1.2.2 计算测量肿瘤大小 观察瘤体体积:在正常饲养小鼠的情况下,每隔1 d用卡尺测量最大直径的长度A和与之垂直的最大宽径B,利用公式得出相应结果,比较各组小鼠的生长情况,绘制肿瘤的生长曲线。
1.2.3 测量血管密度 病理形态观察和免疫组化检测VEGF表达、血管密度。在实验结束后处死小鼠,取出肿瘤组织,应用常规HE染色,观察组织变化,用兔抗鼠VEGF作为一抗,按照说明进行SABC法免疫组织化学染色,随机在肿瘤的边缘与正常组织取平均值MVD,计算与同视野下的肿瘤细胞总数均值的比值,作为肿瘤细胞VEGF的表达阳性率MVD技术按Weidner评价标准进行。
1.3 统计学方法
利用SPSS 13.0软件进行统计分析,计量资料数据以均数±标准差(±s)表示,多个样本之间均数比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤细胞表达VEGF的阳性率
在目的组(VEGF)、绿色荧光组(GPF)、空质粒组(Control)的肾癌细胞中,应用免疫荧光法检测VEGF在肾癌细胞中的表达,在绿色荧光组(GPF)中和空质粒组阳性率很高,在目的组中很低,差异有统计学意义(P<0.05)。
2.2 肿瘤生长曲线
含有VEGF的小鼠的背部的肿瘤体积随着时间的增长,三组小鼠的背部肿瘤的大小不一,在同一时间点上相比含有VEGF的小鼠肿瘤体积最小,VEGF组与GPF组、对照组相比,肾肿瘤的体积远远小于对照组和GFP组,对照组和GPF组相比,其肿瘤体积差异不大。见图3。

2.3 组织中血管密度
在三组小鼠中,通过SABC法免疫组织化学染色显示,在VEGF组中血管密度比其他两组在同期中都低,在对照组中血管密度最高,GPF组介于VEGF组和对照组之间,在同组中每只小鼠的血管密度变化不大,说明siRNA-VEGF在肾癌中具有抑制肿瘤生长的效果。见表1。
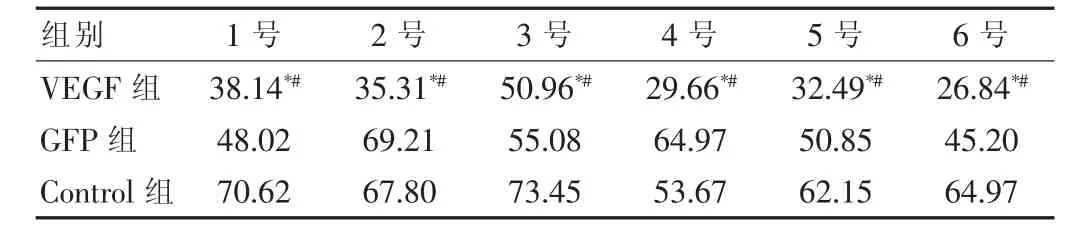
表1 组织中血管密度(个/mm2)
3 讨论
肾癌的治疗在临床上比较单一,主要是通过手术治疗,对放化疗不敏感免疫治疗在肾癌晚期治疗效果不理想。近几年通过对肾癌的研究,临床上有许多药物诞生,但价格比较昂贵,患者不能承受,笔者通过将si-RNA质粒转导肾癌细胞内,与Control组和GFP组相比较,发现细胞比Control组和GFP组生长缓慢,将三组含有不同质粒的肾癌细胞皮下种植小鼠皮下,建立动物的实验模型,测量三组动物实验模型肿瘤的直径大小,可以直观发现存在siRNA的肾癌的小鼠生长速度明显低于Control组和GFP组,生长速度也明显低于其他两组,Control组和GFP的体积大小以及生长速度明显高于VEGF组。GFP组的生长速度和在体小鼠的肿瘤大小无明显变化,通过免疫组化测量组织血管密度可以看出,三组小鼠组织的血管密度各不相同,其表现差异性很大,在VEGF组中,6只小鼠的血管密度与GFP组、Control组相比均小。在VEGF组的每只小鼠的组织血管密度相差不大,这与siRNA抑制血管内皮生长有很大关系,说明其能抑制肿瘤血管内皮生长的速度,间接抑制肿瘤的生长速度,直观上可见肿瘤大小以及体积远远小于GFP组和Control组。根据以上的实验研究,笔者可以得出siRNA-VEGF具有抑制肾癌细胞的生长作用,为临床起到指导作用,在药物的研发上起指导作用。
血管内皮生长因子属于多潜能因子家族,VEGF-B、VEGF-C、VEGF-D、VEGF-E和胎盘生长因子VEGF的生物学作用是促进血管内皮生长,增加血管的通透性及血管生成维持其功能,此外还有促进内皮细胞的分裂[3]。最后还有细胞质的聚钙作用在正常肾脏可以表达,其含量和病变的程度呈正比[4]。
肿瘤的生长依赖血管以及生长因子的作用,其中VEGF对血管的生长有很大的作用,是决定血管形成的因素之一[5]。VEGF在许多恶性肿瘤组织中高水平表达,肿瘤组织中的高表达VEGF有利于肿瘤的生长与转移,有很多研究显示肿瘤生长组织中VEGF的表达很高[6-7]。在实验中Control组肿瘤细胞生长很快,而在VEGF组肾癌组织生长很慢,血管密度很低,说明VEGF的表达增高与肾癌的生长与侵袭有关。
肾癌是一种很容易转移的肿瘤,在临床上往往转移发生很早,转移的主要方式是淋巴转移和血道转移,其转移是一个很复杂的过程,也是一个动态过程,很多因子参与调控,几近年来发现VEGF是与实体肿瘤生长和转移有很大联系的一组生长因子,是以旁分泌的形式进行分泌,刺激血管形成,间接促进肿瘤的生长,在肿瘤的生长体积以及晚期转移的患者VEGF的表达水平高于早期患者。Oya等[8]报道,肾脏小血管以及小管是通过VEGF子分泌作用促进瘤的增生。在近年的研究中发现,VEGF与相应的疾病有关联,例如肾衰竭、代谢疾病、血管疾病,在不同的肾脏疾病中VEGF的表达不同。但是现在在肾癌的研究中,确定VEGF起着决定性的作用,现在有应用药物的治疗,例如舒尼替尼、索拉菲尼等药物的治疗。应用药物在最大限度上抑制VEGF和扩大潜在的抗肿瘤作用,现对这些药物组合安全性进行评估,所以不难看出,在发现VEGF之后为临床治疗提供了指导思想,为寻找其他有效因子作出了很好的实验模型,在今后肾癌治疗中有很好的指导意义。
[1]肖建武.血管内皮生长因子与肾脏疾病研究进展[J].中国医药指南,2008,6(23):
[2]Ferrara N,Gerber Hp,Couter J.The biology of VEGF and its recep-tors[J].2003,9(6):669-676.
[3]Evelyhe D,Patricia H ,Ande V,et al.Tumor angiogenesis and tissue factor expression on during hepatocellular carci-noma progression in a transgenic mouse model[J].J Hepatol,2003,38(6):793-802.
[4]Thomton MV,Kudo D,Rayman P,et al.Degradation of NF-kappa Bin T cell by ganglliosides on re-cell carcinomas[J].J Immunol,2004,172(6):3480-3489.
[5]Sing AK,Gudehithlu KP,Pegoraro AA,et al.Vascular factors alterd in glucose-treated mesangial cells and diabetic glomeruli changes in vascular factors impair endothelial cell growth and matrix [J].Lab Invest,2004,84:597-606.
[6]Carmeliett P.Angiogenesis in life disease and medicine [J].Nature,2005,438(7070):932.
[7]Siemann DW,Chaplin DJ,Horsman MR.Vascular-targeting therapies for treatment of malignant disease[J].Cancer,2004,100(12):2491.
[8]Oya M,Takayanagi A,Horiguchi A,et al.Increased nu-clear factorkappa B activation is related to the tumorde-velopment of renal cell carcinoma[J].Carcinogenesis,2003,24(3):377-384.
