海洋红树林植物黄槿内生真菌Aspergillus sydowii EN-198化学成分研究
2012-10-13杜丰玉李晓明李春顺王斌贵
杜丰玉, 李晓明, 李春顺, 王斌贵
(1.中国科学院 海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 2.中国科学院研究生院,北京100049)
红树植物一般分布于热带、亚热带潮间带或河口边缘, 生长环境特殊, 具有水陆两栖特性, 蕴藏着丰富并极具特色的微生物资源[1]。红树林内生真菌是指那些在其生活史中的全部或某一段时期生活在宿主体内, 但不引起宿主明显病害症状的真菌。因为红树植物独特的两栖特性, 这些内生真菌具有海洋微生物的特点, 拥有独特的代谢途径和遗传背景, 其代谢产物化学多样性也因而比较丰富。近年来红树林内生真菌代谢产物研究已经受到越来越多的关注[2-4]。
对于红树植物及其内生真菌次级代谢产物的研究本研究组曾有报道[5-9]。本文报道从采自海南东寨港的海洋红树林植物黄槿(Hibiscus tiliaceus)叶中分离到一株内生真菌Aspergillus sydowiiEN-198, 并从其发酵培养物中分离鉴定了14个化合物, 其中化合物1和2为首次从Aspergillus sydowii中分离得到。
1 材料与方法
1.1 仪器与试剂
Bruker Avance 500 MHz核磁共振仪, TMS内标;薄层色谱硅胶 GF254和柱色谱硅胶(200~300目)为青岛海洋化工厂分厂产品; Lobar LiChroprep RP-18硅胶 (40~63 μm, Merck); 显色剂为茴香醛硫酸溶液和碘; 所用有机溶剂为重蒸的工业级溶剂。
1.2 菌株发酵
(1)菌株: 菌株 EN-198是分离自海南东寨港采集的海洋红树林植物黄槿(Hibiscus tiliaceus)叶中的内生真菌。
(2)菌株发酵: 菌种以琼脂–麦芽膏培养基, 4℃保存。发酵培养基组成为: 酵母膏3 g/L, 麦芽糖20 g/L, 山梨醇 20 g/L, 味精 10 g/L, 色氨酸 0.5 g/L,KH2PO40.5 g/L, MgSO4·7H2O 0.3 g/L, pH 6.5。250 mL三角烧瓶, 每瓶装液体培养基150 mL, 115 ℃灭菌20 min后接种。共接种液体培养基15 L, 28 ℃, 160 r/min摇床培养7 d, 过滤, 分别收集菌丝体和发酵液。
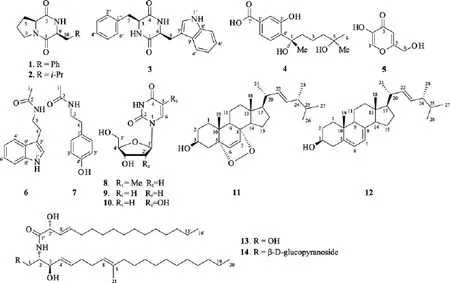
图1 化合物1–14的结构Fig. 1 Structures of compounds 1–14
1.3 提取分离
收集发酵液约15 L, 用乙酸乙酯萃取。菌丝体凉干、粉碎后用丙酮∶水(4∶1)浸泡。将丙酮蒸出, 水相用乙酸乙酯萃取, 萃取物经薄层层析检测发现与发酵液萃取物基本一致, 合并得到粗提物10g。
将上述粗提物进行硅胶VLC柱层析, 以石油醚-乙酸乙酯、氯仿-甲醇体系梯度洗脱, 经TLC检测合并为10个组分(Fr.1-10), 其中组分Fr.4-5经正相硅胶柱层析, Sephadex LH-20 (氯仿: 甲醇=1: 1)凝胶柱层析与反相硅胶柱层析分离得到化合物 11 (10.5 mg),12 (29.5 mg)与13 (24.1 mg); 组分Fr.7经正相硅胶柱层析, Sephadex LH-20 (甲醇)凝胶柱层析和反相硅胶柱层析得到化合物1 (3.2 mg), 2 (4.1 mg), 3 (2.7 mg),4 (14.9 mg), 5 (41.2 mg), 6 (4.8 mg)与 7 (6.7 mg); 组分Fr.8-10经正相硅胶柱层析, Sephadex LH-20 (甲醇)凝胶柱层析和制备薄层层析得到化合物8 (3.3 mg), 9(4.1 mg), 10 (5.2 mg)与 14 (21.2 mg)。
1.4 抑菌活性筛选
(1)病原指示菌: 金黄色葡萄球菌(Staphyloccocus aureus)与大肠杆菌(Escherichiacoli)。
(2)指示菌菌悬液制备: 指示菌接种于LB培养基表面, 于37 ℃培养24 h后, 吸取2 mL无菌0.85%NaCl溶液洗涤培养物, 并用玻璃刮刀将菌刮下。采用平板菌落计数法测定指示菌液所含活菌数, 并将其稀释成密度为1×105CFU/mL的菌液, 备用。
(3)抑菌活性筛选: 采用滤纸片扩散法[6], 测定化合物的抑菌活性。以氯霉素为阳性对照, 每张滤纸片加样量20 μg。待测化合物以DMSO溶解, 配制为20 g/L溶液, 每张滤纸片加样量100 μg。将加样滤纸片贴于带菌平板表面, 并以加 DMSO溶剂的滤纸片为阴性对照, 将平板置于37℃ 培养箱培养24h后观察结果, 测量并记录抑菌圈直径。
2 化合物结构鉴定与抑菌活性
化合物1: 无色粉末,1H-NMR (CDCl3)δH: 3.48(1H, m, Ha-3); 3.52 (1H, m, Hb-3); 1.80 (1H, m, Ha-4);2.01 (1H, m, Hb-4); 2.01 (1H, m, Ha-5); 2.60 (1H, m,Hb-5); 4.07 (1H, t,J= 7.7 Hz, H-6); 5.70 (1H, br s,NH-8); 4.28 (1H, dd,J= 10.6, 2.6 Hz, H-9); 2.79 (1H,dd,J= 14.5, 10.6 Hz, Ha-10); 3.50 (1H, m, Hb-10);7.23 (2H, d,J= 7.2 Hz, H-2′/6′); 7.35 (2H, m, H-3′/5′);7.29 (1H, m,H-4′);13C-NMR (CDCl3)δC: 165.1 (C-1,C); 45.5 (C-3, CH2); 22.5 (C-4, CH2); 28.4 (C-5, CH2);59.1 (C-6, CH); 169.4 (C-7, C); 56.2 (C-9, CH); 36.8(C-10, CH2); 136.0 (C-1′, C); 129.3 (C-2′/6′, CH);129.5 (C3′/5′, CH); 127.5 (C4′, CH)。其波谱数据与环-(S-脯氨酸-S-苯丙氨酸)的文献报道一致[10]。化合物1的比旋光度值为 [α]= –57.1 (c0.28, EtOH), 与文献报道值 [α]2D0= –64 (c0.05, EtOH)接近, 表明其 C-6与C-9位绝对构型均为S[10-11]。该化合物为首次从Aspergillus sydowii中分离得到。
化合物2: 无色粉末,1H-NMR (CDCl3)δH: 3.53(1H, m, Ha-3); 3.59 (1H, m, Hb-3); 1.90 (1H, m, Ha-4);2.02 (1H, m, Hb-4); 2.13 (1H, m, Ha-5); 2.34 (1H, m,Hb-5); 4.11(1H, t,J= 8.2 Hz, H-6); 5.98 (1H, br s,NH-8); 4.01 (1H, dd,J= 9.6, 3.4 Hz, H-9); 1.52 (1H,ddd,J= 14.5, 9.6, 5.0 Hz, Ha-10); 2.06 (1H, m, Hb-10);1.75 (1H, m , H-11); 0.95 (3H, d,J= 6.6 Hz, H-12);1.00 (3H, d,J= 6.6 Hz, H-13);13C-NMR (CDCl3)δC:166.2 (C-1, C); 45.5 (C-3, CH2); 22.7 (C-4, CH2); 28.1(C-5, CH2); 59.0 (C-6, CH); 170.1 (C-7, C); 53.4 (C-9,CH); 38.7 (C-10, CH2); 24.7 (C-11, CH); 21.2 (C-12,CH3); 23.3 (C-13, CH3)。其波谱数据与环-(S-脯氨酸-S-亮氨酸)的文献报道一致[10]。化合物2的比旋光度值为[α]= –98.0 (c0.51, EtOH), 与文献报道值 [α= –108 (c0.10, EtOH)接近, 表明其 C-6与 C-9位绝对构型均为S[10-11]。该化合物为首次从Aspergillus sydowii中分离得到。
化合物 3: 无色粉末,1H-NMR (DMSO-d6)δH:7.91 (1H, br s, NH-2); 3.97 (1H, br s, H-3); 7.71 (1H,br s, NH-5); 3.85 (1H, br s, H-6); 2.80 (1H, m, Ha-7);2.45 (1H, dd,J= 13.5, 4.5 Hz, Hb-7); 2.53 (1H, m,Ha-8); 1.85 (1H, dd,J= 13.5, 4.6 Hz, Hb-8); 10.89 (1H,br s, NH-1′); 6.96 (1H, d,J= 2.3 Hz, H-2′); 7.48 (1H, d,J= 8.0 Hz, H-4′); 6.98 (1H, m, H-5′); 7.07 (1H, m,H-6′); 7.32 (1H, d,J= 8.1 Hz, H-7′); 7.17 (2H, d,J=7.5 Hz, H-2′/6′); 6.70 (2H, m, H-3′/5′); 7.15 (1H, m,H-4′);13C-NMR (DMSO-d6)δC: 166.7 (C-1, C); 55.6(C-3, CH); 166.1 (C-4, C); 55.2 (C-6, CH); 39.5 (C-7,CH2); 29.6 (C-8, CH2); 124.3 (C-2′, CH); 108.8 (C-3′,C); 118.7 (C-4′, CH); 118.3 (C-5′, CH); 120.8 (C-6′,CH); 111.2 (C-7′, CH); 136.0 (C-8′, C); 127.5 (C-9′, C);136.5 (C-1′, C); 128.0 (C-2′/6′, CH); 129.6 (C-3′/5′,CH); 126.3 (C-4′, CH)。其波谱数据与环-(S-苯丙氨酸-S-色氨酸)的文献报道值[12]一致。化合物3的比旋光度值为[α= –156.3 (c0.16, MeOH), 与文献报道值[α= –174.4 (c0.30, MeOH)接近, 表明其 C-6 与 C-9位绝对构型均为S[12]。
化合物 4: 无色粉末,1H-NMR (DMSO-d6)δH:1.66 (1H, m, Ha-2); 1.90 (1H, m, Hb-2); 1.08 (1H, m,Ha-3); 1.30 (1H, m, Hb-3); 1.24 (2H, dd,J= 10.7, 4.4 Hz, H-4); 1.50 (3H, s, H-6); 0.98 (3H, s, Me-1); 0.98(3H, s, Me-5); 7.29 (1H, s, H-2′); 7.30 (1H, d,J= 8.0 Hz, H-5′); 7.30 (1H, d,J= 8.0 Hz, H-6′);13C-NMR(DMSO-d6)δC: 75.0 (C-1, C); 42.1 (C-2, CH2); 18.5(C-3, CH2); 44.0 (C-4, CH2); 68.7 (C-5, C); 28.2 (C-6,CH3); 29.2 (Me-1); 29.2 (Me-8); 133.1 (C-1′, C); 116.8(C-2′, CH); 154.5 (C-3′, C); 136.2 (C-4′, C); 119.5(C-5′, CH); 126.3 (C-6′, CH); 168.0 (C-7′, C)。其波谱数据与(1S)-1-(4′-间羟基苯甲酸)-1,1,5,5-二甲基己二醇的文献报道值[13]一致。
化合物 5: 无色粉末,1H-NMR (DMSO-d6)δH:8.01 (1H, s, H-1); 6.33 (1H, s, H-4); 4.29 (2H, s, H-6);9.04 (1H, s, OH-2); 5.66 (1H, s, OH-6);13C-NMR(DMSO-d6)δC: 139.3 (C-1, CH); 145.7 (C-2, C); 174.0(C-3, C); 110.0 (C-4, CH); 168.1 (C-5, C); 59.5 (C-6,CH2)。其波谱数据与曲酸文献报道值[14]一致。化合物 5对金黄色葡萄球菌有较好抑制活性, 加样量为100 μg/碟时, 抑菌圈直径为 10 mm, 阳性对照抑菌圈直径为 22 mm。该结果与文献报道的曲酸对金黄色葡萄球菌抑制活性一致[15-16]。
化合物6: 无色粉末,1H-NMR (CDCl3)δH: 1.93(3H, s, H-1); 5.55 (1H, br s, NH-2); 3.61 (2H, t,J= 6.3 Hz, H-3); 2.98 (2H, t,J= 6.3 Hz, H-4); 8.10 (1H, br s,NH-1′); 7.05 (1H, s, H-2′); 7.61 (1H, d,J= 7.9 Hz,H-4′); 7.13 (1H, m, H-5′); 7.21 (1H, m, H-6′); 7.39 (1H, d,J= 7.9 Hz, H-7′);13C-NMR (CDCl3)δC: 23.4 (C-1,CH3); 170.1 (C-2, C); 39.9 (C-3, CH2); 25.3 (C-4, CH2);122.3 (C-2′, CH); 113.2 (C-3′, C); 118.7 (C-4′, CH);119.6 (C-5′, CH); 122.3 (C-6′, CH); 111.3 (C-7′, CH);136.5 (C-8′, C); 127.4 (C-9′, C)。 其 波 谱 数 据 与N-[2-(4-吲哚)乙基]乙酰胺文献报道值[17]一致。
化合物 7: 无色粉末,1H-NMR (DMSO-d6)δH:1.77 (3H, s, H-1); 3.17 (2H, dt,J= 7.8, 6.1Hz, H-3);2.57 (2H, m, H-4); 6.98 (1H, d,J= 8.5 Hz, H-2′); 6.68(1H, d,J= 8.5 Hz, H-3′); 6.66 (1H, d,J= 8.5 Hz, H-5′);6.96 (1H, d,J= 8.5 Hz, H-6′);13C-NMR (DMSO-d6)δC: 22.6 (C-1, CH3); 169.0 (C-2, C); 40.6 (C-3, CH2);34.4 (C-4, CH2); 129.5 (C-1′, C); 129.4 (C-2′, CH);115.1 (C-3′, CH); 155.6 (C-4′, C); 115.1 (C-5′, CH);129.4 (C-6′, CH)。其波谱数据与N-[2-(4-对羟基苯酚)乙基]乙酰胺的文献报道值[18]一致。化合物7对金黄色葡萄球菌有一定抑制活性, 抑菌圈直径为9 mm。其抑菌活性为首次报道。
化合物 8: 无色粉末,1H-NMR (DMSO-d6)δH:7.70 (1H, s, H-6); 1.77 (3H, s, Me-5); 6.16 (1H, m,H-1′); 2.06 (2H, m, H-2′); 4.23 (1H, m, H-3′); 3.75 (1H,m, H-4′); 3.57 (1H, m, Ha-5′); 3.54 (1H, m, Hb-5′);13C-NMR (DMSO-d6)δC: 150.4 (C-2, C); 163.7 (C-4,C); 109.2 (C-5, C); 136.0 (C-6, CH); 12.1 (Me-5, CH3);87.2 (C-1′, CH); 39.1 (C-2′, CH2); 70.4 (C-3′, CH);83.7 (C-4′, CH); 61.3 (C-5′, CH2)。其波谱数据与胸腺嘧啶脱氧核苷的文献报道值[19]一致。
化合物 9: 无色粉末,1H-NMR (DMSO-d6)δH:5.69 (1H, d,J= 8.1 Hz, H-5); 7.98 (1H, d,J= 8.1 Hz,H-6); 6.27 (1H, m, H-1′); 2.25 (2H, m, H-2′); 4.39 (1H,m, H-3′); 3.92 (1H, m, H-4′); 3.78 (1H, m, Ha-5′); 3.72(1H, m, Hb-5′);13C-NMR (DMSO-d6)δC: 150.9 (C-2,C); 152.5 (C-4, C); 102.7 (C-5, CH); 142.4 (C-6, CH);89.0 (C-1′, CH); 41.4 (C-2′, CH2); 72.3 (C-3′, CH);86.7 (C-4′, CH); 62.9 (C-5′, CH2)。其波谱数据与尿嘧啶脱氧核苷的文献报道值一致[20]。
化合物10: 无色粉末,1H-NMR (DMSO-d6)δH:5.58 (1H, d,J= 8.0 Hz, H-5); 7.83 (1H, d,J= 8.0 Hz,H-6); 5.76 (1H, d,J= 5.3 Hz, H-1′); 3.96 (1H, t,J=4.6 Hz, H-2′); 4.01 (1H, t,J= 4.6 Hz, H-3′); 3.82 (1H,q,J= 3.1 Hz, H-4′); 3.61 (1H, dd,J= 12.0, 3.1 Hz,Ha-5′); 3.54 (1H, dd,J= 12.0, 3.1 Hz, Hb-5′);13C-NMR(DMSO-d6)δC: 151.6 (C-2, C); 164.5 (C-4, C); 101.7(C-5, CH); 140.3 (C-6, CH); 88.0 (C-1′, CH); 69.8(C-2′, CH); 73.5 (C-3′, CH); 84.7 (C-4′, CH); 60.8(C-5′, CH2)。其波谱数据与尿嘧啶核苷的文献报道值[20]一致。
化合物11: 无色粉末;1H-NMR (CDCl3)δH: 3.96(1H, m, H-3); 6.50 (1H, d,J= 8.5 Hz, H-6); 6.24 (1H,d,J= 8.5 Hz, H-7); 0.81 (3H, s, H-18); 0.88 (3H, s,H-19); 0.99 (3H, d,J= 6.6 Hz, H-21); 5.14 (1H, dd,J= 15.3, 8.3 Hz, H-22); 5.22 (1H, dd,J= 15.3, 7.6 Hz,H-23); 0.81 (3H, d,J= 6.9 Hz, H-26); 0.83 (3H, d,J=7.1 Hz, H-27); 0.90 (3H, d,J= 6.9 Hz, H-28);13C-NMR (CDCl3)δC: 34.7 (C-1, CH2); 30.1 (C-2,CH2); 66.4 (C-3, CH); 39.4 (C-4, CH2); 82.1 (C-5, C);135.2 (C-6, CH); 130.7 (C-7, CH); 79.4 (C-8, C); 51.1(C-9, CH); 37.0 (C-10, C); 20.6 (C-11, CH2); 36.9(C-12, CH2); 44.6 (C-13, C); 51.7 (C-14, CH); 23.4(C-15, CH2); 28.6 (C-16, CH2); 56.2 (C-17, CH); 12.9(C-18, CH3); 18.1 (C-19, CH3); 39.7 (C-20, CH); 20.9(C-21, CH3); 135.4 (C-22, CH); 132.3 (C-23, CH); 42.8(C-24, CH); 33.1 (C-25, CH); 19.6 (C-26, CH3); 19.9(C-27, CH3); 17.5 (C-28, CH3)。其波谱数据与过氧化麦角甾醇的文献报道值[21]一致。
化合物12: 无色粉末,1H-NMR (CDCl3)δH: 3.64(1H, m, H-3); 2.47 (1H, m, Ha-4); 2.28 (1H, m, Hb-4);5.57 (1H, dd,J= 5.6, 2.4 Hz, H-6); 5.38 (1H, m, H-7);0.95 (3H, s, H-18); 0.63 (3H, s, H-19); 1.03 (3H, d,J=6.7 Hz, H-21); 5.23 (1H, dd,J= 15.2, 7.1 Hz, H-22);5.17 (1H, dd,J= 15.3, 7.7 Hz, H-23); 0.82 (3H, d,J=7.2 Hz, H-26); 0.84 (3H, d,J= 7.2 Hz, H-27); 0.92 (3H,d,J= 6.9 Hz, H-28);13C-NMR (CDCl3)δC: 38.4 (C-1,CH2); 32.0 (C-2, CH2); 70.5 (C-3, CH); 40.8 (C-4,CH2); 139.8 (C-5, C); 119.6 (C-6, CH); 116.3 (C-7,CH); 141.3 (C-8, C); 46.3 (C-9, CH); 37.1 (C-10, C);21.1 (C-11, CH2); 39.1 (C-12, CH2); 42.8 (C-13, C);54.6 (C-14, CH); 23.0 (C-15, CH2); 28.3 (C-16, CH2);55.8 (C-17, CH); 12.1 (C-18, CH3); 16.3 (C-19, CH3);40.4 (C-20, CH); 21.1 (C-21, CH3); 135.6 (C-22, CH);132.0 (C-23, CH); 42.8 (C-24, CH); 33.1 (C-25, CH);19.9 (C-26, CH3); 19.6 (C-27, CH3); 17.6 (C-28, CH3)。其波谱数据与麦角甾醇的文献报道值[20]一致。
化合物13: 无色粉末;1H-NMR (CDCl3)δH: 3.73(1H, m, Ha-1); 3.88 (1H, m, Hb-1); 3.87 (1H, m, H-2);4.26 (1H, br s, H-3); 5.50 (1H, dd,J= 15.7, 6.3 Hz,H-4); 5.78 (1H, m, H-5); 2.07 (2H, m, H-6); 2.06 (2H,m, H-7); 5.09 (1H, t,J= 6.1 Hz, H-8); 1.94 (2H, t,J=7.6 Hz, H-10); 1.36 (2H, m, H-11); 1.31-1.25 (16H, br s, H12-H19); 0.87 (3H, t,J= 6.9 Hz, H-20); 1.58 (3H,s, H-21); 4.54 (1H, d,J= 6.5 Hz, H-2′); 5.53 (1H, dd,J= 15.2, 6.7 Hz, H-3′); 5.88 (1H, dt,J= 15.2, 6.7 Hz,H-4′); 2.04 (2H, m, H-5′); 1.36 (2H, m, H-6′); 1.31-1.25(18H, br s, H7′-H15′); 0.87 (3H, t,J= 6.9 Hz, H-16′);13C-NMR (CDCl3)δC: 61.9 (C-1, CH2); 54.7 (C-2, CH);74.0 (C-3, CH); 128.7 (C-4, CH); 134.0 (C-5, CH);32.5 (C-6, CH2); 27.6 (C-7, CH2); 123.1 (C-8, CH);136.2 (C-9, C); 39.7 (C-10, CH2); 28.0 (C-11, CH2);29.7-29.2 (C12-C17, CH2); 31.9 (C-18, CH2); 22.7(C-19, CH2); 14.1 (C-20, CH3); 16.0 (C-21, CH3);173.6 (C-1′, C); 73.2 (C-2′, CH); 127.0 (C-3′, CH);135.9 (C-4′, CH); 32.3 (C-5′, CH2); 29.0 (C-6′, CH2);29.7-29.2 (C7′-C13′, CH2); 31.9 (C-14′, CH2); 22.7(C-15′, CH2); 14.1 (C-16′, CH3)。 其 波 谱 数 据 与(2S,2′R,3R,3′E,4E,8E)-N-(2′-羟基-3′-十六烯酰基)-9-甲基-4,8-二十碳二烯-1,3-二醇[22]一致。
化合物 14: 无色粉末;1H-NMR (CD3OH)δH:4.14 (1H, dd,J= 9.3, 5.4 Hz, Ha-1); 3.72 (1H, dd,J=10.2, 3.2 Hz, Hb-1); 3.89 (1H, m, H-2); 4.13 (1H, dd,J= 7.1, 5.5 Hz, H-3); 5.48 (1H, dd,J= 16.0, 7.4 Hz,H-4); 5.73 (1H, dt,J= 15.3, 6.6 Hz, H-5); 2.08 (2H, m,H-6); 2.05 (2H, m, H-7); 5.16 (1H, t,J= 5.7 Hz, H-8);1.98 (2H, t,J= 7.3 Hz, H-10); 1.41 (2H, m, H-11);1.36-1.31 (16H, br s, H12-H19); 0.91 (3H, t,J= 7.0 Hz,H-20); 1.60 (3H, s, H-21); 4.43 (1H, d,J= 5.8 Hz,H-2′); 5.48 (1H, dd,J= 16.3, 6.0 Hz, H-3′); 5.85 (1H,dd,J= 15.3, 7.7 Hz, H-4′); 2.03 (2H, m, H-5′); 1.42(2H, m, H-6′); 1.36-1.31 (18H, br s, H7′-H15′); 0.93(3H, t,J= 7.0 Hz, H-16′); 4.28 (1H, d,J= 7.7 Hz,H-1″); 3.20 (1H, t,J= 8.1 Hz, H-2″); 3.36 (1H, t,J=8.8 Hz, H-3″); 3.31 (1H, m, H-4″); 3.30 (1H, m, H-5″);3.89 (1H, br d,J= 11.7 Hz, Ha-6″); 3.71 (1H, dd,J=11.7, 4.3 Hz, Hb-6″);13C-NMR (CD3OH)δC: 69.7 (C-1,CH2); 54.7 (C-2, CH); 72.9 (C-3, CH); 131.0 (C-4, CH);134.5 (C-5, CH); 33.0 (C-6, CH2); 28.8(C-7, CH2);124.9 (C-8, CH); 136.8 (C-9, C); 40.8 (C-10, CH2);29.1 (C-11, CH2); 30.2-30.8 (C12-C17, CH2); 33.1(C-18, CH2); 23.7 (C-19, CH2); 14.4 (C-20, CH3); 16.2(C-21, CH3); 175.5 (C-1′, C); 74.1(C-2′, CH); 129.1(C-3′, CH); 134.8 (C-4′, CH); 33.4 (C-5′, CH2);30.2-30.8 (C6′-C13′, CH2); 33.1 (C-14′, CH2); 23.7(C-15′, CH2); 14.5 (C-16′, CH3); 104.7 (C-1″, CH);75.0 (C-2″, CH); 78.0 (C-3″, CH); 71.6 (C-4″, CH);78.0 (C-5″, CH); 62.7 (C-6″, CH2)。其波谱数据与1-O-β-D-葡萄糖基-(2S,2′R,3R,3′E,4E,8E)-N-(2′-羟基-3′-十六烯酰基)-9-甲基-4,8-二十碳二烯-1,3-二醇的文献报道值[22]一致。
[1]刘爱荣, 吴晓鹏, 徐同. 红树林内生真菌研究进展[J].应用生态学报, 2007, 18(4): 912-918.
[2]黄忠京, 邵长伦, 陈意光, 等. 南海红树林内生真菌ZZF79中吡喃酮类代谢产物的研究[J]. 中山大学学报(自然科学版版), 2007, 46(4): 113-115.
[3]林永成, 周世宁. 海洋微生物及其代谢产物[M]. 北京: 化学工业出版社, 2002.
[4]Lin Y C, Wu X Y, Feng S, et al. Five unique compounds: xyloketals from mangrove fungusXylariasp.from the South China Sea coast [J]. J Org Chem, 2001,66(19): 6252-6256.
[5]Li D L, Li X M, Wang B G. Natural anthraquinone derivatives from a marine mangrove plant-derived endophytic fungusEurotium rubrum: structural elucidation and DPPH radical scavenging activity [J]. J Microbiol Biotechnol, 2009, 19(7): 675-680.
[6]Yan H J, Li X M, Li C S, et al. Alkaloid and anthraquinone derivatives produced by the marine-derived endophytic fungusEurotium rubrum[J]. Helv Chim Acta, 2012, 95(1): 163-168.
[7]Li D L, Li X M, Li T G, et al. Dioxopiperazine alkaloids produced by the marine mangrove derived endophytic fungusEurotium rubrum[J]. Helv Chim Acta, 2008, 91(10): 1888-1893.
[8]Li D L, Li X M, Li T G, et al. Benzaldehyde derivatives fromEurotium rubrum, an endophytic fungus derived from the mangrove plantHibiscus tiliaceus[J]. Chem Pharm Bull, 2008, 56(9): 1282-1285.
[9]Liu D, Li X M, Li C S, et al. Nigerapyrones A–H,α-pyrone derivatives from the marine mangrove-derived endophytic fungusAspergillus nigerMA-132 [J]. J Nat Prod, 2011, 74(8): 1787-1791.
[10]Li Z Y, Peng C S, Shen Y, et al. L, L-Diketopiperazines fromAlcaligenes faecalisA72 associated with South China Sea spongeStelletta tenuis[J]. Biochem Syst Ecol, 2008, 36(3): 230-234.
[11]Madeline A, Andrea R R, Phillip C. New and known diketopiperazines from the Caribbean sponge,Calyxcf.podatypa[J]. J Nat Prod, 1995, 58(2): 201-208.
[12]Tullberg M, Grotli M, Luthman K. Efficient synthesis of 2, 5-diketopiperazines using microwave assisted heating [J]. Tetrahedron, 2006, 62(31): 7484-7491.
[13]Hamasaki T, Nagayama K, Hatsuda Y. Two new metabolites, sydonic acid and hydroxysydonic acid,fromAspergillus sydowii[J]. Agric Biol Chem, 1978,42(1): 37-40.
[14]Domnin I N, Remizova L A, Misharev A D, et al.Fragmentation of some 4H-pyran-4-one and pyridin-4-one derivatives under electron impact [J]. Russ J Org Chem (Engl. Transl.), 2008, 44(9): 1369-1373.
[15]李凤梅. 曲酸对大肠杆菌和金黄色葡萄球菌的抑制作用研究 [J]. 食品研究与开发, 2008, 29(6):190-192.
[16]苏国成, 汤凤霞, 杨秋明, 等. 曲酸对常见食品污染菌的抑制作用 [J]. 食品与发酵工业, 2005, 31(3):47-51.
[17]Li Y, Li X F, Kim D S, et al. Indolyl alkaloid derivatives, Nb-acetyltryptamine and oxaline from a marine-derived fungus [J]. Arch Pharm Res, 2003, 26(1):21-23.
[18]Zhao P J, Wang H Y, Li G H, et al. Secondary metabolites from endophyticStreptomycessp. Lz531 [J]. Chem Biodiversity, 2007, 4(5): 899-904.
[19]Jones A J, Grant D M, Winkley M W, et al. Carbon-13 magnetic resonance. XVII. Pyrimidine and purine nucleosides [J]. JACS, 1970, 92(13): 4079-4087.
[20]Pretsch E, Bühlmann P. 波谱数据表—有机化合物的结构解析[M]. 荣国斌译. 上海: 华东理工大学出版社, 2002, 154, 237.
[21]Yue J M, Chen S N, Lin Z W, et al. Sterol from the fungusLactarium volemus[J]. Phytochemistry, 2001,56(8): 801-806.
[22]Zhang Y, Wang S, Li X M, et al. Sphingolipids with previously unreported 9-methyl-C20-sphingosine moiety from algous endophytic fungusAspergillus niger[J].Lipids, 2007, 42(8): 759-764.
