麻疯树分子生物学研究进展
2012-09-29杨静刘永平刘蕴杨明峰
杨静,刘永平,刘蕴,杨明峰
1 中北大学化工与环境学院,山西 太原 030051
2 中国科学院动物研究所,北京 100101
3 北京农学院 农业部都市农业 (北方) 重点开放实验室,北京 102206
麻疯树分子生物学研究进展
杨静1,刘永平1,刘蕴2,杨明峰3
1 中北大学化工与环境学院,山西 太原 030051
2 中国科学院动物研究所,北京 100101
3 北京农学院 农业部都市农业 (北方) 重点开放实验室,北京 102206
麻疯树Jatropha curcas L.作为一种新兴的生物柴油型能源树种已经得到广泛的认可,关于它的各项研究持续升温。文中综述了近年来国内外关于麻疯树分子生物学方面的研究进展,一是揭示麻疯树遗传多样性和系统分类的分子标记研究;二是全面解析麻疯树分子网络的基因组、转录组和蛋白质组研究;三是以培育优质高抗品系为目标的代谢和发育调控相关基因的分离、克隆和功能研究;最后讨论了目前研究的不足和麻疯树未来分子生物学研究的方向。
麻疯树,分子标记,基因组,转录组,蛋白质组,脂肪酸合成,非生物胁迫
Abstract:Jatropha curcas L., has been widely recognized as a potential source of biodiesel. In this review, we presented several aspects about the recent progress in molecular biology of J. curcas. First, molecular markers were used to assess its genetic diversity. Second, large-scale genome, transcriptome and proteome analyses were applied for decoding itsmolecular network. Third, functional characterization of key genes involved in metabolism and regulation of plant development was performed to breed lines with higher quality or higher resistance. Finally, we discussed the limitation of current progress and then proposed the future molecular biology research on J. curcas.
Keywords:Jatropha curcas, molecular marker, genome, transcriptome, proteomics, fatty acid biosynthesis, abiotic stress
麻疯树 Jatropha curcas L.为大戟科(Euphorbiaceae) 麻疯树属植物,又名小桐子、假花生、油桐等,多年生小乔木或灌木,成株高3~4米,多分枝,速生、幼枝粗壮,具有较强的耐干旱瘠薄能力[1-2]。原产中美洲,后引种到东南亚各国,分布于热带、亚热带地区,我国广西、广东、云南、四川、贵州、福建、海南等地均有栽培或野生。麻疯树林单年可以挂果,3年可投入生产,5年进入盛果期,果实采摘期长达50年,是国际上公认的最有发展潜力的生物质能源树种之一[2-3]。
由于麻疯树具有作为可再生能源植物的巨大潜能,近年来国内外利用各种分子生物学手段全面开展了关于麻疯树遗传多样性、系统分类、组学和功能基因等多项研究。这些研究为深入阐明麻疯树的生长发育机理、改善品质、提高产量、最终实现对其果油的高效利用奠定了基础。
1 分子标记和遗传多样性分析
随着分子生物学的不断发展,以 PCR为基础建立起来的分子标记技术不仅有利于种质资源和系统分类的研究,还有利于功能性标记基因的定位和筛选,这将更好地为生物育种提供帮助。其中主要的分子标记技术有:随机扩增多态性DNA (Random amplified polymorphic DNA,RAPD) 标记,扩增片段长度多态性 (Amplified fragment length polymorphism,AFLP) 标记,简单重复序列 (Simple sequence repeats,SSR) 标记,简单重复序列区间 (Inter simple sequence repeats,ISSR) 标记,特定序列扩增区域(Sequence-characterized amplified region,SCAR)标记等。
麻疯树的分子标记研究主要集中在印度和中国,包括种间和种内鉴定,鉴定的样品最少2个,最高的224个。从Sujatha研究团队的研究内容我们很容易看到世界麻疯树分子标记研究的发展轨迹,早在2005年他们用RAPD技术来研究一个印度有毒种与一个墨西哥无毒种之间的相似度[4],此后,他们又分别运用RAPD、ISSR和 SCAR三种技术评价印度不同地区的有毒种与墨西哥无毒种之间的遗传多样性,共计 42个样本,其结论是:同一地区不同生态型的麻疯树变异程度很小[5],这与我国和巴西的研究结果相似[6-7]。因此,研究人员逐渐扩大样品的采集地,最终发现来自中美洲的样本具有较高的遗传多样性,而非洲和印度地区的变异度则很低。随着EST数据库的不断挖掘和大戟科其他物种信息的补充,36条EST-SSRs和20条基因组SSRs被用于研究来自印度尼西亚、南美、云南、海南和格林纳尔等地的 45个样本,发现不同区域的类群变异度比同一类群的变异度大[8]。总的来说麻疯树的遗传基础较窄,在育种改良方面还需要扩大范围,进行诸如突变、种内/种间杂交等研究。
除了针对基因组变异的研究外,同工酶技术也是了解种群内遗传变异的有力工具。张炜等[9]选取云南、四川2个省区10个麻疯树品种,分析了它们7种酶系统7个位点上21个等位基因的遗传变异,相比较而言,西南地区的麻疯树具有较高的遗传多样性,而这种多样性与种群的地理分布无关;种群内部杂合程度较高,推测可能存在自交不育现象。
2 基因组学、转录组学和蛋白质组学研究
2.1 基因组学
麻疯树有 22条染色体,是典型的二倍体生物。它的基因组大概有416 Mbp,属于比较理想的基因组测序植物[10]。目前,SGI公司 (Synthetic Genomics Inc.) 和ACGT公司 (Asiatic Centre for Genome Technology) 运用 Sanger双脱氧法和二代测序技术已经能够估计出基因组大约有400 Mbp,与水稻基因组大小差不多,并公布了完整的首个麻疯树基因组草图 (http://www.acgt.asia/press/pdf/20May2009.pdf)。之后Sato小组利用周期短、费用低的双脱氧法和最新测序综合技术测定了麻疯树基因组序列,结果显示:非冗余序列的基因组全长2.85 Mbp,包含12万个重叠群 (Contigs) 和2.9万个单一序列 (Singlets),大约有 1 529个(4%) 预测编码蛋白的基因是麻疯树特有的[11]。
由于叶绿体和质体是植物合成脂肪酸的主要场所,因此麻疯树叶绿体基因组 (cpDNA) 也备受关注,目前公布的测序结果显示这个闭合环状的分子有163 856 bp长,编码110个独立基因(其中78个蛋白、4个rRNA和28个tRNA),它的大小和基因排布与其他树种相似,系统树分析发现它与木薯的亲缘关系最近[12]。这项数据还能为以叶绿体为基础的遗传转化体系的建立提供相应的信息。
2.2 转录组学
基于麻疯树种子油的重要价值,许多的转录组学研究集中在麻疯树种子、生殖器官等。研究人员先后从王治涛等[13]构建的麻疯树胚乳cDNA文库筛选到多个与油脂代谢和逆境响应有关的功能基因,并在此后的几年中开展了基因全长、表达模式等方面的深入研究。Natarajan等[14]从麻疯树发育中的种子 cDNA文库获得 12 084个EST序列,平均长度为576 bp,这些序列片段与油脂合成相关的许多生物功能有关。Wang等[15]用麻疯树的生殖器官构建了 2个 cDNA文库,共得到9 289条平均长度为603 bp的EST序列,这些序列经过组装得到4 502条独立基因序列 (UniSeqs),选择 50条 EST序列在叶、花和种子中的相对表达水平进行了定量分析,发现其中6条在1~2个麻疯树组织中检测到,这些基因可能编码高表达的油脂合成相关蛋白和转录因子。
为了改善逆境条件下麻疯树的生长状态,Eswaran等[16]利用盐敏感的酵母菌种筛选麻疯树根的cDNA文库,从20 000个转化子中筛选出345个阳性克隆,从中获得32个全长基因。选择胚胎晚期积累蛋白基因 LEA5、胞质抗坏血酸氧化酶基因Apx1、肌动蛋白抑制蛋白基因profilin、金属硫蛋白基因metallothionein和磷脂结合蛋白基因annexin 5个基因检测它们在盐胁迫下根、叶中的表达情况,结果发现它们都在胁迫2 h后发生变化,说明它们都与胁迫早期响应有关,但是在根、叶中的表达规律各异,说明在抵御胁迫时,不同的组织采取不同的抵抗机制。这些表达序列EST和相关基因的功能解析,将为麻疯树的育种工作提供无价的基因资源。
2.3 蛋白质组学
麻疯树的蛋白质组学研究也聚焦到油体功能和油脂的生物合成上。通过对麻疯树种子萌发过程中胚乳油脂变化的比较分析发现油脂的利用主要在萌发的早期,而且涉及到β氧化、乙醛酸循环、TCA循环、糖异生和戊糖等多个途径[17]。Polluechai等[18]对油体的进一步研究中发现3个油体蛋白oleosins (JcOle1,JcOle2,JcOle3),比较发现 JcOle3的表达水平是其他两个基因的 5倍,而且它呈现等位基因变异和内含子区域的单核苷酸多态性现象,因此可以作为系统分类的标记基因和分子育种的侯选基因。除了油体,对麻疯树成熟种子中胚和胚乳可溶性蛋白的比较研究中发现它们差异蛋白集中在油脂动员、信号转导、转录、蛋白质合成以及细胞周期等几个与种子萌发相关的途径中,胚乳中的差异蛋白主要是与分解代谢相关的酶,负责给生长中的胚提供营养;而胚中的差异蛋白主要是与合成代谢相关的酶,负责利用胚乳提供的营养物质为进一步生长服务[19]。
Liang等[20]等用差异蛋白质组学技术,配合叶绿素荧光等光合参数,在低温处理下麻疯树幼苗叶片中鉴定到8个有显著变化的蛋白,其中包括与光合作用有关的ATP合成酶、FeS蛋白、过氧化氢酶 (CAT) 和谷胱甘肽还原酶 (GR) 等,并推测麻疯树对低温的响应可能更多地选择CAT途径。
3 功能基因分析和研究
3.1 油脂合成相关基因
麻疯树种子含油量丰富,脂肪酸组成和菜籽油非常相似,种子中提取的生物柴油可生物降解,比传统的柴油更加清洁和高效,因此几乎所有与麻疯树脂肪酸合成有关的蛋白基因都得到了相应的研究。
乙酰辅酶 A 羧化酶 (Acetyl CoA carboxylase,ACCa) 广泛存在于生物界,是催化乙酰辅酶A和羧化生成丙二酰辅酶A的生物素酶。此反应制约着脂肪酸合成第一阶段的速度,属于脂肪酸合成的限速酶。从麻疯树中分离得到的ACCa基因长1 149 bp,编码383个氨基酸。将麻疯树幼苗分别置于pH 8.0和pH 7.0的生长环境中,发现在pH 8.0的培养条件下,叶片无论发育的早期、中期和晚期ACCa的表达量更高。相应的,黑暗条件下果实中的ACCa的量也增加。如果施加高光胁迫,在果实发育的早、中和晚期ACCa的量发生显著波动,说明ACCa基因表达与叶片和果实的生长条件和发育阶段有关[21]。从麻疯树中分离、鉴定的各类基因信息详见表1。
酰基载体蛋白 (Acyl carrier protein,ACP)结合一系列的脂肪酸合成酶共同完成脂肪酸的碳链加长反应,在脂肪酸的合成过程中起核心作用。从麻疯树胚乳cDNA文库中筛选分离得到的JcACP序列推测的氨基酸序列,与其他物种已知ACP氨基酸序列同源性不高,但是具有“LEEEF”和“LGLDSLDTVEVVMA”两个保守区,这两个区域正好是 4′-磷酸泛酰巯基乙胺辅基的结合位点,是酰基载体蛋白的特征区。该基因在叶、茎和种子中表达,在根中不表达,以种子中的表达量最高,并且种子萌发后其表达量随萌发进程递增,在96 h时表达量达到最高,推测在种子中的这种高量表达可能与种子萌发时的代谢活动有关[22]。
酮脂酰载体蛋白合成酶 (Ketoacyl-acyl carrier protein (ACP) synthase III,KAS III) 是催化细菌或质体中脂肪酸合成中第一个延长反应的关键酶,而KAS I和KAS II分别催化ACP-4∶0到ACP-16∶0和ACP-16∶0到ACP-18∶0的碳链延伸[23]。过量表达KAS III的烟草、拟南芥和葡萄中 C16∶0的脂肪酸量都有增加[24]。酰基-ACP硫酯酶 (Acyl-acyl carrier protein (ACP)thioesterase (TE),FATB) 能够水解酰基-ACP上的硫酯,释放出脂肪酸和ACP,是控制脂肪酸长链终止点的关键酶。研究发现 JcKAS III和JcFATB1在基因组中都是单拷贝的,并且能够在根、茎、叶、花和种子中表达,在种子萌发过程中基因的表达量也在逐渐增大,其中前者在根中的表达量最大,后者在种子中表达量最大[25-26]。在过量表达 JcFATB1的拟南芥中检测到饱和脂肪酸含量增加,特别是其中的棕榈酸的量,而不饱和脂肪酸的量下降。因此,推测JcFATB1作为一个酰基-ACP硫酯酶,能够通过提高棕榈酸含量改变麻疯树种子油的组分[26]。
硬酯酰载体蛋白去饱和酶 (Stearoyl-acyl carrier protein (ACP) desaturase,SAD) 定位在质体基质中,主要催化硬脂酰-ACP脱饱和成油酰-ACP,是控制高等植物脂肪酸中饱和与不饱和键比率的,这个比率的高低与植物的许多生理功能有关,特别是与植物的抗冷性相关[27]。麻疯树的JcSAD的氨基酸序列与蓖麻的相似度高达96%。JcSAD在根、茎、叶、花、果皮和种子都有表达,其中果皮和种子中表达量最大。通过原核表达获得的JcSAD,能够将外源硬脂酰-ACP转化成油酰-ACP,具有去饱和酶活性[28]。在利用病毒诱导基因沉默 (VIGS) 方法检测麻疯树包括脂肪酸合成、发育调控、毒蛋白合成相关的13个基因功能时发现,JcKAS II和JcFATB确实在脂肪酸链长和饱和/不饱和比率中起重要作用,而且JcSAD1在种子的甘油三酯积累阶段表达量较高[29]。
ω3 脂 肪 酸 去 饱 和 酶 (ω3-fatty acid desaturase,FAD3) 是内质网和叶绿体中将二烯脂肪酸去饱和生成三烯脂肪酸的关键酶。三烯脂肪酸属于多不饱和脂肪酸,是植物细胞膜的重要组成成分,叶绿体膜中的这种脂肪酸占到了总脂肪酸的80%。从拟南芥中分离得到定位在内质网中的 FAD3,和定位在质体中的 FAD7,8,其中FAD8与低温响应有关[30-31]。从麻疯树中克隆得到的JcFAD7的6个外显子 (从第2个到第7个)的大小与拟南芥的 FAD7,8是一样的。在转pYJcFAD7质粒的酵母中加入亚油酸能检测到新的C18∶3脂肪酸出现,且所占比例达到2.5%,说明 JcFAD7编码的脂肪酸去饱和酶能够在 ω3的位置上将亚油酸去饱和,但是JcFAD7的表达与温度变化无关[32]。图1显示各酶在麻疯树脂肪酸合成途径中的基本位置和作用。
Xu等[33]利用实时定量PCR研究麻疯树种子发育过程中与脂肪酸和甘油三酯合成相关的 21个油脂基因,比较全面地了解到这些基因在种子发育过程中的表达变化,为更好地研究麻疯树种子油脂积累提供了一些基础数据信息。
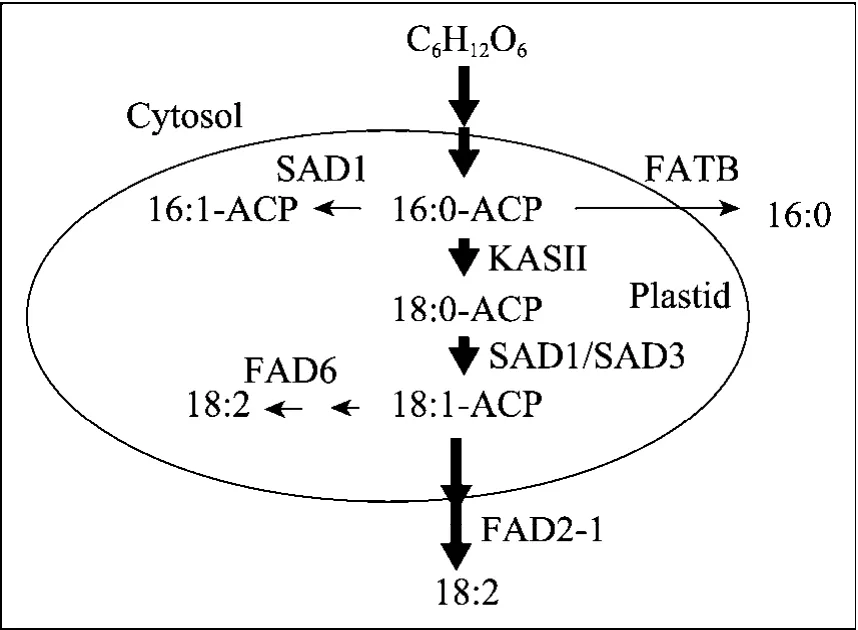
图1 麻疯树脂肪酸合成模型[27]Fig. 1 A model for fatty acid (FA) biosynthetic pathway in J. curcas[27].
磷酸烯酮式丙酮酸羧化 (Phophoenlpyuvate carboxylase,PEPcase) 主要参与植物 C4代谢途径CO2固定作用。研究发现转反义PEPC的转基因大豆和水稻提高了籽粒的油脂含量[34-35]。目前,克隆到的JcPEPC属于该基因家族中PEPC1,其蛋白为C3型PEPC,与蓖麻、陆地棉、橙、大豆、花生的氨基酸序列同源性都超过 90%[36]。推测通过反义抑制技术控制麻疯树PEPC基因的表达,可提高麻疯树种子含油量。
3.2 抗逆相关基因
3.2.1 毒蛋白基因curcin和curcin-L
不同来源的核糖体失活蛋白 (Ribosome inactivating proteins,RIPs) 在抗真菌、抗病毒和抗肿瘤方面表现出独特的作用,具有十分重要的生物学功能。它们是一种能使核糖体28S rRNA的保守α茎环结构域脱嘌呤的蛋白质。目前,已经发现两种麻疯树RIP,分别是种子中的毒蛋白curcin和叶片中的逆境诱导蛋白 curcin-L。早在1976年 Stirpe等[37]就对麻疯树毒蛋白进行了初步分离,并将其中有活性的产物命名为curcin1;此后林娟等[38]对该蛋白的毒性、编码基因以及启动子进行了更深入的研究。curcin只在种子的胚乳中积累,且表达始于心型胚时期,成熟时达到最高[39-40]。将该基因5'侧翼区620 bp (EF612739)长的片段插入pBI121载体,替换其中的 CaMV 35S启动子,并在相应的转基因烟草中检测报告基因 GUS的表达情况,结果显示该启动子驱动的 GUS在烟草种子胚乳中特异性表达,与它调控的curcin基因表达模式相似,其作用始于心形胚时期,并持续到种子成熟[41]。
另一个 curcin-L在受脱落酸、水杨酸、干旱、高温、低温和 UV等胁迫诱导时在叶片中表达[40]。用 curcin-L基因 5'端 654 bp (EF612740)侧翼序列替换pBI121转烟草的实验中,通过检测转基因烟草的GUS表达量证实:它在叶片中特异表达,并且响应以上 6种胁迫的诱导,其中对于PEG模拟的干旱响应最明显[42]。这些结果拓展了我们对麻疯树核糖体失活蛋白的了解,不仅有毒性蛋白 curcin,还有抗逆蛋白curin-L。
3.2.2 ERF转录因子基因 (JcERF) 和 DREB转录因子基因 (JcDREB)
尽管麻疯树在抗旱、耐盐、耐贫瘠等方面表现突出,但是要想获得果实高产且含油量高的种植结果,还必须对麻疯树抵御生物和非生物逆境反应进行相应的研究,以期获得耐受胁迫能力更强的植株。除了前面介绍的利用盐敏感型酵母筛选麻疯树根部耐盐基因的报道[16]以外,Tang等[43-44]先后从高盐、干旱和低温胁迫的幼苗叶片中克隆到了JcERF和JcDREB,研究发现它们均在高盐、干旱、ABA等逆境胁迫条件下大量表达,在过量表达JcERF和JcDREB的拟南芥中显示了比野生型更好的抗性特征,说明这两个基因在麻疯树忍受非生物胁迫中起重要作用。
3.2.3 肌醇-1-磷酸合成酶基因JcMIPS
肌醇-1-磷酸合成酶 (Myo-inositol-1-phosphatesynthase,MIPS) 在真核生物中是非常保守的,可催化 6-磷酸葡萄糖转化为肌醇-1-磷酸,是肌醇生物合成的限速酶[45]。肌醇作为一种重要的渗透保护物质不仅是植物细胞中磷元素的主要贮存形式,而且在信号转导、保护植物免受外部逆境伤害、激素贮存与运输等方面都起到重要作用。苟春宝等[46]和Wang等[47]研究发现干旱、高盐、低温和 ABA胁迫不仅诱导 JcMIPS的表达,还能使与 JcMIPS 5′端不同缺失片段相连的 GUS报告基因在烟草叶片原生质体中瞬时表达,说明JcMIPS对各种逆境的响应可能源于启动子的某个核心区域的调控。
3.2.4 水通道蛋白基因JcPIP和JcPIP2
植物水通道蛋白 (Aquaporin) 是水分快速进出细胞的主要途径。根据它们的分布和在细胞器上的定位不同将它们分为 4大类,其中最常见的就是质膜内膜蛋白 (Plasma membrane intrinsic protein,PIPs) 和液泡膜内膜蛋白(Tonoplast intrinsic protein,TIPs)。从麻疯树中克隆到的JcPIP和JcPIP2的氨基酸序列与蓖麻、葡萄和菠菜 PIP蛋白在进化上亲缘关系较近。将 JcPIP2互补 RNA (complementary RNA,cRNA) 注入非洲爪蟾卵母细胞后改变了细胞膜的水通透性,说明它具有水通道蛋白功能,它能够在根、茎和叶中表达,但是只有JcPIP2在干旱胁迫条件下诱导表达[48],JcPIP基因诱导表达变化不明显[49]。
3.2.5 甜菜碱醛脱氢酶基因JcBD1
在植物、动物、细菌和藻类的许多物种中,甜菜碱作为一种无毒渗透剂,不仅能在水分亏缺时起到保护作用,还能在各种胁迫条件下维持蛋白和膜结构。甜菜碱醛脱氢酶 (Betaine aldehyde dehydrogenase,BADH) 能催化甜菜碱醛不可逆的转变为甜菜碱,是甜菜碱生物合成途径中的关键酶。该酶的基因JcBD1能在根、茎、叶、花和未成熟种子中表达,其中叶和茎中的表达量最高。Southern杂交分析发现该基因是多拷贝的,属于一个多基因家族。在高盐、高温和干旱条件下,JcBD1的表达量明显提高,表达JcBD1蛋白的大肠杆菌在高盐环境中长势明显好于对照[50]。
3.2.6 细胞质II类小热激蛋白基因JcHSP17.5
多种胁迫环境下,生物体内会产生一组分子量大小在15~42 kDa的小热激蛋白 (Small heat shock proteins,sHSPs),它们具有分子伴侣的功能,能够在不依赖ATP的情况下阻止在逆境胁迫下变性蛋白的累积以及保护蛋白的正确折叠,从而减少胁迫对生物的伤害[51]。从麻疯树胚乳cDNA文库中筛选到一条编码157个氨基酸的胞质类小热激蛋白基因JcHSP17.5,该基因经过在大肠杆菌以及酿酒酵母中过量表达的研究发现两种重组菌在逆境下都较对照组生活力有显著提高,有较好的耐热和耐渗透胁迫能力,推测JcHSP17.5在麻疯树生长过程中可能与麻疯树耐热、耐旱以及耐离子胁迫相关[52]。
3.2.7 翻译肿瘤调节肿瘤蛋白基因JcTCTP
翻译肿瘤调节肿瘤蛋白 (Translationally controlledtumor protein,TCTP) 基因最早是从人类肿瘤细胞中克隆到,发现其在翻译水平上受到控制,因此得名[53]。目前对TCTP的研究主要集中在哺乳动物和寄生虫中,对于植物中的 TCTP作用及其机制尚不清楚。但是在对JcTCTP表达模式的研究中发现它呈现一定的组织和时间特异性:在Ⅰ期胚乳、胚和茎中最为丰富,而在Ⅱ期胚乳和花中表达最弱[54]。它还受到高温、NaCl和乙烯的诱导,推测可能与麻疯树耐高温、耐贫瘠的特性有关[55]。
3.2.8 ADP核糖基化因子基因JcARF
ADP核糖基化因子 (ADP-ribosylation factor,ARF) 是小 G 蛋白家族 (RAS、RHO、RAB、ARF和 RAN) 的一员,它们参与诸如基因表达、细胞骨架重组和微管形成等生理活动。从麻疯树cDNA文库中筛选到的JcARF,编码的预测蛋白具有典型的 GTP结合蛋白家族特有的P 框 (GLDAAGKT)、G′框(DVGGQ)和 G 框(NKQDL)。研究发现 JcARF在花中的表达要比在根、茎、叶、胚乳中的表达丰富得多,此外该基因还受干旱、低温的诱导,但是对NaCl胁迫不敏感[56]。后来还发现,乙烯利诱导提高的表达量比干旱和低温的诱导更加明显,JcARF可能与植物激素参与的信号转导有关[57]。
3.3 发育相关基因
3.3.1 DOF转录因子基因JcDof1-3
拟南芥中 AtCDFs (CYCLING DOF FACTOR) 是一组研究得最清楚的参与光周期反应调控开花的Dof (DNA binding with one finger)转录因子[58-60]。在对它们的系列研究中发现,过量表达 AtCDF1的转基因拟南芥的开花时间推迟,而转反义OsRdd1-AS (与AtCDF的同源基因)的水稻表现出开花推迟、植株矮小和种子变小的现象[61]。我们从麻疯树中克隆到3个Dof转录因子基因JcDof1-3,研究发现JcDof1和JcDof3的表达在长日照和短日照条件下均呈现有规律的生物钟振颤,但是在3 d的连续光照后,它们的表达呈现JcDof1量更高,而JcDof3波峰出现更早的情况,在与开花调控有关的拟南芥蛋白FKF1、ZTL、ASK2、LKP2和GI的酵母双杂交试验中,发现JcDof1只与ASK2结合,而JcDof3能与ASK2和LKP2结合,说明它们可能采取不同的蛋白降解途径来调控麻疯树的开花时间,推测它们在调控麻疯树的开花过程中扮演着既冗余又互补的角色[62-63]。如果能变麻疯树的持续开花/结果特性为同步开花/结果,将大大提高采收效率,为麻疯树的产业化发展发展扫清道路,也是麻疯树育种方向之一。
3.3.2 F-Box蛋白基因JcFbl1
F-box蛋白广泛存在于各种真核生物中,最早在酵母中研究发现 F-box蛋白参与组成 SCF复合体,这个复合体又参与泛素降解途径介导的信号转导,经过研究证明F-box蛋白一般都通过SCF复合体参与了植物生长和发育的各种重要生理过程,如激素应答、昼夜节律、光形态建成、抗逆性等。高帆等[64]从麻疯树胚乳cDNA文库中筛选出一条与在动、植物生长发育过程中起重要调控作用的 F-box家族序列相似的EST序列,并进一步克隆得到含有完整编码框的 cDNA全长和基因组序列,遗憾的是该文仅对其进行了生物信息学分析和构建了真核表达载体,而对该蛋白可能参与的生理功能没有进一步的研究和发掘。
4 小结与展望
虽然关于麻疯树分子生物学方面的研究逐年增加,取得了很多可喜的成绩,但是不得不承认许多研究起步较晚,很多的基因组、转录组信息还有待进一步分析鉴定。对于功能基因的分离、克隆多限于表达模式分析和原核表达阶段,对于转基因功能验证方面的工作开展较少,目前尚未见到油脂含量增加或是抗性提高的转基因麻疯树的报道。因此,还必须对大量未知的和已知的基因和蛋白进行更为详尽的分析和鉴定,不仅仅是通过异源转基因植物鉴定其功能,更重要的是找到提高脂肪酸含量、提高植株抗逆性和调控植株开花时间的关键基因,为麻疯树育种和产业化发展服务。
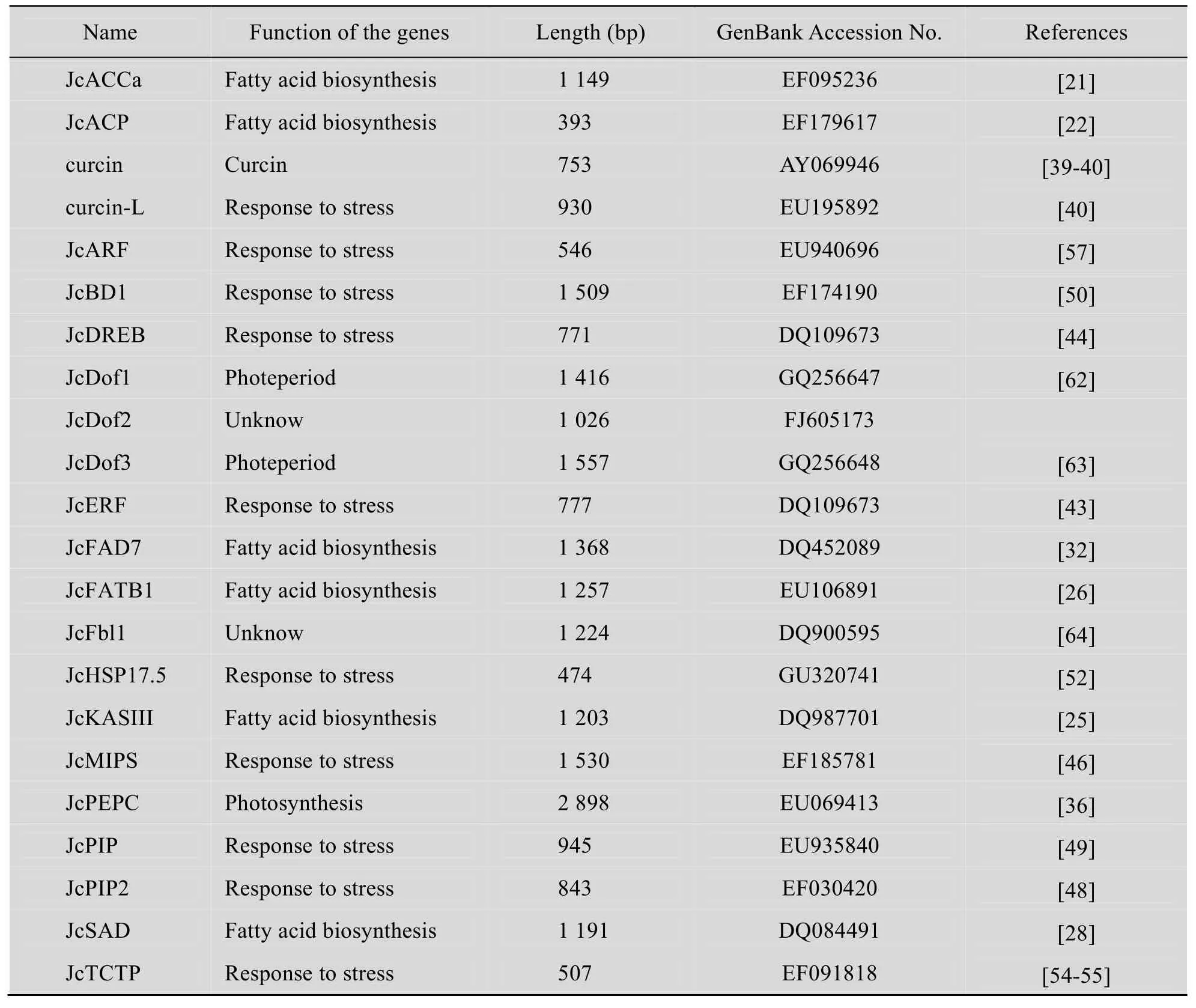
表1 麻疯树中分离鉴定的基因Table 1 Cloning and characterization of genes in J. curcas
REFERENCES
[1] Openshaw K. A review of Jatropha curcas: an oil plant of unfulfilled promise. Biomass Bioenerg,2000, 19(1): 1−15.
[2] Heller J. Physic nut Jatropha curcas L. Rome:International Plant Genetic Resources Institute,1996: 10−17.
[3] Lou YP, Gu XP, Gu SH, et al. Research progress on cultivation of Jatropha curcas. Guizhou Agri Sci, 2009, 37(2): 33−36.
娄彦萍, 谷晓平, 古书鸿, 等. 小油桐种植研究进展. 贵州农业科学, 2009, 37(2): 33−36.
[4] Sujatha M, Makkar HPS, Becker K. Shoot bud proliferation from axillary nodes and leaf sections of non-toxic Jatropha curcas L. Plant Growth Regul, 2005, 47(1): 83−90.
[5] Basha S, Sujatha M. Inter and intra-population variability of Jatropha curcas (L.) characterized by RAPD and ISSR markers and development of population-specific SCAR markers. Euphytica,2007, 156(3): 375−386.
[6] Grativol C, Lira-Medeiros CF, Hemerly AS, et al.High efficiency and reliability of inter-simple sequence repeats (ISSR) markers for evaluation of genetic diversity in Brazilian cultivated Jatropha curcas L. accessions. Mol Biol Rep, 2011, 38(7):4245−4256.
[7] Sun QB, Li LF, Li Y, et al. SSR and AFLP markers reveal low genetic diversity in the biofuel plant Jatropha curcas in China. Crop Sci, 2008, 48(5):1865−1871.
[8] Wen MF, Wang HY, Xi ZQ, et al. Development of EST-SSR and genomic-SSR markers to assess genetic diversity in Jatropha curcas L. BMC Res Notes, 2010, 3(1): 42−50.
[9] Zhang W, Luo JX, Gu YJ, et al. Allozyme variation of genetic diversity in natural populations of Jatropha curcas germplasm from different areas in Southwest China. Chin J Plant Ecol, 2011, 35(3):330−336.
张炜, 罗建勋, 辜云杰, 等. 西南地区麻疯树天然种群遗传多样性的等位酶变异. 植物生态学报, 2011, 35(3): 330−336.
[10] Carvalho CR, Clarindo WR, Prac MM, et al.Genome size, base composition and karyotype of Jatropha curcas L., an important biofuel plant.Plant Sci, 2008, 174(6): 613−617.
[11] Sato S, Hirakawa H, Isobe S, et al. Sequence analysis of the genome of an oil-bearing tree,Jatropha curcas L. DNA Res, 2011, 18(1): 65−76.
[12] Asif MH, Mantri SS, Sharma A, et al. Complete sequence and organisation of the Jatropha curcas(Euphorbiaceae) chloroplast genome. Tree Genet Genomes, 2010, 6(6): 941−952.
[13] Wang ZT, Gao F, Zhang SW, et al. Construction and analysis of Jatropha curcas L. endosperm cDNA library. J Sichuan Univ: Nat Sci Ed, 2007,44(1): 173−175.
王治涛, 高帆, 张淑文, 等. 麻疯树胚乳 cDNA文库的构建与分析. 四川大学学报: 自然科学版,2007, 44(1): 173−175.
[14] Natarajan P, Kanagasabapathy D, Gunadayalan G,et al. Gene discovery from Jatropha curcas by sequencing of ESTs from normalized and full-length enriched cDNA library from developing seeds. BMC Genomics, 2010, 11(1): 606−619.
[15] Wang W, Wei DM, Pun S, et al. Profiling of gene expression in the reproductive organs of Jatropha curcas. China Biotechnol, 2011, 31(6): 38−48.
[16] Eswaran N, Parameswaran S, Sathram B, et al.Yeast functional screen to identify genetic determinants capable of conferring abiotic stress tolerance in Jatropha curcas. BMC Biotechnol,2010, 10(23): 1−15.
[17] Yang MF, Liu YJ, Liu Y, et al. Proteomic analysis of oil mobilization in seed germination and postgermination development of Jatropha curcas. J Proteome Res, 2009, 8(3): 1441−1451.
[18] Popluechai S, Froissard M, Jolivet P, et al.Jatropha curcas oil body proteome and oleosins:L-form JcOle3 as a potential phylogenetic marker.Plant Physiol Biochem, 2011, 49(3): 352−356.
[19] Liu H, Yang ZL, Yang MF, et al. The differentialproteome of endosperm and embryo from mature seed of Jatropha curcas. Plant Sci, 2011, 181(6):660−666.
[20] Liang Y, Chen H, Tang MJ, et al. Responses of Jatropha curcas seedlings to cold stress:photosynthesis-related proteins and chlorophyll fluorescence characteristics. Physiol Plant, 2007,131(3): 508−517.
[21] Xie WW, Gao S, Wang SH, et al. Cloning and expression analysis of carboxyltransferase of acetyl-coA carboxylase from Jatropha curcas. Z Naturforsch C, 2010, 65(1/2): 103−108.
[22] Jiang LD, Wang YX, Wang YC, et al. Gene cloning and expression analysis of acyl carrier protein in Jatropha curcas L.. Chin J Appl Environ Biol,2008, 14(6): 769−773.
江璐玎, 王云霄, 王迎春, 等. 麻疯树酰基载体蛋白的基因克隆、表达分析及原核表达. 应用与环境生物学报, 2008, 14(6): 769−773.
[23] Jaworski JG, Clough RC, Barnum SR. A cerulenin insensitive short chain 3-ketoacyl-acyl carrier protein synthase in spinacia oleracea Leaves. Plant Physiol, 1989, 90(1): 41−44.
[24] Dehesh K, Tai H, Edwards P, et al. Overexpression of 3-ketoacyl-acyl-carrier protein synthase IIIs in plants reduces the rate of lipid synthesis. Plant Physiol, 2001, 125(2): 1103−1114.
[25] Li J, Li MR, Wu PZ, et al. Molecular cloning and expression analysis of a gene encoding a putative β-ketoacyl-acyl carrier protein (ACP) synthase III(KAS III) from Jatropha curcas. Tree Physiol,2008, 28(6): 921−927.
[26] Wu PZ, Li J, Wei Q, et al. Cloning and functional characterization of an acyl-acyl carrier protein thioesterase (JcFATB1) from Jatropha curcas. Tree Physiol, 2009, 29(10): 1299−1305.
[27] Lindqvist Y, Huang W, Schneider G, et al. Crystal structure of delta9 stearoyl-acyl carrier protein desaturase from castor seed and its relationship to other di-iron proteins. EMBO J, 1996, 15(16):4081−4092.
[28] Luo T, Peng SM, Deng WY, et al. Characterization of a new stearoyl-acyl carrier protein desaturase gene from Jatropha curcas. Biotech Lett, 2006,28(9): 657−662.
[29] Ye J, Qu J, Bui HTN, et al. Rapid analysis of Jatropha curcas gene functions by virus-induced gene silencing. Plant Biotech J, 2009, 7(9):964−976.
[30] Gibson S, Arondel V, Iba K, et al. Cloning of a temperature-regulated gene encoding a chloroplast omega-3 desaturase from Arabidopsis thaliana.Plant Physiol, 1994, 106(4): 1615−1621.
[31] Yadav NS, Wierzbicki A, Aegerter M, et al.Cloning of higher plant omega-3 fatty acid desaturases. Plant Physiol, 1993, 103(2): 467−476.
[32] Guo L, Qin RW, He W, et al. Identification and characterization of a plastidial ω3-fatty acid desaturase gene from Jatropha curcas. Chin J Appl Environ Biol, 2008, 14(4): 469−474.
郭亮, 卿人韦, 何玮, 等. 麻疯树叶绿 ω3脂肪酸脱饱和酶基因的克隆和鉴定. 应用与环境生物学报, 2008, 14(4): 469−474.
[33] Xu RH, Wang RL, Liu AZ. Expression profiles of genes involved in fatty acid and triacylglycerol synthesis in developing seeds of Jatropha (Jatropha curcas L.). Biomass Bioen, 2011, 35(5):1683−1692.
[34] Zhao GL, Chen JQ, Yin AP, et al. Transgenic soybean lines harbouring Anti-PEP gene express super-high oil content. Mol Plant Breed, 2005,3(6): 792−796.
赵桂兰, 陈锦清, 尹爱萍, 等. 获得转反义 PEP基因超高油大豆新材料. 分子植物育种, 2005,3(6): 792−796.
[35] Wu GT, Lang CX, Hu ZH, et al. Raising fat content in transgenic rice by anti-PEP gene transformation.J Plant Physiol Mol Biol, 2006, 32(3): 339−344.
吴关庭, 郎春秀, 胡张华, 等. 应用反义 PEP基因表达技术提高稻米脂肪含量. 植物生理与分子生物学学报, 2006, 32(3): 339−344.
[36] Fan ZQ, Li JY, Tian M, et al. Cloning and sequence analysis of full length cDNA of pepc gene from Jatropha curcas. Forest Res, 2010, 23(3): 349−354.
范正琪, 李纪元, 田敏, 等. 麻疯树磷酸烯酮式丙酮酸羧化酶pepc基因全长cDNA克隆及序列分析. 林业科学研究, 2010, 23(3): 349−354.
[37] Stirpe F, Pession-Brizzi A, Lorenzoni E, et al.Studies on the proteins from the seeds of Croton tiglium and of Jatropha curcas. Biochem J, 1976,156(1): 1−6.
[38] Lin J, Yan F, Tang L, et al. Isolation, purification and functional investigation on the N-glycosidase activity of curcin from the seeds of Jatropha curcas. High Tech Lett, 2002, 12(11): 36−40.
林娟, 颜钫, 唐琳, 等. 麻疯树核糖体失活蛋白的分离纯化和作用机制研究. 高技术通讯, 2002,12(11): 36−40.
[39] Lin J, Chen Y, Xu Y, et al. Cloning and expression of curcin, a ribosome inactivating protein from the seeds of Jatropha curcas. Acta Botan Sin, 2003,45(7): 858−863.
[40] Qin XB, Shao CX, Xu Y, et al. Analysis on the expression patterns of two ribosome inactivating proteins from Jatropha curcas L. Plant Physiol Comm, 2008, 44(5): 891−896.
秦小波, 邵彩霞, 徐莺, 等. 麻疯树两种核糖体失活蛋白的表达模式分析. 植物生理学通讯,2008, 44(5): 891−896.
[41] Qin XB, Gao JH, Xu Y, et al. Isolation of curcin promoter from Jatropha curcas and analysis in transgenic tobacco plants. Chin Bull Bot, 2008,25(4): 407−414.
秦小波, 高继海, 徐莺, 等. 麻疯树 curcin 启动子的分离及其在转基因烟草中的功能分析. 植物学通报, 2008, 25(4): 407−414.
[42] Qin XB, Zheng XJ, Shao CX, et al. Stress-induced curcin-L promoter in leaves of Jatropha curcas L.and characterization in transgenic tobacco. Planta,2009, 230(2): 387−395.
[43] Tang M, Sun J, Liu Y, et al. Isolation and functional characterization of the JcERF gene, a putative AP2/EREBP domain-containing transcription factor, in the woody oil plant Jatropha curcas. Plant Mol Biol, 2007, 63(3): 419−428.
[44] Tang MJ, Liu X, Deng HP, et al. Over-expression of JcDREB, a putative AP2/EREBP domaincontaining transcription factor gene in woody biodiesel plant Jatropha curcas, enhances salt and freezing tolerance in transgenic Arabidopsis thaliana. Plant Sci, 2011, 181(6): 623−631.
[45] Abreu EFM, Aragão FJL. Isolation and characterization of a myo-inositol-1-phosphate synthase gene from yellow passion fruit (Passiflora edulis f. flavicarpa) expressed during seed development and environmental stress. Ann Bot,2007, 99(2): 285−292.
[46] Gou CB, Wang Y, Yun C, et al. Isolation of MIPS gene promoter from Jatropha curcas L. and activity analysis of transient expression in tobacco protoplast. Plant Physiol Comm, 2010, 46(7):724−730.
苟春宝, 王勇, 喻川, 等. 麻疯树 MIPS 基因启动子的分离及在烟草原生质体中瞬时表达活性分析. 植物生理学通讯, 2010, 46(7): 724−730.
[47] Wang Y, Huang J, Gou CB, et al. Cloning and characterization of a differentially expressed cDNA encoding myo-inositol-1-phosphate synthase involved in response to abiotic stress in Jatropha curcas. Plant Cell Tiss Organ Cult, 2011, 106(2):269−277.
[48] Zhang Y, Wang YX, Jiang L, et al. Aquaporin JcPIP2 is involved in drought responses in Jatropha curcas. Acta Biochim Biophys Sin, 2007,39(10): 787−794.
[49] Wang YX, Zhang Y, Jiang LD, et al. Cloning function of a new aquaporin gene (JcPIP) from Jatropha curcas. J Tropical Subtropical Bot, 2008,21(6): 289−295.
王云霄, 张颖, 江璐玎, 等. 麻疯树水通道蛋白新基因JcPIP干旱胁迫下的功能分析. 热带亚热带植物学报, 2008, 21(6): 289−295.
[50] Zhang FL, Niu B, Wang YC, et al. A novel betaine aldehyde dehydrogenase gene from Jatropha curcas, encoding an enzyme implicated in adaptation to environmental stress. Plant Sci, 2008,174(5): 510−518.
[51] Waters ER, Lee GJ, Vierling E. Evolution,structure and function of the small heat shock proteins in plants. J Exp Bot, 1996, 47(296):325−338.
[52] Zhu XL, Zhu XH, Gu XP, et al. Cloning and heterologous expression of a cytosolic class II small heat shock protein gene (JcHSP17.5) from Jatropha curcas L. Plant Physiol Comm, 2010,46(5): 441−447.
朱勋路, 朱习红, 辜小苹, 等. 一个麻疯树胞质II类小热激蛋白基因 JcHSP17.5 的克隆和异源表达. 植物生理学通讯, 2010, 46(5): 441−447.
[53] Gross B, Gaestel M, Böhm H, et al. cDNA sequence coding for a translationally controlled human tumor protein. Nucl Acids Res, 1989,17(20): 8367.
[54] Lin S, Gao F, Luo H, et al. Sequencing and expression of translationally controlled tumor protein (TCTP) of Jatropha curcas L. Chin J Biochem Mol Biol, 2008, 24(8): 727−734.
林莎, 高帆, 罗洪, 等. 麻疯树J c-Tctp1 基因的同源性分析及时空表达模式鉴定. 中国生物化学与分子生物学报, 2008, 24(8): 727−734.
[55] Qin XB, Gao F, Zhang JP, et al. Molecular cloning,characterization and expression of cDNA encoding translationally controlled tumor protein (TCTP)from Jatropha curcas L. Mol Biol Rep, 2010,38(5): 3107−3112.
[56] Lin FR, Qin XB, Zhu XL, et al. Cloning and expression of an ADP-ribosylation factor gene in Jatropha curcas L. Plant Physiol Comm, 2009,45(6): 549−554.
林凡荣, 秦小波, 朱勋路, 等. 麻疯树中 ADP 核糖基化因子基因的克隆和表达. 植物生理学通讯, 2009, 45(6): 549−554.
[57] Qin XB, Lin FR, Lii YF, et al. Molecular analysis of ARF1 expression profiles during development of physic nut (Jatropha curcas L.). Mol Biol Rep,2011, 38(3): 1681−1686.
[58] Sawa M, Nusinow DA, Kay SA, et al. FKF1 and GIGANTEA complex formation is required for day-length measurement in Arabidopsis. Science,2007, 318(5848): 261−265.
[59] Imaizumi T, Schultz TF, Harmon FG, et al. FKF1 F-box protein mediates cyclic degradation of a repressor of CONSTANS in Arabidopsis. Science,2005, 309(5732): 293−297.
[60] Fornara F, Panigrahi KCS, Gissot L, et al.Arabidopsis DOF transcription factors act redundantly to reduce CONSTANS expression and are essential for a photoperiodic flowering response. Dev Cell, 2009, 17(1): 75−86.
[61] Iwamoto M, Higo K, Takano M. Circadian clock-and phytochrome-regulated Dof-like gene,Rdd1, is associated with grain size in rice. Plant Cell Environ, 2009, 32(5): 592−603.
[62] Yang J, Yang MF, Wang D, et al. JcDof1, a Dof transcription factor gene, is associated with the light-mediated circadian clock in Jatropha curcas.Physiol Plant, 2010, 139(3): 324−334.
[63] Yang J, Yang MF, Zhang WP, et al. A putative flowering-time-related Dof transcription factor gene, JcDof3, is controlled by the circadian clock in Jatropha curcas. Plant Sci, 2011, 181(6):667−674.
[64] Gao F, Wang ZT, Zhang SW, et al. Cloning and eukaryote expression vector construction of a novel protein gene containing F-box motif from Jatropha curcas L. endosperm. Chin J Appl Environ Biol,2007, 13(6): 807−810.
高帆, 王治涛, 张淑文, 等. 麻疯树胚乳类f-盒蛋白基因的克隆和载体构建. 应用与环境生物学报, 2007, 13(6): 807−810.metabolically engineered Escherichia coli W3110. Appl Environ Microbiol, 2003, 69(1): 399−407.
[12] Sawers G, Watson G. A glycyl radical solution:oxygen-dependent interconversion of pyruvate formate-lyase. Mol Microbiol, 1998, 29(4): 945−954.
[13] Hesslinger C, Fairhurst SA, Sawers G. Novel keto acid formate-lyase and propionate kinase enzymes are components of an anaerobic pathway in Escherichia coli that degrades L-threonine to propionate. Mol Microbiol,1998, 27(2): 477−492.
[14] Jantama K, Zhang XL, Moore JC, et al. Eliminating side products and increasing succinate yields in engineered strains of Escherichia coli C. Biotechnol Bioeng, 2008,101(5): 881−893.
[15] Vemuri GN, Altman E, Sangurdekar DP, et al. Overflow metabolism in Escherichia coli during steady-state growth: transcriptional regulation and effect of the redox ratio. Appl Environ Microbiol, 2006, 72(5): 3653−3661.
[16] Zhou S, Yomano LP, Shanmugam KT, et al. Fermentation of 10% (w/v) sugar to D(−)-lactate by engineered Escherichia coli B. Biotechnol Lett, 2005, 27(23/24):1891−1896.
Received: March 24, 2010; Accepted: May 17, 2010
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2006AA10Z138).
Corresponding author: Gongshe Yang. Tel/Fax: +86-29-87092430; E-mail: gsyang999@hotmail.com
国家高技术研究发展计划 (863计划) (No. 2006AA10Z138) 资助。
Progress in molecular biology of Jatropha curcas
Jing Yang1, Yongping Liu1, Yun Liu2, and Mingfeng Yang3
1 School of Chemical Engineering and Environment, North University of China, Taiyuan 030051, Shanxi, China
2 Institute of Zoology, Chinese Academy of Sciences, Beijing 100101, China
3 Key Laboratory of Urban Agriculture (North) of Ministry of Agriculture China, Beijing University of Agriculture, Beijing 102206, China
杨静, 刘永平, 刘蕴, 等. 麻疯树分子生物学研究进展. 生物工程学报, 2012, 28(6): 671−683.
Yang J, Liu YP, Liu Y, et al. Progress in molecular biology of Jatropha curcas. Chin J Biotech, 2012, 28(6): 671−683.
Received: November 25, 2011; Accepted: March 9, 2012
Supported by: National Natural Science Foundation of China (No. 30972333), Initial Foundation of North University of China (No.2011-2012), Research Fund for the Doctor of North University of China (No. 2011-2012), Natural Science Foundation for Young Scientists of Shanxi Province (No. 2012021029-1).
Corresponding author: Mingfeng Yang. Tel: +86-10-80797308; E-mail: mfyang@bac.edu.cn
国家自然科学基金 (No. 30972333),中北大学校基金 (No. 2011-2012),中北大学博士启动基金 (No. 2011-2012),山西省自然科学青年基金 (No.2012021029-1) 资助。
