啤酒酵母RNA提取条件的优化及其磁性固定化
2012-09-25王红英,孙井辉,钱斯日古楞,李长青
王 红 英, 孙 井 辉, 钱 斯 日 古 楞, 李 长 青
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
RNA是生物体最重要的基因表的物质基础,除了在生物体正常的生长外,它与生命的异常如肿瘤等有密切关系。双链RNA对基因表达的阻断被称为RNA干预(RNA interference,RNAi)[1]。双链RNA经酶切后会形成很多小片段,称为siRNA。它与mRNA中的同源序列互补结合,会导致其对应的mRNA失去功能,使基因“沉默”,以此治疗疾病[2-3]。但siRNA进入细胞后易被降解,故稳定和快速传递siRNA的新型给药系统的研究较为关注[4]。以磁性微球为载体的靶向药物能够使药物靶向传递,减轻药物对其他部位的不良反应,同时通过磁场富集的药物能够提高疗效。因此磁性固定化能够使siRNA快速到达目的部位和避免运输过程中的降解。
本研究对啤酒酵母总RNA进行提取,并对其进行磁性固定化研究,以期为磁性固定化siRNA的靶向性研究和RNAi研究提供参考。
1 材料与方法
1.1 材 料
啤酒酵母(S.cerevisiae);磁性壳聚糖微球,本实验室自制[5];戊二醛,天津基准化学试剂有限公司;其他试剂均为国产分析纯。
1.2 方 法
1.2.1 酵母RNA的提取
采用浓盐法提取酵母RNA[6]。将8 g酵母加入质量分数为10%的NaCl溶液中,置于100 ℃ 水浴锅中搅拌4 h,冷却后在3 500 r/min条件下离心10 min。将上清液用6 mol/L盐酸调pH至2.4,在冰浴中静置使其完全沉淀,将所得上清液以3 500 r/min离心10 min获得核酸沉淀物。用体积分数95%乙醇洗涤沉淀物质,去除残余杂质及色素;沉淀再用乙醚洗涤两次,通过布氏漏斗抽滤,冷冻干燥获得RNA粉末。
1.2.2 定磷法测定啤酒酵母RNA质量分数
磷标准曲线制作用最小二乘法作线性回归,得回归方程。
Y=0.047 0X-0.002 7,R2=0.999 6
w(RNA)=10-6n(T1/m1-T2/m)(340/31)
式中,T1,总磷微克数;T2,无机磷微克数;n,稀释倍数;m1,样品数,μg;m,样品质量,μg;340,RNA平均相对分子质量;31,磷的原子数。
1.2.3 磁性微球固定化RNA
准确称取10 mg磁性壳聚糖微球,用3%的戊二醛溶液浸泡2 h,对其进行活化。再用无水乙醇和超纯水对微球反复洗涤,洗去多余的戊二醛等。将活化好的微球加入到一定质量分数的RNA溶液(质量浓度为2 mg/mL),在40 ℃条件下振荡4 h,得到磁性固定化RNA。用磁场将磁性RNA沉淀,用超纯水洗涤沉淀至上清液无RNA洗出。汇集上清液,测定RNA总量。
2 结果与讨论
2.1 酵母RNA提取的正交优化试验
采用正交分析方法对浓盐法提取酵母RNA提取影响因素进行优化,试验设计为L9(34)正交试验,试验方案见表1。
表1 酵母RNA提取的正交试验因素与水平
Tab.1 Factors and levels of orthogonal experiment of the yeast RNA extraction

水平At/hBθ/℃Cw(NaCl)/%Dw(酵母)/%12908823951010341001212
由表2、3可见,因素A即反应时间为最显著影响因子。最佳提取工艺为A3B3C2D1,即反应时间4 h,反应温度100 ℃,氯化钠质量分数10%,酵母质量分数8%,最佳提取条件下RNA的提取率可达6.13%。
表2 酵母RNA提取的正交试验结果与分析
Tab.2 Results and analysis of orthogonal experiment of the yeast RNA extraction

试验号ABCD提取率/%111114.70212225.52313336.00421234.82522315.59623126.01731324.88832135.45933216.13均值15.4074.8005.3875.473均值25.4735.5205.4905.470均值35.4876.0475.4905.423极差0.0801.2470.1030.050
表3 正交试验方差分析表
Tab.3 Variance analysis of orthogonal experiment

因素偏差平方和自由度F比F临界值显著性抽提时间2.3502111.90519.000*抽提温度0.02121.00019.000NaCl质量分数0.01120.52419.000酵母质量分数0.00520.23819.000误差0.0202
2.2 RNA固定化条件的优化
2.2.1 固定化最佳RNA添加量
取8只100 mL三角瓶,分别加入10 mg经活化的磁性微球,再分别加入5、10、15、20、25、30、35和40 mL RNA溶液(质量浓度为2 mg/mL),40 ℃恒温振荡4 h,用磁铁将磁性RNA沉淀,过滤、洗涤、收集上清液,通过定磷法测定总RNA质量分数,结果如图1所示。由图1可知,当RNA添加量不足30 mL时,固定化后的洗涤上清液中游离的RNA极少,说明少于30 mL 添加量的RNA完全被固定化;当RNA添加量超过30 mL时,上清液中的游离RNA量逐渐增大,说明微球表面固定化RNA达到饱和,继续增加RNA添加量,RNA固定化率不变。综合考虑,每10 mg磁性壳聚糖微球的最佳RNA添加量为30 mL。
2.2.2 固定化最佳反应时间
在4只100 mL三角瓶中各加入10 mg活化的磁性微球和30 mL RNA溶液,40 ℃振荡2、4、6、8 h。将磁性微球沉淀,过滤,用纯水洗涤,收集上清液和洗涤液,用定磷法测定其RNA质量分数,结果如图2所示。由图2可见,固定化时间2~8 h,上清液中RNA质量分数先下降(4 h达到最低)而后逐渐增大。这是因为当固定化时间小于4 h,有部分RNA和微球未很好地结合;当固定化的时间大于4 h,已被固定化的部分RNA脱落,因而上清液中RNA质量分数有所增加。因此RNA的最佳固定化时间确定为4 h。
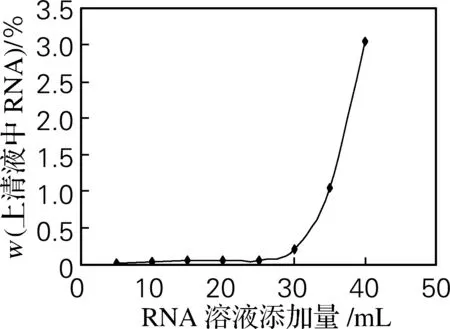
图1 RNA添加量对磁性固定化的影响
Fig.1 Effect of RNA addition on the magnetic immobilization

图2 固定化时间对RNA固定化的影响
2.2.3 固定化最佳反应温度
取4只100 mL三角瓶,各加10 mg活化的磁性微球,加入30 mL的RNA溶液,分别在20、30、40和50 ℃进行固定化4 h。用磁场将磁性微球沉淀,过滤,收集上清液和洗涤液,用定磷法测定其RNA质量分数,结果如图3所示。

图3 温度对RNA固定化的影响
Fig.3 Effect of temperature on RNA immobilization
由图3可见,随着固定化温度的提高,上清液中RNA质量分数逐渐降低,40 ℃时达到最低,当温度超过40 ℃,上清液中RNA质量分数提高。因此固定化最佳反应温度确定为40 ℃。
3 结 论
通过对RNA提取条件的优化,得到了浓盐法提取啤酒酵母RNA的最佳工艺条件,并将提取的RNA进行磁性固定化,得到磁性固定化RNA的最佳条件。在提取时间为4 h、提取温度100 ℃、氯化钠质量分数10%和酵母质量分数8%的最优条件下,RNA的提取率达到6.13%,其中RNA提取时间对提取率的影响最为显著。RNA的最佳固定化条件为,RNA的添加量30 mL(质量浓度为2 mg/mL),固定温度40 ℃,固定化时间4 h。
本实验对siRNA新型给药系统的发明进行探索,为RNAi技术的应用开拓一个新的道路。
[1] DEVINCENZO J, CEHELSKY J E, ALVAREZ R, et al. Evaluation of the safety, tolerability and pharmacokinetics of ALN-RSV01, a novel RNAi antiviral therapeutic directed against respiratory syncytial virus (RSV)[J]. Antiviral Research, 2008, 77(3):225-231.
[2] DENKBAS E B, KILICAY E, BIRLIKSEVEN C, et al. Magnetic chitosan microspheres: preparation and characterization[J]. Reactive and Functional Polymers, 2002, 50(3):225-232.
[3] HOWARD K A, RAHBEK U L, LIU Xiu-dong. RNA interference in vitro and in vivo using a chitosan/siRNA nanoparticle system[J]. Molecular Therapy, 2006, 14(4):476-484.
[4] 倪春,张才全. siRNA分子选择性的导入靶组织细胞的方法[J]. 重庆医学, 2007, 36(24):2572-2574.
[5] 钱斯日古楞,王红英. 磁性淀粉复合微球的制备及其性质[J]. 大连轻工业学院学报, 2003, 22(3):191-193.
(QIAN Si-ri-gu-leng, WANG Hong-ying. Preparation of magnetic starchy composite microspheres and its characteristics[J] . Journal of Dalian Institute of Light Industry, 2003, 22(3):191-193. )
[6] 孙荣丹,刘莹,张洪林,等. 浓盐法与稀碱法在啤酒废酵母中提取RNA的研究[J]. 氨基酸和生物资源, 2006, 28(3):76-78.
