A型H1N1流感病毒2009年血凝素蛋白变异分析*
2012-09-17武治印胡劲松
武治印,胡劲松
1)中国医学科学院药用植物研究所北京100094 2)国家开发银行北京100037
A型H1N1流感病毒2009年血凝素蛋白变异分析*
武治印1),胡劲松2)#
1)中国医学科学院药用植物研究所北京100094 2)国家开发银行北京100037
#通讯作者,男,1979年7月生,博士,高级工程师,研究方向:细胞生物学,E-mail:jingsonghu@126.com
流感病毒;血凝素蛋白;变异
目的:通过分析血凝素蛋白的演变规律探讨A型H1N1流感病毒的进化来源及流行特点。方法:利用生物信息学方法,比较A/Mexico/4108/2009(H1N1)毒株和与其相关的22株流感病毒血凝素蛋白序列的进化关系,重点分析A/Mexico/4108/2009(H1N1)毒株相关氨基酸位点的变异情况。结果:A/Mexico/4108/2009(H1N1)血凝素蛋白的蛋白酶剪切位点、受体结合位点以及表面抗原位点都与1918年和1976年暴发的H1N1流感病毒类似,可能涉及H1N1流感病毒在不同宿主间的传播、重组。结论:A/Mexico/4108/2009(H1N1)毒株的病毒毒力、感染性以及免疫原性发生了一定的变异,并且可能在变异过程中发生了向1918年和1976年的H1N1流感病毒的回复突变。
2009年蔓延全球的A型H1N1流感疫情是近年来影响范围较广、社会关注度较高的疫情。现在再次审视疫情暴发的特点和规律,对于进一步做好今后的传染病防控无疑具有重大的现实意义。根据核蛋白和基质蛋白抗原性的不同,流感病毒分为A、B和C 3型。A型流感病毒变异较快,B、C型变异较慢。世界范围内几次流感大流行均由A型病毒引起,为防治流感带来极大的挑战[1]。血凝素蛋白是流感病毒最主要的抗原,其抗体能中和流感病毒[2]。血凝素蛋白前体蛋白(562~566氨基酸)经细胞内源性蛋白酶剪切成2条以二硫键相连的蛋白:血凝素蛋白1(319~326氨基酸)和血凝素蛋白2(221~222氨基酸)。其中,血凝素蛋白1位于囊膜外部,负责与受体的结合,包含5个主要的抗原位点;血凝素蛋白2区包括小部分胞外区及C末端的跨膜区和胞内区,将血凝素蛋白分子嵌在膜上;血凝素蛋白2区 N端的10个氨基酸构成疏水性融合肽,在膜融合过程中起重要作用[3]。在流感病毒感染过程中,血凝素蛋白通过和唾液酸受体结合,完成病毒对细胞的吸附,并能介导病毒囊膜和酸性内吞泡膜的融合[4]。血凝素蛋白的5个抗原位点(Sa、Sb、Ca1、Ca2和Cb)位于蛋白头部,不同亚型的血凝素蛋白抗原表位氨基酸位点有所不同[5-6]。流感病毒RNA片段重排会导致其抗原性不断发生变异[7],进而影响血凝素蛋白与受体结合位点的变化[8]。该研究主要利用生物信息学方法,比较分析2009年暴发的流感病毒A/Mexico/2009(H1N1)株与已知的流感病毒毒株血凝素蛋白进化关系和氨基酸位点变异等情况,分析A/Mexico/2009(H1N1)株的进化来源和进化特征。
1 材料与方法
1.1 血凝素蛋白序列 用于分析的血凝素蛋白序列来源于NCBI。根据蛋白序列初步比较分析,选择包括A/Mexico/4108/2009(H1N1)毒株在内的23条具有代表性的流感病毒血凝素蛋白序列(表1)。

表1 23株流感病毒毒株信息
1.2 序列分析方法 用于序列分析的其他参考病毒序列分析方法包括:①NCBI提供的在线BLASTp程序。②多序列比对,使用的软件为ClustalX Multiple Sequence Alignment Program 1.83,比对结果使用weblogo程序的在线服务器。③基于多序列比对的结果绘制进化树,使用的软件为MEGA 5。
2 结果
2.1 A/Mexico/2009(H1N1)毒株血凝素蛋白BLASTp分析 A/Mexico/2009(H1N1)血凝素蛋白序列与2009年世界其他地方分离得到的人感染A型H1N1病毒高度相似(一致性>99%);与2009年分离得到的猪感染的A/swine/Alberta/2009(H1N1)毒株血凝素蛋白序列高度相似(一致性>98%);并且与 A/Iowa/CEID23/2005(H1N1)、A/New Jersey/1976(H1N1)、A/swine/Iowa/1988(H1N1)等毒株血凝素蛋白序列相似度较高(表2)。
2.2 A/Mexico/2009(H1N1)毒株血凝素蛋白进化树分析 结果见图1。可见A/Mexico/2009(H1N1)与A/Iowa/2005(H1N1)亲缘关系最近。这2株人源流感病毒与猪源流感病毒A/swine/Iowa/1988(H1N1)、A/swine/Wisconsin/1961(H1N1)、A/swine/Ratchaburi/2000(H1N1)、A/swine/Chachoengsao/2005(H1N1)进化上同属一个分支。同时,A/Mexico/2009(H1N1)与人源 A/South Carolina/1918(H1N1)、A/New Jersey/1976(H1N1)进化关系较近,而与自1918年以来小规模流行的其他人源流感病毒的亲缘关系较远。从跨亚型来看,A/Mexico/2009(H1N1)与 A/Hong Kong/97(H5N1)和 A/Japan/1957(H2N2)进化关系较近,而与 A/Hong Kong/1968(H3N2)较远。
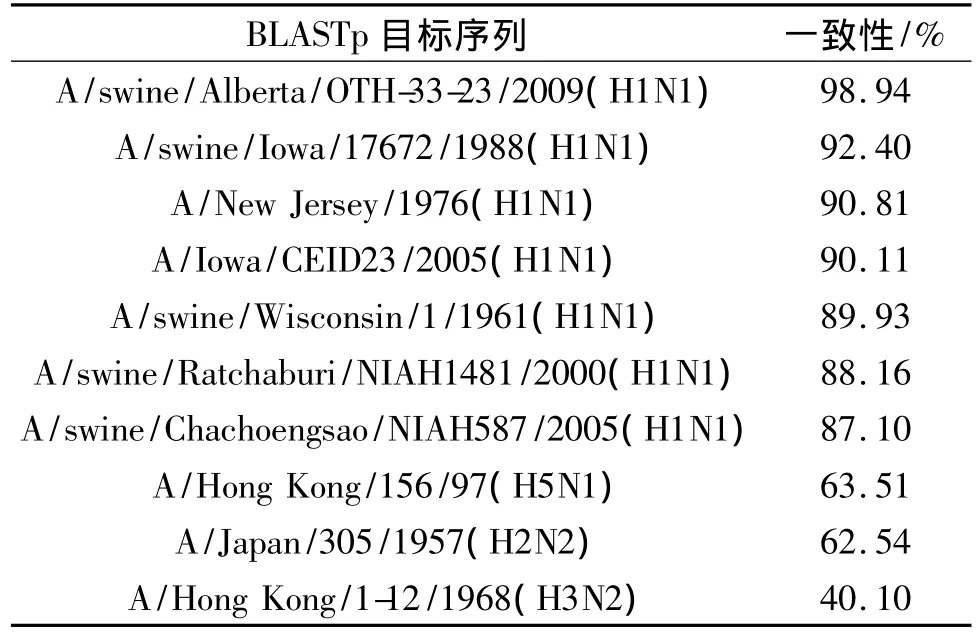
表2 A/Mexico/4108/2009(H1N1)血凝素蛋白序列相似度比较
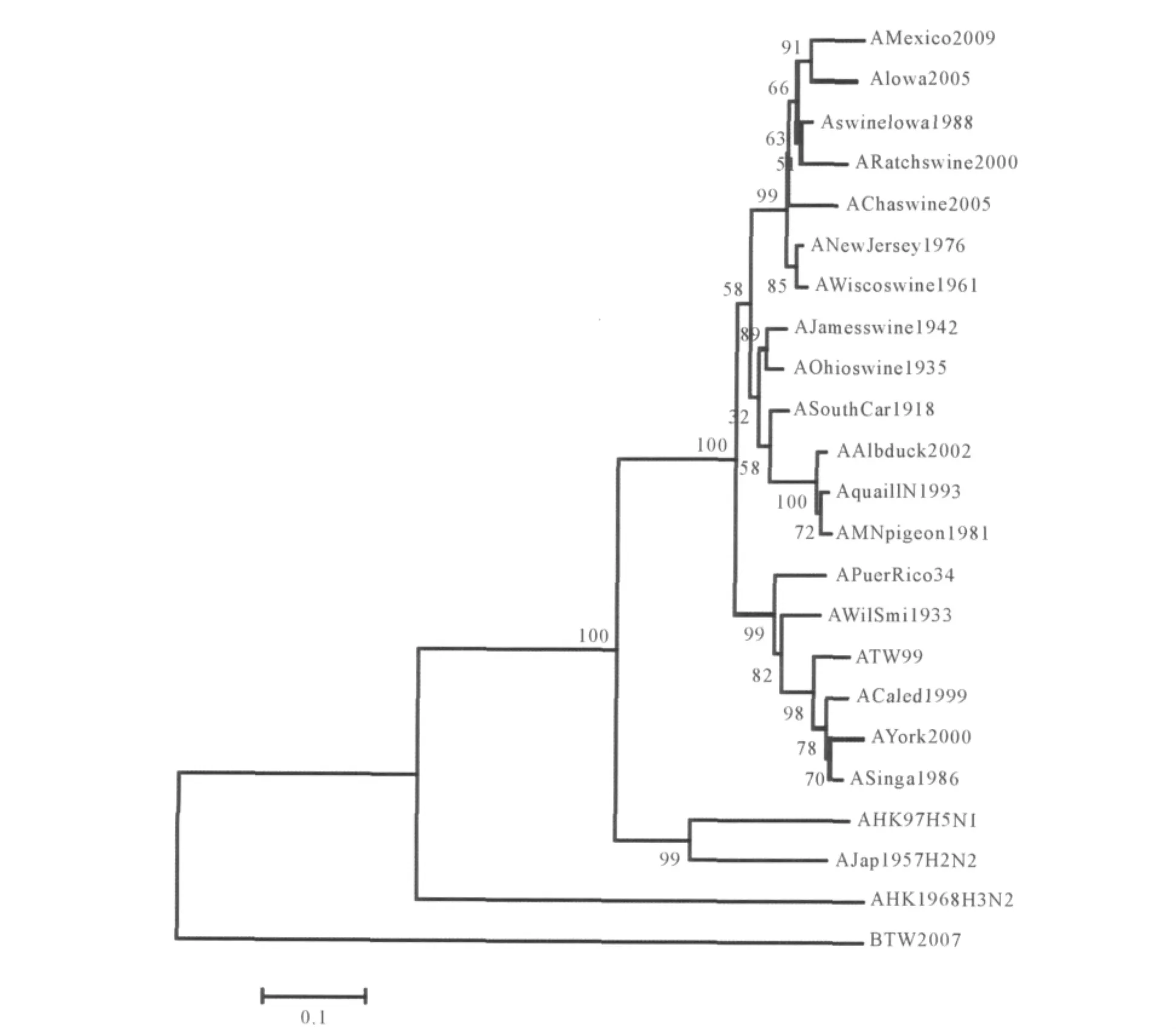
图1 23株流感病毒血凝素蛋白进化树
2.3 A/Mexico/2009(H1N1)毒株血凝素蛋白序列变异分析
2.3.1 蛋白酶水解位点 包括 A/Mexico/2009(H1N1)在内的23株H1N1流感病毒的血凝素蛋白酶水解位点(344~345氨基酸残基位点)变异很小,十分保守,水解位点附近的氨基酸序列变异也很小(图2)。

图2 23株H1N1流感病毒血凝素蛋白水解位点氨基酸比对结果的logo图
2.3.2 受体结合位点 结果见表3。可见190螺旋氨基酸变化不大,而220环和130环氨基酸变异较大。其中130环氨基酸序列在大流行流感病毒株相同,而在小流行流感病毒中变化较大,且氨基酸种类和极性均有所变化。220环氨基酸序列变异较大,221位(S)、223 位(Y)、227 位(F)未发生变异;225位和226位发生R与K的替换,其氨基酸种类和极性未发生变化;224位氨基酸变异带有进化顺序的关系,由1976年以前的N变异为1976年以后的S;222位和228位的氨基酸呈现出变异的多样化。

表3 H1N1流感病毒血凝素蛋白受体结合位点比较
2.3.3 糖基化位点 27位、28位、40位、104位、304位和498位糖基化位点并未发生变异,也未缺失。但是这些糖基化位点附近氨基酸残基发生变异,有些氨基酸的种类和极性还有所变化,如305位发生S→T变异。
2.3.4 二硫键位点 二硫键位点([21,481]、[59,292]、[72,84]、[107,153]、[296,320]、[488,492])未发生变异。但是,在这些二硫键附近的氨基酸发生了变异,如491位存在A与T的替换,氨基酸种类和极性都发生变化。
2.3.5 表面抗原位点 结果见表4。可见 Sa区128(F)、129(E)、160(S)、162(Y)、165(L)、167(W),Sb区192(V)、198(H),Ca2 区 140(W)、143(H),Cb 区79(L)、81(N)、82(P)、83(E)、122(L)等氨基酸位点未发生变异。
A/South Carolina/1/1918、A/New Jersey/1976 2株流感病毒与A/Mexico/2009比较来看,163位R→R→K、166 位 L→I→I、196 位 V→I→I、173 位 S→N→N、145位 T→T→S、225位 R→R→K、78 位 L→L→I。这些位点氨基酸虽发生变异,但是发生变异后氨基酸的种类和极性均未发生改变。而159位S→N→K、169位 T→V→V、144位E→E→D、224位N→N→S,这些位点发生变异后,其氨基酸种类和极性发生了较大改变。
A/Mexico/2009与 A/Iowa/2005毒株相比,对于163位 R→K、145位 T→S,A/Iowa/2005与以前的H1N1流感病毒相同,这些位点在2009年毒株中发生变异,但是氨基酸种类和极性未发生变化。对于193位 I→L、207位 T→S,A/Mexico/2009与前几次大流行的病毒相同。对于159位N→K,1918年和1934年、1976年和2005年此位点氨基酸相同,而2009年与上述年份毒株均不同,但与猪和禽类的相同,此位点变异具有较大的多样性,且A/Mexico/2009毒株血凝素蛋白与猪和禽来源的毒株有较强的亲缘关系。
A/Mexico/2009与A/Puerto Rico/34序列比较,2株病毒血凝素蛋白表面抗原位点氨基酸变异较多。

表4 H1N1流感病毒血凝素蛋白表面抗原位点比较
3 讨论
3.1 A/Mexico/2009流行毒株可能是流感病毒在不同宿主间传播并重组的结果 A/Mexico/2009血凝素蛋白很可能是流感病毒在不同物种间传播和重组的结果。序列比对和进化树分析结果显示,A/Mexico/2009血凝素蛋白来源明显与近期大多数小规模流行的人源流感病毒不同。A/Mexico/2009血凝素蛋白可能来源于2000年至2005年猪源流感病毒,并可追溯至1935年、1942年和1988年猪源流感病毒以及1918年和1976年大流行的人源流感病毒。
物种间的传播和变异可能是病毒引起感染和致病性变化最大的因素。流感病毒宿主范围十分广泛,其RNA片段重组会引起流感病毒抗原性的巨大改变,这往往是引起新一轮流感流行的原因[9]。来源于猪体内的H1抗原于1918年暴发,并在欧洲引起数千万人的死亡。1957年、1968年、1976年流行的H1N1病毒毒株都曾发生重组事件。虽然A/H1流感病毒在2009年之前未再大规模流行,但是1918年和1976年A/H1流感病毒的基因片段在禽类和猪流感病毒中屡有发现。作者的进化树分析结果也清晰地反映了这点。而在上述流感大流行期间和之后,在人群中小规模流行的A型流感病毒的感染性和病毒毒力远不如上述A型流感病毒,进化分析结果也表明这些流感病毒与猪和禽类流感病毒的亲缘关系较远。
猪可能是流感病毒跨物种传播的中间宿主。血凝素蛋白识别受体是宿主细胞表面的唾液酸分子。在禽类中,唾液酸是以α-2,3的方式结合在糖链上的,而在人类中,唾液酸是以α-2,6的方式结合的。因此,流感病毒在人与禽类间无法直接传播。但是,流感病毒可以通过某些中间宿主,例如猪,来完成受体结合方式的变异。这是因为猪体内,既存在α-2,3唾液酸,又存在α-2,6唾液酸,因此能够同时被禽流感病毒和人流感病毒感染,为流感病毒变异提供了最佳场所[10]。
3.2 A/Mexico/2009血凝素蛋白分子特征 血凝素蛋白剪切位点的序列特征与毒株毒力有关。近年来,世界各地出现了高致病性H5N1禽流感,并偶然感染人类。而2009年暴发的H1N1流感与禽类流感病毒亲缘关系较远,且其表现出高传染性但致死率却不高的特点。与流感病毒毒性相关的分子水平特征之一就是血凝素蛋白的蛋白酶剪切位点的连续碱性氨基酸。A/Mexico/2009的血凝素蛋白剪切位点的序列特征与1918年和1976年暴发的H1N1流感病毒比较接近,其序列为 PSIQSRGLFGAIAG FIEGGWTGM。与H5N1亚型相比,H1N1亚型剪切位点附近氨基酸多为脂肪族氨基酸,碱性氨基酸较少,这往往会影响病毒毒力。因此,H1N1亚型流感病毒的毒力相对H5、H7等其他亚型而言较弱。1918年暴发的H1N1亚型流感导致约2 000万人死亡,主要原因一是病毒自身毒力较强,二是由于当时缺乏抗生素,很多患者因继发的细菌感染而死亡。同时,流感病毒的毒力还与神经氨酸酶、聚合酶等蛋白相关。
A/Mexico/2009与其他H1亚型的血凝素蛋白相似度较高,三维结构可能没有明显的变化。但是,从蛋白二维结构来看,虽然A/Mexico/2009血凝素蛋白的二硫键位点发生变异或缺失,但是这些位点附近的氨基酸发生部分变异,有的氨基酸种类和极性均发生改变,会在一定程度上影响 A/Mexico/2009血凝素蛋白的三维空间构象。虽然这种影响并非一种质变,但也会影响A/Mexico/2009血凝素蛋白感染性和免疫原性。
A/Mexico/2009获得了较强的感染能力。由A/Mexico/2009血凝素蛋白受体结合位点氨基酸比较可见,其受体结合位点130环上氨基酸位点与小规模流行的流感病毒,例如A/Iowa/2005以及猪源流感病毒等相比发生了变异,而这种变异结果是氨基酸序列回归到1918年和1976年2次大规模暴发的H1N1流感病毒的相应序列。
3.3 病毒免疫原性变化 A/Mexico/2009病毒糖基化位点未发生变异或缺失,但是糖基化位点附近部分氨基酸发生变异,有些氨基酸的类别和极性都有变化。这些变化会影响血凝素蛋白的糖基化,进而影响蛋白的免疫原性。
比对血凝素蛋白5个表面抗原区域氨基酸序列发现:①Sb区159位点上氨基酸变异最大,不仅病毒之间氨基酸变异频率最高,而且氨基酸种类和极性相差也很大,显示了病毒抗原性的多变性。可能与病毒免疫原性关系密切。②Sa区193位、Sb区196位、Ca1区207位表现出大规模流行和小规模流行病毒不一致的情况。A/Mexico/2009在这些位点上氨基酸变异又回归到1918年和1976年流感病毒,显示了这些病毒之间的亲缘关系。这可能与病毒感染能力也有一定关系。③Sa区158位和Sb区156位表现出亲缘关系远近的特点,亲缘关系较近的几株病毒保持不变,而亲缘关系较远的(A/Puerto Rico/34)发生变异。④Sa区166位、Ca1区169位、Ca2区224位及225位、Cb区78位氨基酸变异与病毒进化时间相关,时间顺序相近病毒的相同位点上氨基酸保持一致。
由此可见,应重点关注H1N1流感病毒Sa区193位、Sb区196位及159位、Ca1区207等表面抗原位点氨基酸的变异情况。
3.4 疫苗设计 在研发药物方面,由于流感病毒具有较为复杂的进化规律,在选择药物靶点时一定要参考其宿主情况以及病毒的进化规律;在设计疫苗方面,对于制备重组病毒,因A/Mexico/2009流感病毒的毒力并不是很强,可将A/Mexico/2009血凝素蛋白基因片段整体重组到工程毒株(如A/Puerto Rico/8/34)中。根据A/Mexico/2009毒株的特点以及与工程毒株的不同,在制备重组病毒时,应重点关注受体结合位点130环137位,表面抗原区域Sa区158位,Sb区156位、159位,Ca1区169位、173位、207位,Ca2区144位、224位等位点氨基酸的变异情况。
[1]Knipe DM,HowleyPM.Fundamentalvirology[M].Wilkins:Lippincott Williams,2001.
[2] Skehel JJ,Wiley DC.Receptor binding and membrane fusion in virus entry:the influenza hemagglutinin[J].Annual Rev Biochem,2000,69:531
[3] Chen J,Skehel JJ,Wiley DC.N-and C-terminal residues combine in the fusion-pH influenza hemagglutinin HA(2)subunit to form an N cap that terminates the triple-stranded coiled coil[J].Proc Nat Acad Sci USA,1999,96(16):8967
[4] Sato SB,Kawasaki K,Ohnishi S.Hemolytic activity of influenza virus hemagglutinin glycoproteins activated in mildly acidic environments[J].Proc Nat Acad Sci USA,1983,80(11):3153
[5] Caton AJ,Brownlee GG,Yewdell JW,et al.The antigenic structure of the influenza virus A/PR/8/34 hemagglutinin(H1 subtype)[J].Cell,1982,31(2 Pt 1):417
[6] Wrammert J,Koutsonanos D,Li GM,et al.Broadly crossreactive antibodies dominate the human B cell response against 2009 pandemic H1N1 influenza virus infection[J].J Exp Med,2011,208(1):181
[7] Vijaykrishna D,Poon L,Zhu HC,et al.Reassortment of pandemic H1N1/2009 influenza A virus in swine[J].Science,2010,328(5985):1529
[8] Gamblin S,Haire L,Russell RJ,et al.The structure and receptor binding properties of the 1918 influenza hemagglutinin[J].Science,2004,303(5665):1838
[9] Webster RG,Laver WG,Air GM,et al.Molecular mechanisms of variation in influenza viruses[J].Nature,1982,296(5853):115
[10]Ito T,Couceiro JN,Kelm S,et al.Molecular basis for the generation in pigs of influenza A viruses with pandemic potential[J].J Virol,1998,72:7367
(2012-07-10收稿 责任编辑姜春霞)
Mutation of 2009 type A H1N1 influenza virus hemagglutinin
WU Zhiyin1),HU Jinsong2)
1)Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences,Beijing 100094 2)Chi-na Development Bank,Beijing 1
influenza virus;hemagglutinin;mutation
Aim:To investigate the evolutionary source and the epidemiological characteristics of the type A H1N1 influenza virus by analyzing the evolution of the hemagglutinin protein.Methods:The hemagglutinin amino acid sequences from the A/Mexico/4108/2009(H1N1)strain and its associated other 22 influenza virus strains were collected and compared using bioinformatic methods,and the evolutionary relationship was analyzed.Results:The A/Mexico/4108/2009(H1N1)hemagglutinin protein was the recombination product during its spread among different hosts.And its protease cleavage site,receptor binding sites,and surface antigenic sites were similar to the H1N1 influenza virus epidemic strains outbreak in 1918 and 1976.Conclusion:It demonstrates the variation of the virulence,transmissibility and immunogenicity of A/Mexico/4108/2009(H1N1)strain,and also indicates the response back to the H1N1 virus epidemic strains in 1918 and 1976.
Q349.53
10.3969/j.issn.1671-6825.2012.05.007
*国家自然科学基金资助项目 3017004,30421004;国家“973”计划基金资助项目 2003CB715900
