木香药材活性成分及其结构修饰研究进展
2012-09-11王昌瑞穆小静张起辉张子春
钱 伟,徐 溢*,王昌瑞,穆小静,张起辉,张子春
重庆大学化学化工学院,重庆 400030
菊科植物木香(Saussurea costus(Falc.)Lipech),原产于印度,后由云南移植栽培,故又称云木香,现今主要分布在四川、云南、西藏、湖南、湖北等地。木香以根茎入药,有健胃消胀、调气解郁、止痛安胎作用。中医常用其治疗脘腹胀痛、胸肋胀满、呕吐、腹痛和腹泻、痢疾后重等症,具有行气止痛、健脾消食的功效[1,2]。木香的挥发油主要含有一些倍半萜内酯类成分,而药材中具有抗肿瘤、抗菌、抗溃疡等作用的主要成分是木香烯内酯与去氢木香内酯。为了得到药效更高,适合临床运用的药物,现在对木香烯内酯与去氢木香内酯的衍生、结构修饰的研究也逐渐增加。本文将对这方面的研究工作进行分析和综述。
1 木香的化学成分
目前为止,归纳现有文献报道的木香的化学组分,已经在木香中发现了萜类、黄酮、生物碱、甾体、糖、脂肪酸,还有氨基酸和脂肪[2-12]。单萜化合物主要有莰烯、水芹烯、α-和β-紫罗兰酮、丁香烯、松香烯等化合物[2]。
萜类化合物含量最为丰富,尤其是其中的倍半萜内酯如去氢木香内酯和木香烯内酯含量较高,为木香的主要活性化合物。倍半萜类化合物又可以分为愈创木烷(guaiane)、桉叶烷(eudesmane)、吉马烷(germacrane)型等结构。愈创木型化合物:去氢木香内酯(图 1)、异中美菊素、zaluzanin C、11β,13-dihydro-3-epizaluzanin、lappalone[3]、isodehydrocostuslactone[4]、saussureamines B 和 C[5]等化合物。桉叶烷型 化 合 物:11β,13-dihydroreynosin、1β,6α-dihydroxycostic acid ethylester、reynosin、4α-hydroxy-4βmethyldihydrocostol、colartin[3]、saussureal、4-β-methoxydehydrocostuslactone、isodehydrocostuslactone-15-aldehyde[4]、 13-sulfo-dihydroreynosin、 13-sulfo-dihydrosantamarine[6]等化合物。吉马烷型化合物包括:木香烯内酯(图 1)、dihydrocostunolide、saussureamine A、costunolide-15-O-β-D-glucopyranoside[5,7,8]等。还有其他倍半萜类化合物如β-elemene、elemol、elemenal、elema-1,3,11(13)-trien-12-ol、葎草烯、环氧石竹烯、石竹烯、雪松烯[2]、10α-hydroxyl-artemisinic acid[9]等。
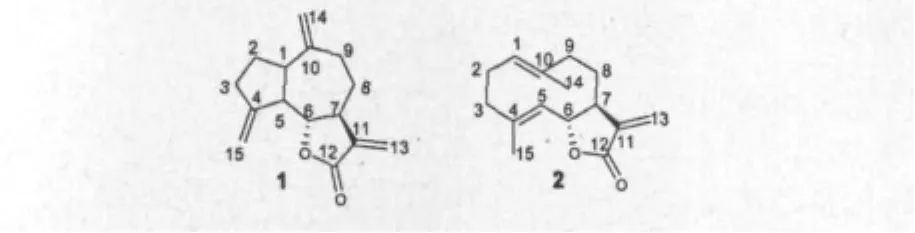
图1 去氢木香内酯(1)和木香烯内酯(2)的化学结构Fig.1 Structures of dehydrocostus lactone(1)and cost unolide(2)
植物甾醇化合物主要有3-epi-lappasterol、lappalanasterol[10]、β-sitosterol、daucosterol、pregnenolone[11]等。
其他化合物有1-hydroxypinoresinol-1-β-D-glucopyranoside、3β-acetoxy-9(11)-baccharene 等三萜化合物,还有一些如 3-(3R-acetoxy-5,5-dimethylcyclopent-1-ene)-4'-O-methylscutellarein-7-O-(6''''-O-acetyl-β-D-glucopyranosyl-(1 →3)-[α-L-rhamnopyranosyl-(1→2)]-β-D-glucopyranoside、kaempferol-3-O-β-D-glucopyransoyl-(1→4)-α-L-rhamnopyranosyl-(1→6)-β-D-galactopyranoside-7-O-(6''''-O-acetyl-β-D-glucopyranosyl-(1→3)-[α-L-rhamnopyranosyl-(1→2)]-β-D-glucopyranoside[12]等配糖体化合物。含有氨基酸如天冬氨酸、甘氨酸、天冬酰胺、γ-氨基丁酸等20种氨基酸[2]。其他还有木香碱、菊糖、果糖、油酸等[2]化合物。
2 木香及其活性成分的药理研究进展
木香药材及其活性成分具有一定的药理作用,其中木香烯内酯和去氢木香内酯的研究相对较多,并表现出良好的抗肿瘤、抗菌等药效。
2.1 抗肿瘤作用研究
木香的化学成分众多复杂,研究发现去氢木香内酯和木香烯内酯能明显抑制A549肿瘤细胞分泌血管内皮生长因子(VEGF)[14],而 VEGF可能为木香及其制剂发挥抗肿瘤作用的主要作用靶点之一。Jung-Hye Choi等[15]研究表明采用腹腔给药方式,木香烯内酯能有效抑制肺肿瘤生长和提高存活率。EunJi Kim等[16]研究了去氢木香内酯诱导 DU145人类前列腺肿瘤细胞凋亡,发现木香提取液对雄性激素依赖型前列腺肿瘤具有化学预防作用,木香的正己烷层提取液及其有效成分去氢木香内酯能够抑制细胞生长与诱导DU145细胞凋亡。唐于平等[17]研究了木香中去氢木香内酯等5种倍半萜化合物对5种肿瘤细胞生长抑制作用研究,结果显示具有五元内酯环结构的化合物对肿瘤细胞具有一定选择性抑制作用。Chia-Yuan Liu等[18]主要研究了木香烯内酯对人类肝癌细胞(HCC)在细胞周期时的分布和辐射敏感度的研究,表明木香烯内酯可以减少肝癌细胞的生存能力,并能在有丝分裂期的阻止细胞周期。Eun JeongChoi等[19]研究了去氢木香内酯的抗肿瘤活性,考察了其对人类乳腺癌细胞和卵巢癌细胞的作用,表现出了其潜在的抗肿瘤活性。
2.2 其他药理研究
除了在抗肿瘤方面的研究之外,还有很多研究表明木香药材及其活性成分在抗菌、抗炎、抗氧化等方面也表现出一定的功效。
Hyeon-Hee Yu等[13]研究了木香乙醇提取液对变异链球菌具有抑制作用,并能抑制变异链球菌诱导的龋齿。Gil-SaengJeong等[20]研究发现木香中的去氢木香内酯对血红素加氧酶-1具有保护作用,而其α-亚甲基-γ-丁内酯结构是发挥作用的关键部位。另外,S.D.Ambavade 等[21]研究了木香提取液的抗惊厥作用,采用木香的石油醚、乙醇和水提取液在老鼠体内分别进行了以戊撑四唑(pentylenetetrazole)和苦毒素诱导的惊厥试验和最大电休克疗法试验,发现木香石油醚提取液具有提高戊撑四唑和苦毒素诱导的惊厥抑制作用。EunMi Choi等[22]研究发现去氢木香内酯能保护由双氧水诱导产生细胞损伤的成骨细胞,同时,去氢木香内酯对成骨细胞可作为保护氧化损伤的保护剂。Ji Young Choi等[23]以木香甲醇提取部分做了体外蛋白质酪氨酸酶1B(PTP1B)抑制试验,进一步对提取部分分离得到桦木酸、桦木酸甲酯、木香内酯、去氢木香内酯四种活性组分。Elena Butturini等[24]考察了木香烯内酯和去氢木香内酯对信号传感器和转录活化剂3(STAT3)活性的抑制作用的分子机制,表明这两个化合物能够通过诱导转录活化剂3蛋白的半胱氨酸残基的翻译后修饰(氧化还原依赖型)来发挥调节作用的。Rayan Nirmala Arul等[25]研究表明木香烯内酯能够通过抑制炎性细胞因子和NO合成酶来激活小鼠中的BV2小胶质细胞,为治疗神经炎性疾病提供了另一治疗手段。Ji-Hyun Kim[26]等的研究表明,木香烯内酯能够通过抑制蛋白激酶B和核因子κB信号通路来诱导子宫内膜细胞凋亡,可作为治疗子宫内膜异位的一种潜在药物。Anans Sarwar等[27]研究了木香的乙醇提取物对白细胞吞噬活性、淋巴细胞增殖和干扰素γ的作用,表明它可以作为一种治疗自身免疫疾病和慢性炎症疾病的潜在药物。
关于木香药材及其活性成分的药理研究,Madan Mohan Pandey 等[28]和 Yu-Fang Wang 等[29]已经做过较好的总结,本文只在这做一些适当的补充。这些研究显示,木香药材及其活性成分的药效不够高,目前尚不能直接作为药物使用。据此,为了得到药效更加优良的化合物,通过对相关活性组分进行结构修饰与衍生来提高其药效的研究备受人们关注。对去氢木香内酯和木香烯内酯这两种化合物的结构修饰和衍生研究逐渐成为人们的研究重点,有些课题组还对衍生所得化合物与一些天然的倍半萜成分一起研究药效。
3 木香烯内酯与去氢木香内酯的结构修饰和衍生途径和方法
3.1 迈克尔(Michael)加成衍生
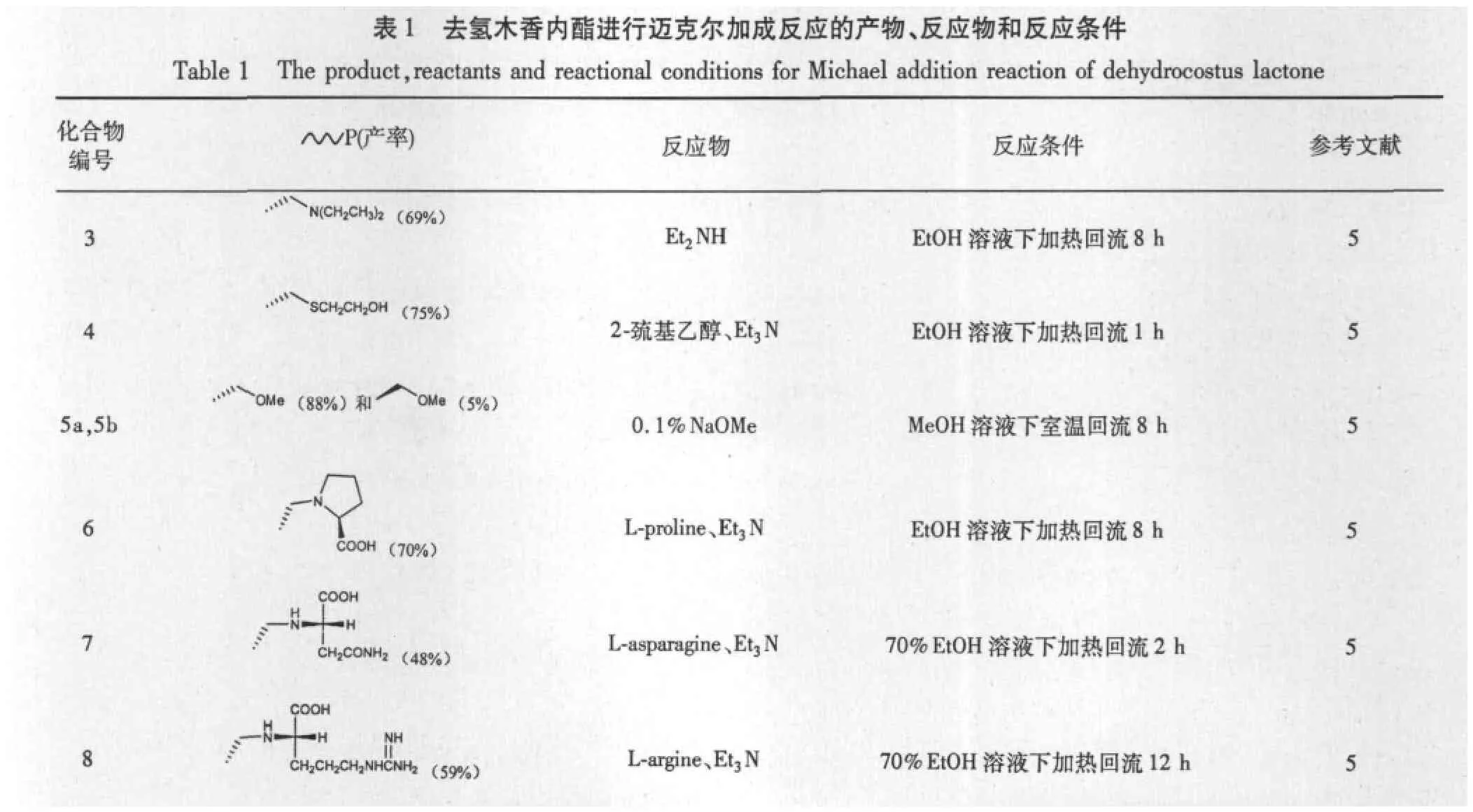
具有α-活泼氢原子的化合物,在碱的作用下形成负碳离子,此负碳离子可以与α,β-不饱和羰基化合物发生共轭亲核加成,这类反应叫做迈克尔反应。木香烯内酯和去氢木香内酯这两种化合物都具有α-亚甲基-γ-内酯结构,很多课题组研究了在13位碳上通过Michael加成,连接上含氮化合物,含氧化合物,含硫化合物等。
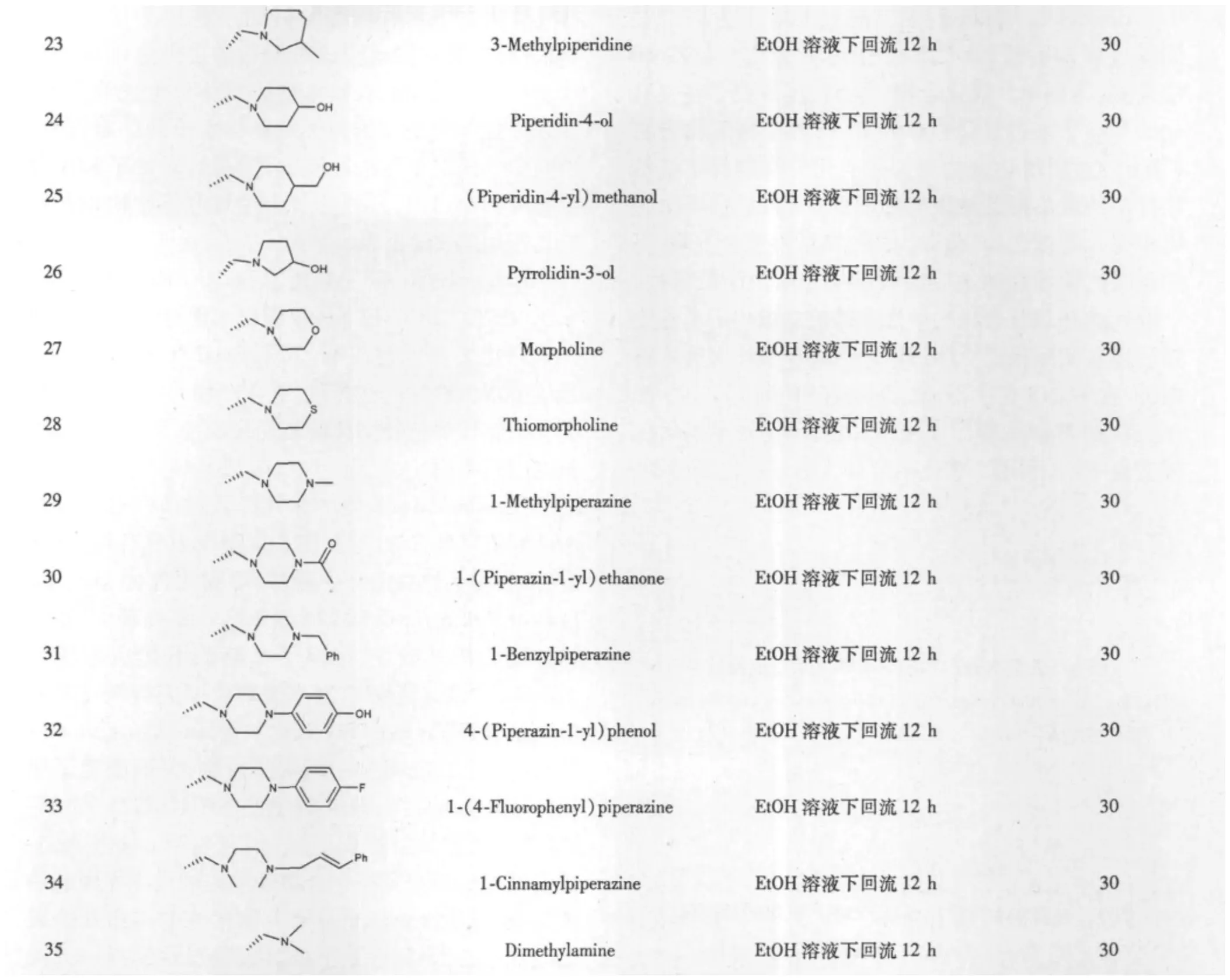
Hisashi Matsuda等[5]对木香烯内酯和去氢木香内酯通过13位碳上Michael加成,衍生获得乙二胺、2-巯基乙醇、甲氧基、一系列氨基酸等新化合物(图2、3和表1、2),相关反应的产率都在70%以上。对所获得的化合物分别进行对水压诱导和HCl/EtOH诱导的小鼠胃溃疡进行考察,发现去氢木香内酯、木香烯内酯与三个氨基酸倍半萜化合物6、7和17,是治疗胃溃疡的有效成分。Sanjay K.Srivastava等[30]以木香烯内酯为起始,通过在13位碳上进行系列氨基化合物的Michael加成,获得的产物对 SW-620(colon)、MIAPaCa2(pancreas)和 K-562(leukemia)等9种肿瘤细胞株有细胞毒性,研究表明去氢木香内酯在C13位修饰上系列氨基化合物尤其是吡啶和吡咯烷环化合物之后,其对不同肿瘤细胞具有良好的选择性,表现出其在抗肿瘤方面的潜在研发价值。

图2 去氢木香内酯进行迈克尔加成的反应通式Fig.2 Michael addition reaction of dehydrocostus lactone
?
?
F.A.Macías等[32]研究了对 α-亚甲基-γ-内酯的迈克尔加成,在β-不饱和羰酰基(以去氢木香内酯为例,图4)上加成羟基得到一个具有活性的倍半萜内酯,实验采用六甲基磷酰三胺(HMPA)来提高羟基的亲核性和稳定烯醇结构。课题组[33]还研究了多种愈创木倍半萜内酯诱导列当种子发芽的作用,实验发现在愈创木内酯骨架上引入第二内酯会失去对列当特异性作用,提高其它列当属植物的发芽速度。采用了如图4的反应后,又在羟基上接入一个内酯基团,刺激发芽作用增大。在β-不饱和羰酰基上引入一个羟基不仅可以改变去氢木香内酯的某些性质比如极性等,还为其它复杂基团的引入提供了一个有效的位点。

图4 去氢木香内酯通过迈克尔加成加成上羟基的反应Fig.4 Add hydroxyl groups to dehydrocostus lactone by Michael addition reaction
综上所述,去氢木香内酯和木香烯内酯的α-亚甲基-γ-内酯是其发挥活性的重要位点,而且还是其进行衍生化的一个活性位点;当在13位上采用Michael加成衍生获得一系列氨基和含氧含硫基团之后,其活性就有了显著性的改变,其具体改变有可能受化合物极性、空间位阻等因素的影响,但目前尚未有完整的研究能够有效地阐述其活性变化的原因和机制。
3.2 氧化和成环衍生
有课题组利用不同的氧化剂对去氢木香内酯和木香烯内酯进行氧化,实现了在环上衍生羟基基团,增加结构的亲水性;木香烯内酯在一些氧化剂作用下,能实现5位碳与10位碳连接,内部结构重排成环,将原来的十元环变成两个六圆环。
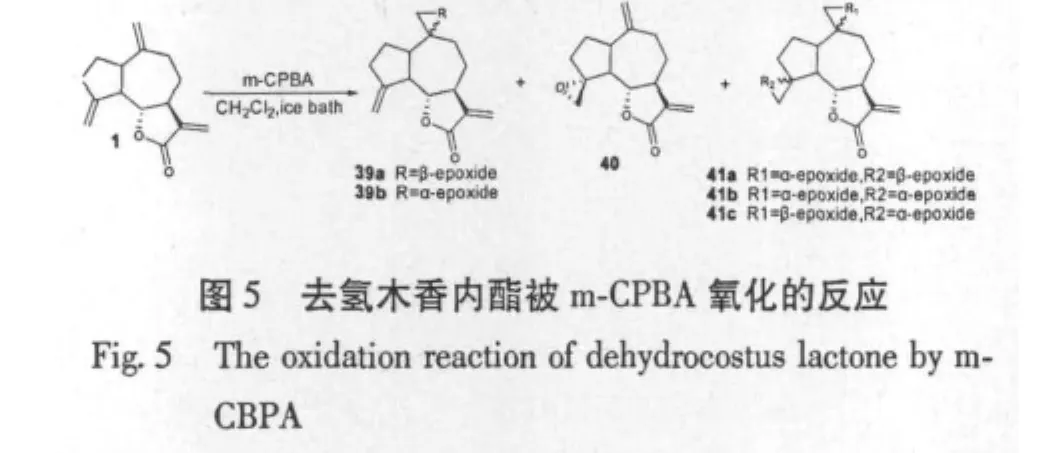
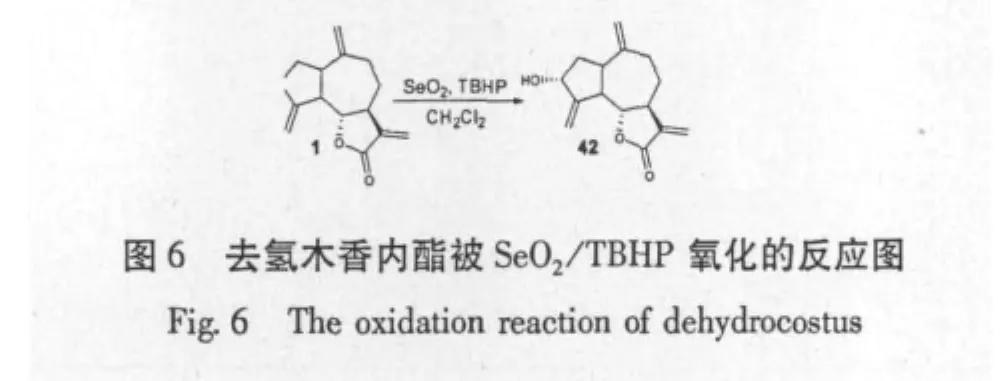
Charles L.Cantrell等[34]研究去氢木香内酯在间氯过氧苯甲酸(m-CPBA)作用下氧化4位或10位烯基,得到单环氧化合物(图5),还研究了在二氧化硒和叔丁基过氧化氢作用下,得到二环氧化合物(图6);对所得化合物与天然的化合物进行了抗结核杆菌的最小抑制浓度实验对照,结果显示当化合物中引入羟基之后,化合物的抗菌活性就会下降,可知影响抗菌活性的主要因素是倍半萜内酯的极性,一取代的环氧化合物的活性普遍比二取代的活性要强。还有文献报道[35]用H2O2/NaOH氧化去氢木香内酯,在11、13位上形成环氧化合物(图7)。

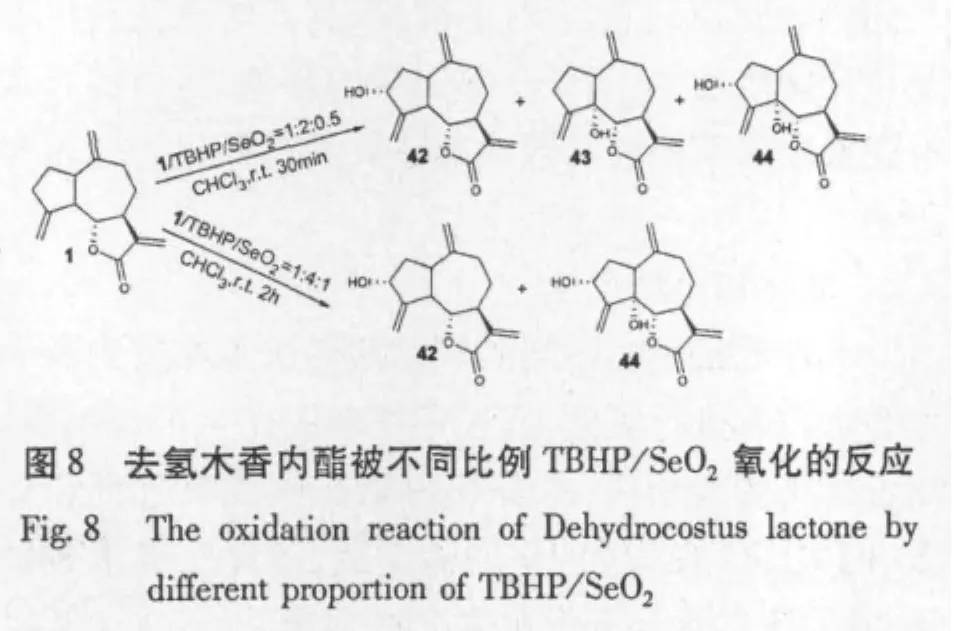
F.A.Macías等[36]根据氧化剂比例的不同氧化程度也不同,利用二氧化硒与叔丁基过氧化氢(TB HP)氧化去氢木香内酯等得到一些羟基化化合物(图8);进而依据半合成与天然的多种愈创木型倍半萜内酯对几种单双叶植物的发芽与生长的作用,发现内酯部分是抑制种子发芽与生长的必需部位,但是引入第二个不饱和羰基,能提高对种子和发芽生长的抑制作用,另外其亲脂性与立体结构也是影响其作用的关键因素。
HussainSabir等[37]采用了 SeO2/UHP/PEG-400、SeO2/UHP/CHCl2和SeO2/UHP/CH3OH作为氧化剂来氧化去氢木香内酯,其中SeO2/UHP/PEG-400系统表现出较好的选择性,氧化产物单一(图9),该类化合物作为植物生长调节剂表现出了促进植物生长的促进作用。
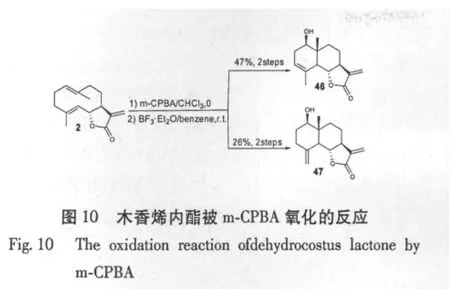
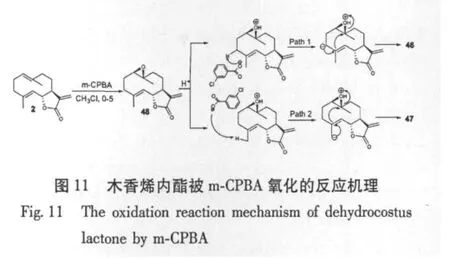
Hisashi Matsuda等[5]采用间氯过苯甲酸(m-CPBA)氧化对木香烯内酯,使5位碳与10位碳进行环合,并在C-1位加上一个羟基,得到化合物santamarine(46)和 reynosin(47)(图 10)。许卉等[38]在立体构型分析基础上,提出了可能的氧化反应机制(图11)。该课题组[39]对木香烯内酯进行氧化和乙酰化修饰,利用m-CPBA氧化木香烯内酯,还对1位羟基进行乙酰化得到一系列化合物,进而测定了所得单体化合物对人源肿瘤细胞SMMC-7721和PC-3M体外增殖抑制的IC50值。研究表明α-亚甲基-γ-内酯结构的倍半萜类化合物是木香细胞毒作用的物质基础,其活性受分子骨架上取代基的类型及位置影响显著,而亲脂性并不是其细胞毒性的唯一关键因素。他们还研究了11种木香倍半萜类化合物对脂多糖(LPS)诱导的小鼠巨噬细胞释放NO的抑制作用,发现木香倍半萜内酯环外双键对于该类化合物的NO释放抑制活性具有非常重要的意义[40]。
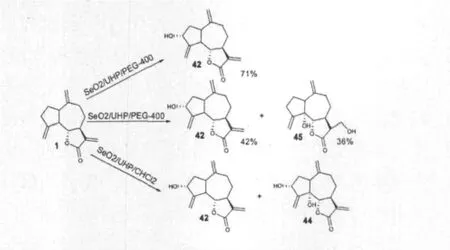
图9 去氢木香内酯在不同溶剂体系下被SeO2/UHP氧化的反应Fig.9 The oxidation reaction of Dehydrocostus lactone by SeO2/UHP in different solvent
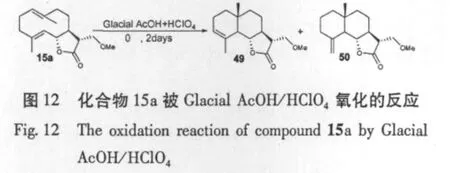
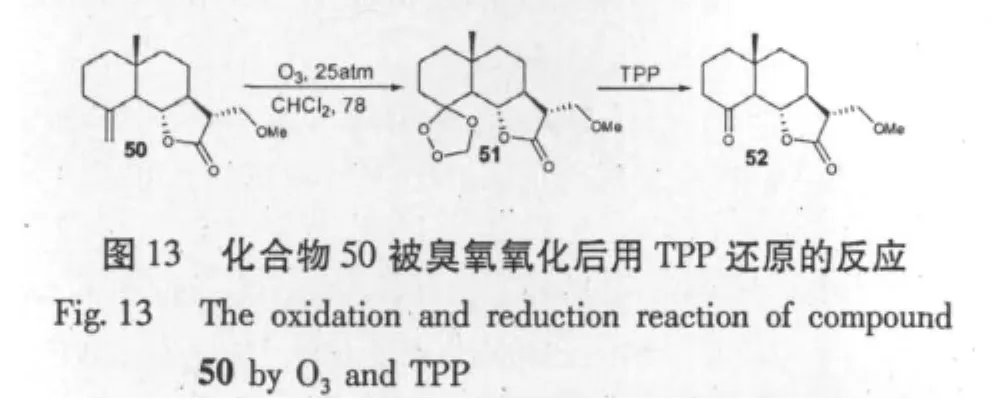
A.Robinson等[31]对木香烯内酯在 C13位进行Michael加成,加成上一个甲氧基后,再对所得化合物15a在高氯酸与冰醋酸混合物下环合得到化合物49和50,对化合物50用臭氧处理得到化合物51,然后用三苯基膦(TPP)对化合物11进行还原得到化合物52,该系列反应实现了在倍半萜内酯结构上引入另一个羰基。对部分所得化合物进行体外抗肿瘤细胞研究后发现α-亚甲基-γ-内酯结构是其抗肿瘤的主要活性位点,而其他位置双键的改变可能使对不同肿瘤细胞具有选择性的杀伤作用(图12,13)。
综上所述,木香烯内酯和去氢木香内酯在一些氧化剂作用下,增加取代基的数量、改变其位置、改变极性及破坏α-亚甲基-γ-内酯结构等,对它们的活性改变都有决定性的作用。衍生产物的极性、立体结构等的变化对其效能影响较大,且α-亚甲基-γ-内酯结构再次被证明对很多活性的发挥是一个必不可少的部位。
3.3 其它衍生方法
利用去氢木香内酯和木香烯内酯进行结构修饰和衍生,还能制备一些结构比较复杂的化合物包括一些复杂的天然活性化合物。
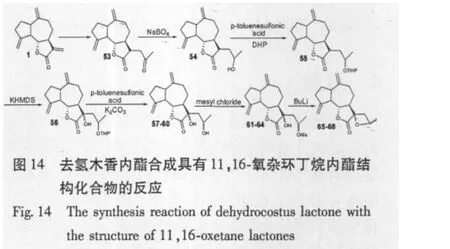
F.A.Macías等[41]研究了去氢木香内酯经过一系列反应,最终合成了具有11,13-氧杂环丁烷内酯的化合物,并对它们的立体结构进行了完整的分析,为以后研究这些衍生物的构效关系做好了准备(图14)。
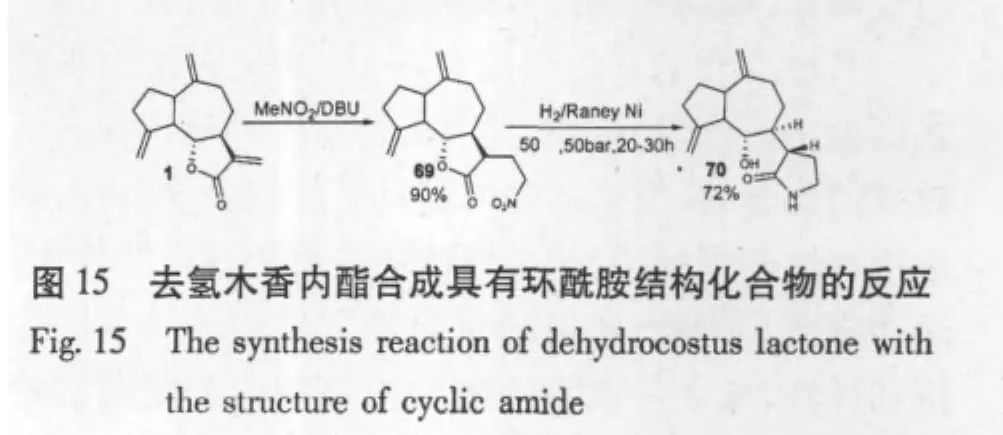
Andreas Otto等[42]先使用硝基甲烷与 DUB(二氮杂二环),在去氢木香内酯上迈克尔加成一个硝甲基,然后H2/兰尼Ni还原,将硝基转化成氨基后,转而进攻内酯结构,最后形成一个环酰胺结构(图15)。
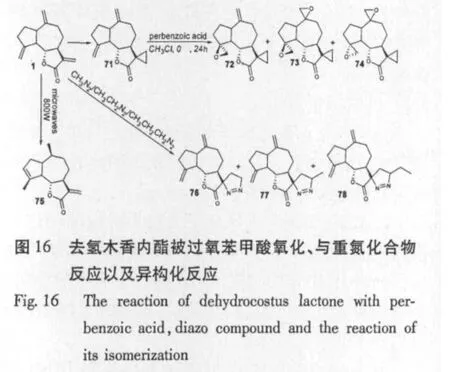
R.R.Setia等[43]研究了去氢木香内酯被过氧苯甲酸氧化、与重氮化合物反应以及热解反应(图16),并对得到的一系列化合物做了对植物根生长抑制实验,结果表明衍生后的抑制性增加,且其抑制性与13位上的碳链长度呈正相关,即碳链越长抑制活性越大。
有文献报道[44]木香烯内酯11、13位间的双键能参与Diels-Alder加成反应(图17),阐明一些复杂天然产物的合成方式。

4 展望
目前已经有很多课题组已经对木香药材中表现出良好抗肿瘤等活性的去氢木香内酯和木香烯内酯结构的成分进行了结构修饰和衍生研究,其主要集中在C-13位点的迈克尔加成和一些氧化反应,并对得到的系列化合物和一些天然的倍半萜化合物进行药效研究,以期为获得新的候选药物做准备。
虽然现在的衍生研究较多,但是大多采用鸟枪式衍生法,合成一系列衍生物,再从中筛选出相对药效高的化合物,衍生前并未进行系统的分子设计,缺乏指导性和靶标性,这会导致衍生过程盲目性较大,成功率低。因此,如何结合药物定量构效关系的分析和计算,从去氢木香内酯和木香烯内酯抗菌抗肿瘤等作用出发,在原有的研究基础上,合理高效设计出合适的目标衍生物,将使人们继续关注的重点。
目前衍生方式的研究主要集中在去氢木香内酯和木香烯内酯C-13位点的迈克尔加成和一些氧化反应,在母体分子上引入一些氨基酸、含氮化合物、羟基、环氧环等,以此来改变母体化合物的性质,提高药效。而且在去氢木香内酯和木香烯内酯结构衍生基础上,引入羟基和环氧环后,可以继续衍生,在C-13位点以外,连接上比较复杂的基团或者是某些活性分子,可以进一步提高药效。如何将现代合成技术中的组合化学技术引入,在短时间内在分子上引入含氮、氧或者硫的一系列电子等排体,然后配合高通量筛选,以期快速筛选得到高药效的目标化合物是长远发展的趋势之一。
1 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People's Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010,VolⅠ,57-58.
2 Nanjing University of Traditional Chinese Medicine(南京中医药大学).Dictionary of Traditional Chinese Medicine(中药大辞典).Shanghai:Shanghai Scientific&Technical Publishers,2006.478.
3 Sun CM,et al.Cytotoxicity sesquiterpenelatones from the root of Saussurealappa.J Nat Prod,2003,66:1175-1180.
4 Kalsi PS,Sharma S,Kaur G.Isodehydrocostus lactone and isozaluzaninC,twoguaianolides from Saussurealappa.Phytochemistry,1983,22:1993-1995.
5 Matsuda H,et al.Absolute stereo-structures and syntheses of Saussureamines A,B,C,D and E amino acidesquiterpene conjugates with gastroprotective effect,from the roots of Saussurealappa.Tetrahedron,2000,56:7763-7777.
6 Kalsi PS,et al.Guaianolides from Saussurealappa.Phytochemistry,1995,40:1713-1715.
7 Yin HQ,et al.Two new sesquiterpene lactones with the sulfonic acid group from Saussurealappa.Chem Pharm Bull,2005,53:841-842.
8 Yang H(杨辉),et al.Study on chemical constituents of SaussurealappaⅠ.Acta Bot Yunnan(云南植物研究),1997,1:85-91.
9 Duan JA,et al.A New sesquiterpene and other constituents from Saussurealapparoot.Nat Prod Commun,2010,5:1531-1534.
10 Singh V,Ali M.Phytoconstituents from Saussurealapparoots.Indian J Chem,2004,43:655.
11 Yang H(杨辉),et al.Study on chemical constituents of SaussurealappaⅡ.Acta Bot Yunnan(云南植物研究),1997,1:92-96.
12 Rao KS,et al.Acylated flavone glycosides from the roots of Saussurealappa and their antifungal activity.Molecules,2007,12:328-344.
13 Yu HH,et al.Saussurealappa inhibits the growth,acid production,adhesion,and water-insoluble glucan synthesis of Streptococcus mutans.J Ethnopharmacol,2007,111:413-417
14 Hao LJ(郝立杰),et al.Inhibitory effects of sesquiterpenes from Saussurealappa on the vascular endothelial growth factor.Nat Prod Res Dev(天然产物研究与开发),2010,22:687-691.
15 Choi JH,Lee KT.Costunolide-induced apoptosis in human leukemia cells:Involvement of c-Jun N-terminal kinase activation.Biol Pharm Bull,2009,32:1803-1808.
16 Kim EJ,et al.Apoptosis of DU145 human prostate cancer cells induced by dehydrocostus lactone isolated from the root of Saussurealappa.Food Chem Toxicol,2008,46:3651-3658.
17 Tang YP(唐于平),et al.Inhibitory effects of sesquiterpenes from Common Aucklandia Root on proliferation of five kinds cultured cancer cells in vitro.China J Tradit Chin Med Pharmacy(中华中医药杂志),2010,25:2180-2182.
18 Liu CY,et al.Costunolide causes mitotic arrest and enhances radiosensitivity in human hepatocellular carcinoma cells.Radiat Oncol,2011,6:56.
19 Choi EJ,Kim GH.Evaluation of anticancer activity of dehydrocostuslactone in vitro.Mol Med Report,2010,3:185-188.
20 Jeong GS,et al.The α-methylene-γ-butyrolactone moiety in dehydrocostus lactone is responsible for cytoprotectiveheme oxygenase-1 expression through activation of the nuclear factor E2-related factor 2 in HepG2 cells.Eur J Pharmacol,2007,565:37-44.
21 Ambavadeetal SD,et al.Pharmacological evaluation of anticonvulsant activity of root extract of Saussurealappa in mice.Eur J Integr Med,2009,1:131-137.
22 Choi EM,et al.Protective effects of dehydrocostus lactone against hydrogen peroxide-induced dysfunction and oxidative stress in osteoblastic MC3T3-E1 cells.Toxicolin Vitro,2009,23:862-867.
23 Choi JY,et al.Isolation of betulinic acid,its methyl ester and guaiane sesquiterpenoids with protein tyrosine phosphatase 1B inhibitory activity from the roots of Saussurealappa C.B.Clarke.Molecules,2009,14:266-272.
24 Butturini E,et al.Two naturally occurring terpenes,dehydrocostuslactone and costunolide,decrease intracellular GSH content and inhibit STAT3 activation.PLoS One,2011,6:20174.
25 NA Rayan,et al.Costunolide inhibits proinflammatory cytokines and iNOS in activated murine BV2 microglia.Front Biosci,Elite Ed,2011,3:1079-1091.
26 Kim JH,et al.Costunolide induces apoptosis in human endometriotic cells through inhibition of the prosurvival akt and nuclear factor kappa B Signaling pathway.Biol Pharm Bull,2011,34:580-585.
27 Sarwar A,et al.Effects of Saussurea lapparoots extract in ethanol on leukocyte phagocytic activity,lymphocyte proliferation and inter feron-gamma(IFN-γ).Pak J Pharm Sci,2007,20:175-179.
28 Pandey MM,et al.Saussurea costus:Botanical,chemical and pharmacological review of an ayurvedic medicinal plant.J Ethnopharmacol,2007,110:379-390.
29 Wang YF,et al.Secondary metabolites of plants from the genus Saussurea:Chemistryand biologicalactivity.Chem Biodivers,2010,7:2623-2659.
30 Srivastava SK,et al.Synthesis of 13-amino costunolide derivatives as anticancer agents.Bioorg Med Chem Lett,2006,16:4195-4199.
31 Robinson A,et al.A new sesquiterpene lactone from the roots of Saussurea lappa:Structure-anticancer activity study.Bioorg Med Chem Lett,2008,18(14):4015-4017.
32 Macías FA,et al.An easy access to bioactive 13-hydroxylated and 11,13-dihydroxylated sesquiterpene lactones(SLs)through Michael addition of a nucleophilichydroxyl group.Tetrahedron,2008,64:10996-11006.
33 Macías FA,et al.New chemical clues for broomrape-sunflower host-parasite interactions:Synthesis of guaianestrigolactones.J Agric Food Chem,2009,57:5853-5864.
34 Cantrell CL,et al.Antimycobacterial activities of dehydrocostus lactone and its oxidation products.J Nat Prod,1998,61:1181-1186.
35 Chhabra BR,et al.Sesquiterpene lactones from Saussurealappa.Phytochemistry,1998,49:801-804.
36 MacíasFA,et al.Sesquiterpene lactones with potential use as natural herbicide models.2.guaianolides.J Agric Food Chem,2000,48:5288-5296.
37 Sabir H,et al.Highly selective oxygenations of olefins over selenium dioxide using urea hydrogen peroxide as oxidising agent withsesquiterpene lactones.J Global Pharm Technol,2010,2(4):88-92.
38 Xu H(许卉),et al.Oxidation of costunolide with m-chloroperbenzoic acid.J Yantai Univ,Nat Sci Eng Ed(烟台大学学报,自然科学与工程版),2006,19:181-185.
39 Xu H(许卉),et al.Study on sesquiterpenes constituents from Aucklandia lappa decne and and their cytotoxic activity.Proceedings of the Research and Development of Innovative Drugs and New Varieties Academic Conference(创新药物及新品种研究、开发学术研讨会论文集),2006.
40 Zhao F(赵烽),et al.The Research of Anti-inflammatory Activity In Vitro by Sesquiterpenes from Aucklandia lappa Decne and their Structure-activity Relationship.Proceedings of the Research and Development of Innovative Drugs and New Varieties Academic Conference(创新药物及新品种研究、开发学术研讨会论文集),2006.
41 Macías FA,et al.11,16-oxetane lactones.Spectroscopic evidences and conformational analysis.Tetrahedron,2006,62:7747-7755.
42 OttoA,et al.Stereoselective synthesis of 3-(ω-hydroxyalkyl)-2-pyrrolidinones from α-alkylidenelactones and nitromethane.Tetrahedron-Asymm,1999,10:3381-3389.
43 Setia RR,et al.Chemical modifications of dehydrocostus lactone from Saussurealappa and the study of structure-activity relationship.Indian J Chem,2007 46:847-851.
44 Appendino G,et al.Genepolide,a Sesterpene γ-lactone with a novel carbon skeleton from mountain wormwood(Artemisia umbelliformis).J Nat Prod,2009,72:340-344.
