高速逆流色谱制备玫瑰红景天中的三种酚性化合物
2012-09-11马朝阳傅倩云
马朝阳,傅倩云,栾 霄,黄 超
1江南大学食品学院;2江南大学医药学院,无锡 214122
玫瑰红景天(Rhodiola rosea)在中国和东欧国家是一种有名的传统药用植物,具有去疲劳、增强学习和记忆、兴奋中枢神经系统、提高工作效率、耐缺氧、改善睡眠、预防高原病、抗癌等多种生理功能[1],目前是一种很受欢迎的药食两用“适应原”植物。多酚是其抗氧化活性成分。目前对玫瑰红景天酚性成分分离的主要方法是多步柱色谱[2,3],其主要的缺点是分离过程复杂、回收率低、大量消耗有机溶剂。近来,高速逆流色谱(HSCCC)作为一种现代分离技术可以很好弥补柱色谱技术的缺陷,在天然活性成分的分离上正得到越来越广泛的应用。
HSCCC是20世纪80年代初期发展起来的一种连续高效的液-液分配色谱分离技术。由于不使用固态支持介质,避免了因不可逆吸附引起的样品损失、失活变性等现象,具有样品无损失、无污染、高效、快速等优点。目前,高速逆流色谱已被广泛应用于天然药物成分的分离制备和中药的分析鉴定中,应用HSCCC可以分离纯化黄酮、生物碱、皂苷等有效成分[4]。同时具有制备量大,分离效果好,速度快等优势。
目前还没有使用HSCCC方法分离玫瑰红景天酚性化合物的报道。本研究的主要目的是形成一种简单有效的HSCCC方法同时纯化玫瑰红景天提取物中的三种酚性化合物。
1 材料与方法
1.1 材料与试剂
样品的提取及HSCCC分离的试剂(正己烷、乙酸乙酯、乙醇、甲醇)均为分析纯;水为二次蒸馏水;UPLC流动相为色谱纯试剂;玫瑰红景天提取物(西安小草科技有限公司)。
1.2 仪器与设备
TBE-300A高速逆流色谱仪(上海同田生化技术有限公司);ÄKTA泵系统配有紫外吸收检测器和分步收集器(瑞士通用电气医疗集团);HX-1050恒温循环器(北京博医康实验仪器有限公司);WATERS ACQUITY UPLC超高效液相色谱仪(美国沃特世公司);BC-202B旋转蒸发仪(上海贝凯生物化工设备有限公司);DL-360B超声波清洗器(上海之信仪器有限公司);TOF-MS质谱仪(沃特世公司,美国)。
1.3 实验方法
1.3.1 溶剂系统的选择
本实验使用UPLC法来测定三种红景天多酚样粗品中各组分的分配系数K值,来确定用于高速逆流色谱分离的两相溶剂体系。测定方法如下:配得不同比例的溶剂体系10 mL,加入2.5 mg玫瑰红景天样品超声溶解后静置2 h,分别取上下相溶液2.5 mL浓干,分别用10 mL乙醇溶解后取1 mL溶液进行UPLC测定,测得上下相的峰面积为A1和A2。分配系数K则按下式计算:K=A1/A2。选取待分离组分的K值为0.2~5,且不同相邻组分K值之比大于1.2的两相溶剂体系作为高速逆流色谱分离过程中的两相溶剂体系。
1.3.2 样品前处理
称取红景天粗品65.00 g,水溶解后以1 BV/h上装有1L聚酰胺树脂的层析柱(5.6×60 cm)富集酚性化合物,上样结束后,用1.5 BV水洗柱除去不被吸附的成分,然后用95%乙醇洗脱,洗脱物浓干得7.83 g酚性化合物,最后过装有250 mL的硅胶柱(3.5×50 cm),收集650 mL乙酸乙酯-甲醇(16∶1,v/v)洗脱物,浓干得2.38 g固形物,用于HSCCC分离。
1.3.3 制备两相溶剂系统和样品溶液
将正己烷、乙酸乙酸、醋酸、水(体积比4∶5∶4∶5)置于分液漏斗中,充分振摇后静置24 h,将上相和下相分开,超声脱气20 min后使用。取150 mg的前处理后的固形物溶于15 mL上相流动相作为进样样品。
1.3.4 HSCCC分离
用泵将固定相(上相)以25 mL/min的流速泵入HSCCC分离柱,固定相充满色谱柱后,打开主机,转速定为800 rpm,以3 mL/min的流速泵入流动相(下相);待整个系统建立动态平衡后(1.5 h),流速调为1.5 mL/min,由六通进样阀进样,进行HSCCC分离。分离过程中根据紫外检测图谱,接收目标成分,检测波长为280 nm。收集到的各部分样品溶液,用旋转蒸发仪蒸干真空干燥得相应的固体成分。
1.3.5 UPLC-TOF-MS分析
将收集到的红景天多酚各组分进行UPLC-TOFMS分析,分析条件:采用UPLCTMBEH C18色谱柱(100 mm × 2.1 mm,1.7 μm)(Waters,USA),流动相为乙腈(0.1%,v/v)-甲酸水溶液,梯度洗脱程序如下,0~8 min,5% ~40%乙腈;8 ~12 min,40% ~100% 乙腈。流速0.3 mL/min,紫外检测波长280 nm,柱温35 ℃,进样量1 μL。
质谱条件如下:离子源为ESI,分析模式为负离子模式。脱溶剂温度400℃,离子源温度100℃,锥孔气体流速50 L/Hr,毛细管电压3000 V,样品锥孔电压20.0 kV,提取锥孔电压4.0 kV,捕获气体流速1.5 mL/min,载气流速24 mL/min。质谱扫描范围m/z 100~1000。
1.3.6 三种化合物1H NMR谱测定
将三种化合物溶于氘代试剂中,其中化合物1和化合物2溶于氘代甲醇,化合物3溶于氘代氯仿中,在400MHz的 Avance核磁共振仪(Bruker,瑞士)上测定氢谱,以四甲基硅烷(TMS)为内标物。
2 结果与讨论
2.1 流动相的选择
成功的HSCCC分离很大程度上依赖寻找合适的溶剂系统,可以提供理想的分配系数K值,实际的K值一般落在0.2~5的范围内。参考Ito方法[5],由于所要分离的组分可以溶于乙酸乙酯,所以溶剂系统的筛选从乙酸乙酯-水(1∶1,v/v)开始,此时三种目标成分的K值偏大(表1),说明主要分配在上相,作为HSCCC溶剂系统不合适。溶剂系统的搜寻偏向脂溶性更强的溶剂体系-正己烷∶乙酸乙酯∶甲醇∶水(1∶1∶1∶1,v/v/v/v),而此时的 K 值又太小,目标成分很快洗出分离效果差。溶剂系统的搜寻在此基础上往脂溶性稍弱的溶剂系统[6,7]正己烷∶乙酸乙酯∶甲醇∶水(4∶5∶4∶5),此时目标成分的K值落在合适的范围说明可以作为HSCCC分离的溶剂系统。
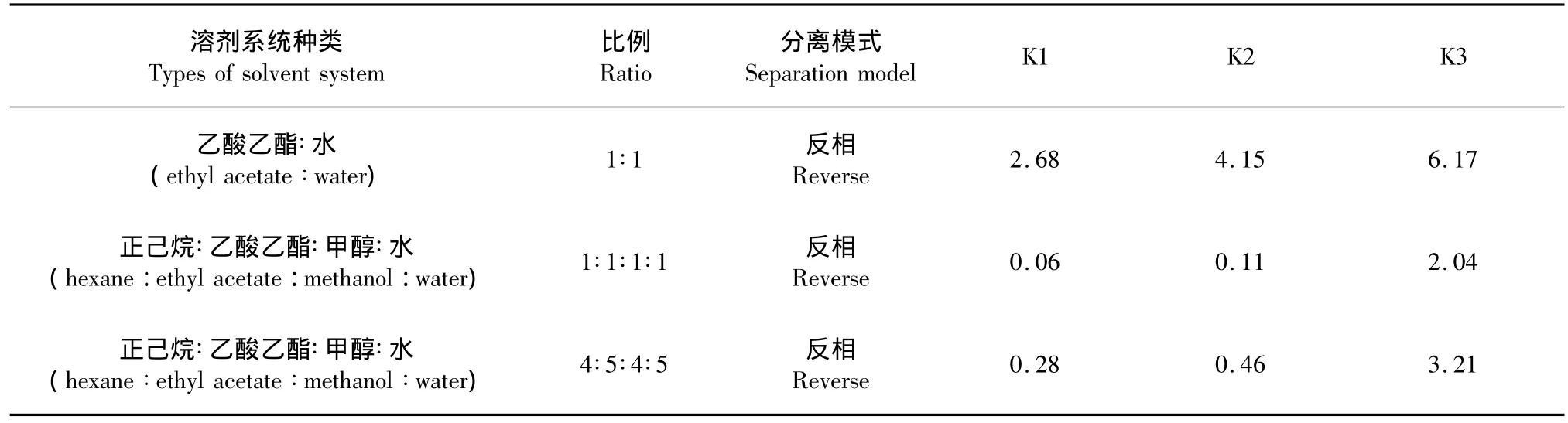
表1 溶剂系统的选择Table 1 Selection of solvent system
2.2 高速逆流色谱分离结果
在制备HSCCC分离过程中,进样量被优化,当进样量在80~150 mg范围内没有流动相和分辨率的损失,进一步增加进样量时会导致流动相的流失使分离失败,因此进样量选150 mg。在分离过程中,由于化合物3的分配系数较大,意味着长的洗脱时间。所以当化合物1和化合物2洗脱出来175 min钟后,流动相流速从开始的1.5 mL/min采用增大到3.0 mL/min,从而减小化合物3的出峰时间。三种化合物分离的HSCCC色谱图如图1所示。150 mg样品经HSCCC分离后得到化合物1:68.5 mg、化合物2:8.5 mg、化合物3:45.5 mg,根据UPLC中峰面积比例可以得到它们的纯度分别达到99.1%、98.5%、99.4%。三种化合物的UPLC色谱图如图2所示。
2.3 三种化合物的结构鉴定
三种化合物的质谱数据(图3)和1H NMR数据如下:
化合物 1:C7H5O5,[M-H]-169.0124(error:5.5 ppm);1H NMR(400 MHz,CD3OD)δ;7.08(2H,s,H-2,6)。

图1 分离三种化合物的HSCCC色谱图Fig.1 HSCCC chromatography of pre-treated Rhodiola rosea extract
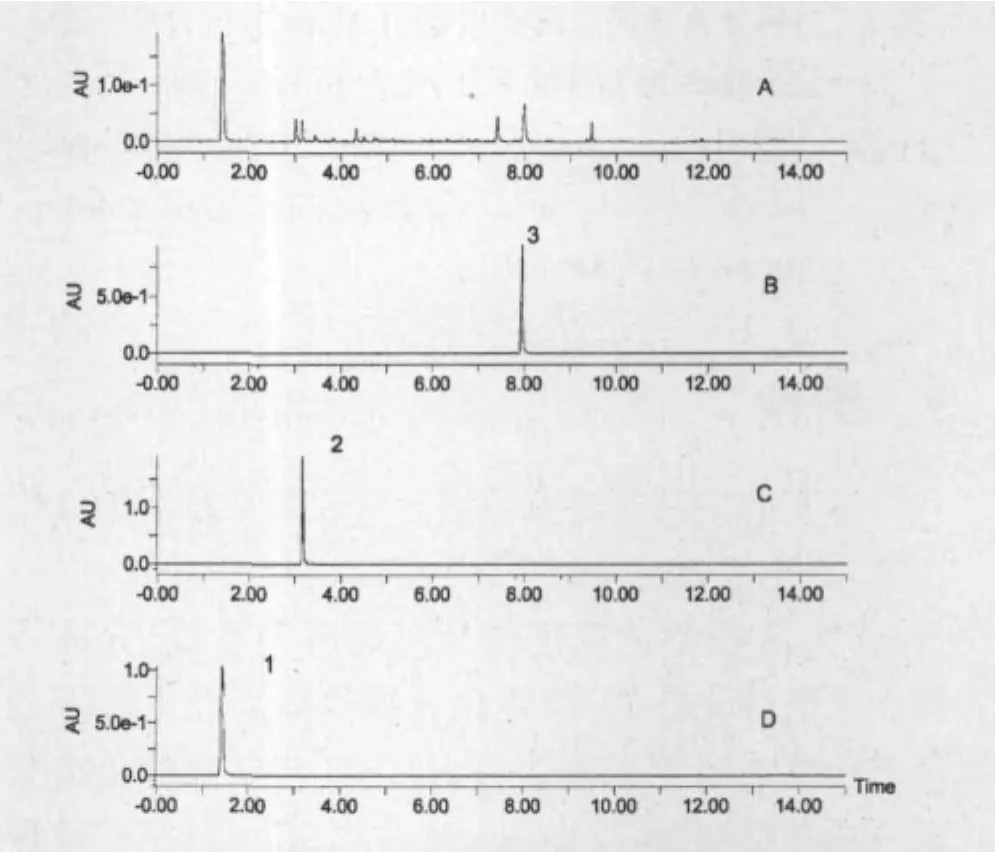
图2 粗分离样品及纯化的三种化合物的超高效液相色谱图,其中图A为粗分离样品,化合物1(图D)为没食子酸、化合物2(图C)为没食子酸甲酯、化合物3(图B)为山奈酚Fig.2 UPLC chromatograms of the pre-treated crude extract(A),the purified compound 1(D),compound 2(C)and compound 3(B)
化合物2:C8H7O5,[M-H]-183.0293(error:5.5 ppm);1H NMR(400 MHz,CD3OD)δ:7.06(2H,s,H-2,6),3.90(2H,s,-CH3)。
化合物3:C15H9O6,[M-H]-285.0399(error:5.2 ppm);1H NMR(400 MHz,CDCl4)δ:8.11(2H,d,J=8.7 Hz,H-2’,6’),6.93(d,J=8.7 Hz,H-3’,5’),6.40(1H,J=2.0 Hz,H-6),6.19(d,J=2.0 Hz,1H)。
基于以上数据,三种化合物鉴定为没食子酸(Gallic acid)[8],没食子酸甲酯(Methyl gallate),山奈酚(Kaempferol)[9]。

图3 三种化合物的电喷雾质谱图,化合物1:没食子酸;化合物2:没食子酸甲酯;化合物3:山奈酚Fig.3 ESI-MS spectra of three separated constituents,compound 1:Gallic acid;compound 2:Methyl gallate;compound 3:Kaempferol
3 结论
本文应用高速逆流色谱分离玫瑰红景天酚性化合物,以正己烷-乙酸乙酯-甲醇-水(4∶5∶4∶5,v∶v∶v∶v)作为制备型逆流色谱分离的溶剂系统,分离得到3个酚性化合物,单体化合物的纯度经高效液相色谱检测均高于98%。将HSCCC与常规柱色谱分离方法相结合,可以提高分离效率,在天然活性成分的分离纯化方面有广阔的应用前景。
1 Panossian A,Wikman G,Sarris J.Rosenroot(Rhodiola rosea):traditional use,chemical composition,pharmacology and clinical efficacy.Phytomed,2010,17:481-493.
2 Bao WF(包文芳),Wu WC(吴维春),Zhang W(张薇).I-solation and identification of domestic Rose Rhodiola watersoluble components.Chin J Med Chem(中国药物化学杂志),2000,10:209-210.
3 Zapesochnaya GG,Kurkin VA.Glycosides of cinnamyl alcohol from the rhizomes of Rhodiola rosea.Chem Nat Comp,1983,18:685-688.
4 Han X,Zhang T,Wei Y,et al.Separation of salidroside from Rhodiola crenulata by high-speed counter-current chromatography.J Chromatogr A,2002,971:237-241.
5 ItO Y.Golden rules and pitfalls in selecting optimum conditions for high-speed counter-current chromatography.J Chromatogr A,2005,1065:145-168.
6 Ouyang XK,Jin MC,He CH.Preparative separation of four major alkaloids from medicinal plant of Tripterygium wilfordii Hook F using high-speed counter-current chromatography.Sep Purific Technol,2007,56:319-324.
7 Yanagida A,Yamakawa Y,Noji R,et al.Comprehensive separation of secondary metabolites in natural products by highspeed counter-current chromatography using a three-phase solvent system.J Chromatogr A,2007,1151(1/2):74-81.
8 Jiao QY(焦启扬),Wu LJ(吴立军),Huang J(黄建),et al.Chemical constituents from the involucre of Castanea mollissima Blume.J Shenyang Pharm Univ(沈阳药科大学学报),2009,1:26-29.
9 Liu JL(刘俊岭),Re N(热娜),Du NS(堵年生).Chemical constituents from the root of Rhodila pamiera.Nat Prod Res Dev(天然产物研究与开发),2000,12(3):30-33.
