北方五省(区)马铃薯晚疫病菌对甲霜灵和精甲霜灵的敏感性检测
2012-09-11王文桥韩秀英张小风马志强孟润杰
王文桥, 王 丽, 韩秀英, 张小风, 马志强, 孟润杰
(河北省农林科学院植物保护研究所,河北省农业有害生物综合防治工程技术研究中心,保定 071000)
马铃薯晚疫病具有暴发性和毁灭性,对马铃薯生产构成严重威胁,生产上主要依靠药剂防治。甲霜灵、精甲霜灵、噁霜灵等苯基酰胺类杀菌剂对卵菌菌丝生长、休止孢萌发均具有很强的抑制作用,有良好的内吸传导性能,对晚疫病有优异的预防、治疗和铲除作用,甲霜灵单剂及甲霜灵、精甲霜灵、噁霜灵等苯基酰胺类杀菌剂与代森锰锌的混剂是防治晚疫病最有代表性的药剂,曾大大提高晚疫病等卵菌病害的防治水平,该类药剂在国内外使用年限长约30年,用于种薯处理或叶面喷施。据作者调查,近几年来甲霜灵·锰锌、精甲霜灵·锰锌等混剂对我国马铃薯晚疫病防效有所下降。国内外相继报道了马铃薯晚疫病菌对甲霜灵或精甲霜灵抗性发生[1-14],生产中迫切需要检测马铃薯晚疫病菌(Phytophthora infestans)对甲霜灵和精甲霜灵的敏感性,以验证田间药效下降是否由于马铃薯晚疫病菌对甲霜灵和精甲霜灵敏感性降低而造成。河北、吉林、辽宁、黑龙江和内蒙古是我国商品薯主产区,也是我国重要的种薯繁育基地。本研究检测了2007-2009年从河北、吉林、辽宁、黑龙江和内蒙古等北方主产区采集的马铃薯晚疫病菌对甲霜灵、精甲霜灵的敏感性,旨在明确上述北方五省(区)马铃薯晚疫病菌对甲霜灵和精甲霜灵的敏感性差异及抗性发生状况,为制定苯基酰胺类杀菌剂使用对策及指导马铃薯晚疫病化学防治提供依据。
1 材料与方法
1.1 供试药剂
氨苄青霉素(ampicillin),中诺药业(石家庄)有限公司;利福平(rifampicin),沈阳红旗制药有限公司;95%五氯硝基苯(quintozene)原药,山西三立化工有限公司;97%甲霜灵(metalaxyl)原药,沈阳化工研究院;97.1%精甲霜灵(metalaxyl-M)原药,先正达(中国)投资有限公司;二甲亚砜(DMSO,分析纯),天津市福晨化学试剂厂;丙酮(acetone,分析纯),天津市嘉顺化工有限公司。
1.2 供试培养基
黑麦琼脂蔗糖培养基(RSA):黑麦60g,蔗糖20g,琼脂粉12g,蒸馏水1000mL。
胡萝卜琼脂培养基(CA):胡萝卜200g榨成汁,琼脂粉20g,蒸馏水1000mL。
选择性培养基:含氨卞青霉素200μg/mL,利福平20μg/mL和五氯硝基苯100μg/mL的RSA培养基。
1.3 供试菌株
2007-2009年从河北省、吉林省、辽宁省、黑龙江省和内蒙古自治区种植马铃薯的田块采集晚疫病病叶,经分离纯化鉴定后获得的晚疫病菌菌株10℃保存于试管中RSA斜面上。所有菌株均来自相距1km以上的田块。
1.4 供试植物材料
在温室种植感病种薯‘费乌瑞它(favorita)’,待长至7~8片复叶时剪取中上部展开叶片供试。
1.5 马铃薯晚疫病菌对甲霜灵及精甲霜灵的敏感性检测
1.5.1 菌丝生长速率法检测马铃薯晚疫病菌对甲霜灵的敏感性
将甲霜灵原药用二甲亚砜配制成1000μg/mL的母液,再稀释至50μg/mL,按体积比1∶9将药液与三角瓶中融化后冷却至约60℃的CA培养基充分混匀,配制成含甲霜灵(5、100μg/mL)的CA 平板,以仅含二甲亚砜的CA平板为对照。将在RSA平板上培养10d的菌株用打孔器沿菌落边缘打取直径为5mm的菌饼,接种在含5、100μg/mL甲霜灵CA平板及对照平板中央,每处理接种3皿,18℃培养7~10d,当对照菌落直径达到3cm以上时,用十字交叉法测量菌落直径。
参照Oyarzun的方法[15]将菌株划分成:抗性菌株(R),在含5μg/mL和100μg/mL甲霜灵的CA平板上菌落直径均≥对照菌落直径的40%;敏感菌株(S),在含5μg/mL和100μg/mL甲霜灵的CA平板上菌落直径均<对照菌落直径的40%;中间型菌株(I),在含5μg/mL甲霜灵的CA平板上菌落直径≥对照菌落直径的40%,在含100μg/mL甲霜灵的CA平板上菌落直径<对照菌落直径的40%。
抗性菌株分布频率(%)=(抗性菌株数/菌株总数)×100。
1.5.2 叶盘漂浮法[16]检测马铃薯晚疫病菌对甲霜灵及精甲霜灵的敏感性
将甲霜灵及精甲霜灵原药先用少量丙酮溶解,再用去离子水稀释成1000μg/mL的母液,用去离子水稀释配成系列浓度的药液:200、100、50、10、5、1、0.5、0.1、0.05μg/mL。每个浓度的药液取20mL,加入直径9cm的培养皿中,对照加蒸馏水,每处理3皿。剪取长势一致的马铃薯叶片,用打孔器打取直径为15mm的叶盘,背面向上漂浮于液面上,每皿10片叶盘。将菌株在RSA平板上培养7~10d后,用蒸馏水将孢子囊洗下,配制成浓度为1×105孢子囊/mL的孢子囊悬浮液,用微型移液器接种于叶盘中心,10μL/叶盘。置于18~20℃、每天16h光照条件下培养4~5d,根据叶盘上产孢面积占叶盘面积的百分比调查叶盘病级:0级,无病;1级,1%~5%;3级,6%~10%;5级,11%~20%;7级,21%~50%;9级,>50%。
计算病情指数及相对防效。利用DPS数据处理软件,根据药剂系列浓度的对数值与每个浓度相对防效的几率值之间的线性回归分析,求出甲霜灵及精甲霜灵对菌株的毒力回归方程式(Y=a+bX)、相关系数(R)及菌株对甲霜灵及精甲霜灵敏感性(EC50值),参照Schwinn[16]等的方法划分菌株:敏感(sensitive,S),EC50值≤0.01μg/mL;中间型(inter-mediate,I),0.01μg/mL<EC50值≤10μg/mL;抗性(resistant,R),EC50值>10μg/mL。计算北方五省马铃薯晚疫病菌对甲霜灵及精甲霜灵的各类敏感型菌株所占比率。
病情指数=∑(每个级别的叶盘数×相应病级数)×100/(叶盘总数×最高病级数);
相对防效(%)=[(对照病情指数-处理病情指数)/对照病情指数]×100。
2 结果与分析
2.1 在离体条件下马铃薯晚疫病菌对甲霜灵的敏感性
菌丝生长速率法检测结果显示,河北、辽宁、吉林、黑龙江及内蒙古等北方五省(区 )马铃薯晚疫病菌已普遍对甲霜灵产生抗性。供试的380个菌株中,对甲霜灵的抗性菌株频率达到80.0%,表明抗性菌株已在群体中占优势,中间型菌株占2.9%,而敏感菌株占17.1%(表1)。采自河北省的菌株中对甲霜灵的抗性菌株从2007年的100%降为2008年的66.4%,2009年又回升至74.2%。而采自黑龙江的菌株中对甲霜灵的抗性菌株频率从2007年的52.9%上升为2008-2009年的100%。采自吉林省的菌株中对甲霜灵的抗性菌株频率从2008年的63.0%上升为2009年的90.7%。2008年采自辽宁和内蒙古的菌株中对甲霜灵的抗性菌株分别占100%和81.8%。
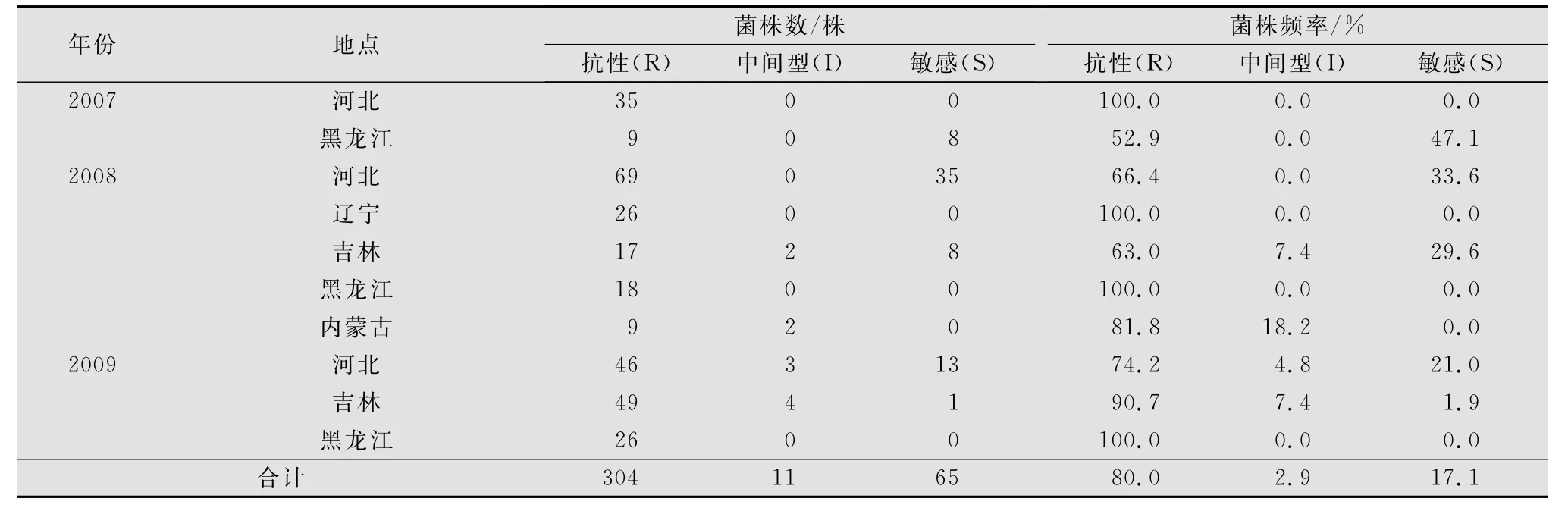
表1 菌丝生长速率法检测380株马铃薯晚疫病菌对甲霜灵的敏感性
2.2 在活体条件下马铃薯晚疫病菌对甲霜灵的敏感性
采用FAO推荐的叶盘漂浮法检测了采自河北、辽宁、吉林、黑龙江及内蒙古的380个菌株中222株对甲霜灵的敏感性,结果表明,其EC50值分布在0.0284~815.3618μg/mL之间,平均值为106.29μg/mL,对甲霜灵的抗性菌株占73.5%,与菌落生长速率法所测对甲霜灵的抗性菌株频率(80%)较为一致,中间型菌株占26.5%(表2),明显高于菌落生长速率法所测得的中间型菌株频率(2.9%),未检测到敏感菌株,而用菌落生长速率法测得的敏感菌株频率为17.1%。叶盘漂浮法检测的河北省抗性菌株出现频率由2007年的100%降为2008年的30.4%,2009年又回升至68.8%。吉林省的抗性菌株频率从2008年的69.34%升为2009年的96.2%。黑龙江的抗性菌株频率从2008年的73.3%升至2009年的100%。

表2 叶盘漂浮法检测222株马铃薯晚疫病菌对甲霜灵的敏感性1)
2.3 活体条件下马铃薯晚疫病菌对精甲霜灵的抗性
如表3所示,叶盘漂浮法测得采自黑龙江、辽宁、吉林、河北和内蒙古五省(区)的95株马铃薯晚疫病菌对精甲霜灵的EC50值分布在0.0029~211.1808μg/mL之间,平均值为29.72μg/mL,抗性菌株占54.5%,中间型菌株占44.5%,敏感菌株仅占1.0%,而对甲霜灵的EC50值分布在0.0284~489.0352μg/mL之间,平均值为52.37μg/mL,抗性菌株占64.2%,中间型菌株占35.8%,未发现敏感菌株,表明马铃薯晚疫病菌对精甲霜灵和甲霜灵均已普遍产生抗性。所测的95个菌株中,对精甲霜灵和甲霜灵的抗性菌株出现频率基本一致,对精甲霜灵的抗性菌株出现频率略低于对甲霜灵的抗性菌株出现频率。各地区对精甲霜灵的抗性菌株或中间型菌株分布频率差异较大,采自河北省的40株中,中间型菌株占优势(62.5%),抗性菌株仅占34.9%,而其他4省采集的55株中,抗性菌株占优势(69.1%),中间型菌株占30.9%。
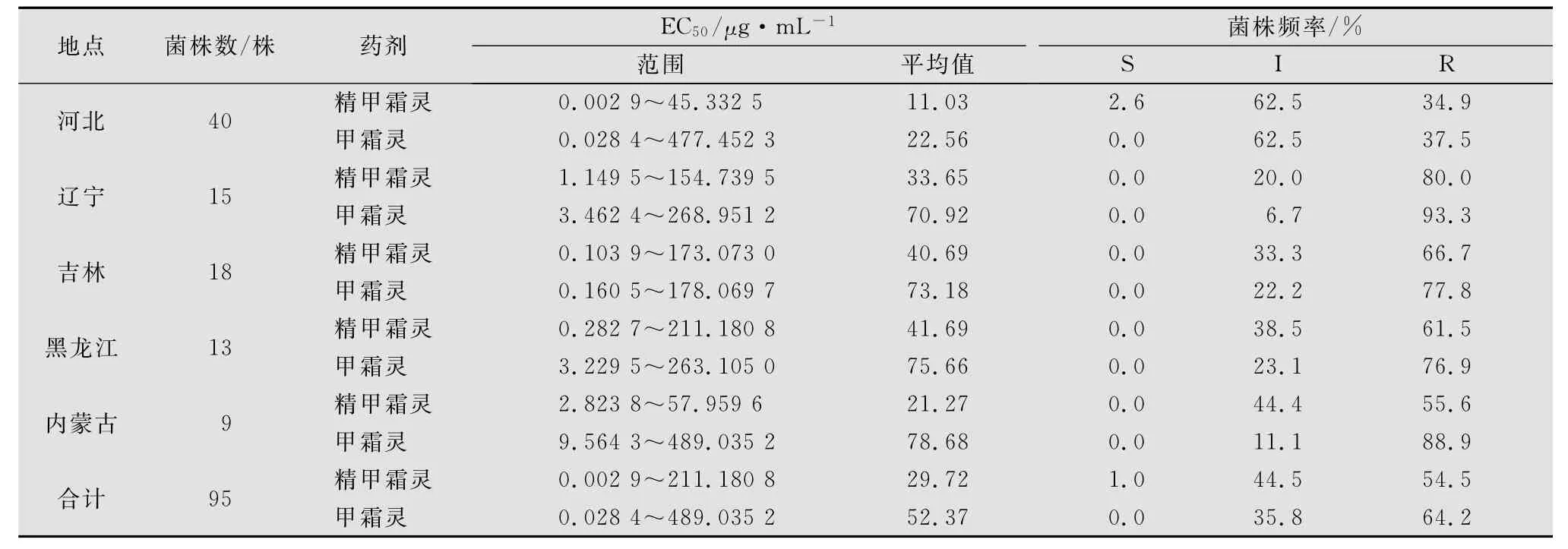
表3 叶盘漂浮法检测马铃薯晚疫病菌对精甲霜灵和甲霜灵的敏感性比较1)
3 讨论
20世纪80年代以来,甲霜灵及其有效光学异构体精甲霜灵、噁霜灵等苯基酰胺类药剂相继被普遍用于马铃薯晚疫病防治。本研究采用菌丝生长速率法和叶盘漂浮法检测发现河北、辽宁、吉林、黑龙江和内蒙古等北方五省(区)马铃薯晚疫病菌对甲霜灵的抗性菌株分布频率分别为80%和73.5%,以叶盘漂浮法检测发现对精甲霜灵的抗性菌株分布频率达54.5%,表明上述五省(区)马铃薯晚疫病菌对甲霜灵及精甲霜灵已普遍产生抗性,甲霜灵(或精甲霜灵)与代森锰锌的混剂对晚疫病的防效势必降低,但实际防效受到多大影响,能否继续使用,尚需进一步调查。国外已有研究表明,几年内停止使用苯基酰胺类药剂或启用其混剂,可使抗性频率明显下降[17],因此,在上述北方五省(区)应停止使用甲霜灵单剂,慎用甲霜灵(或精甲霜灵)混剂,叶面喷施时适当提高甲霜灵(或精甲霜灵)混剂的浓度。此外,还应注意到甲霜灵与其他苯基酰胺类药剂作用机理相同[18],它们之间存在着正交互抗性关系,应限制噁霜灵等其他苯基酰胺类药剂在对甲霜灵或精甲霜灵普遍产生抗性的地区使用,优先选用作用机理不同的药剂(烯酰吗啉、双炔酰菌胺、嘧菌酯、氟吡菌胺·霜霉威、烯酰吗啉·锰锌、霜脲氰·锰锌等)。
我国各地马铃薯晚疫病化学防治受到不同程度的重视,用药状况差异很大,晚疫病菌对甲霜灵或精甲霜灵的抗性发生状况可能存在很大差异,需要扩大抗药性检测范围,使抗药性监测常态化,根据抗药性发生状况或抗药性菌株分布情况进行药剂选用。在很少用药防治的偏僻、干旱、山地及散种地区,马铃薯晚疫病菌群体中对甲霜灵或精甲霜灵的抗性菌株的分布频率可能很低,可选用苯基酰胺类药剂及其混剂,但为了延缓抗药性产生,应提倡将该类药剂与其他不同作用机理的药剂交替或混合喷施。在种薯和规模化商品薯基地,每个生长季节施药次数可达6~10次,可能分布着很高比率的抗性菌株,因此,应尽量选用作用机理不同的药剂,减少或暂时停用苯基酰胺类杀菌剂(包括混剂),待晚疫病菌对该类药剂恢复至最初的敏感状态时再恢复使用。
本研究发现叶盘漂浮法检测的北方五省(区)95株马铃薯晚疫病菌中,54.5%的菌株为对精甲霜灵的抗性菌株,明显低于秘鲁的对精甲霜灵的抗性菌株分布频率(100%)[19]。2007-2009年采自河北省和黑龙江省的马铃薯晚疫病菌对精甲霜灵的抗性频率分别为34.9%和61.5%,明显高于沈江卫等报道的2006-2007年河北、黑龙江的抗性频率(8.9%)[14]。2007-2009年采自河北围场、崇礼等坝上地区的117株马铃薯晚疫病菌中,对甲霜灵的抗性菌株频率为59.8%,明显高于王文桥等2002年报道的1997-1999年采自河北围场县和崇礼县的217株马铃薯晚疫病菌中对甲霜灵的抗性菌株所占频率(29%)[20]。表明河北省和黑龙江省马铃薯晚疫病菌对精甲霜灵及甲霜灵的抗性菌株所占频率呈上升趋势,这是由于含甲霜灵、精甲霜灵或噁霜灵的药剂使用范围扩大、使用次数增多和用量增大造成,还是由于不同地块不同的供试菌株具有不同敏感性造成,有待研究查明。
对甲霜灵的抗性频率在不同地区及不同年份之间存在较大差异,黑龙江和吉林等地的抗性频率明显高于河北、辽宁和内蒙古的抗性频率,这种抗性频率地区差异及年度波动可能与各地区及相同地区不同年份甲霜灵及其相关药剂使用情况不同有关,也可能是取样点不同造成的,原因有待查明。有些地区抗性频率已高达100%,与国内其他报道的结果一致[7-14]。
本研究采用菌丝生长速率法和叶盘漂浮法检测的马铃薯晚疫病菌对甲霜灵的抗性菌株分布频率基本一致(分别为80%和73.5%),而检测低抗菌株和敏感菌株的分布频率时结果差别很大,前者检测的中间型菌株的分布频率为2.9%,明显低于后者检测的中间型菌株分布频率(26.5%),而前者检测的敏感菌株分布频率(17.1%)明显高于后者检测的敏感菌株分布频率(0),这种差异可能起因于划分菌株类型(抗性、中间型及敏感)的标准不同。
任何生测方法均有其适用性。防治卵菌病害的药剂有些主要是抑制病菌菌丝生长,另一些(如QoI类、接触性杀菌剂)主要表现为抑制孢子萌发;一部分药剂具有内吸传导性,另一部分药剂为非内吸剂,因此,要根据药剂的作用特点及内吸传导性确定适合的抗药性检测方法。菌丝生长速率法适合于检测各类能在离体条件下培养的植物病原菌对能明显抑制菌丝生长杀菌剂的敏感性,目前被广泛应用,国内外有人用该法检测马铃薯晚疫病菌对甲霜灵、精甲霜灵、CAA类药剂(烯酰吗啉)、霜脲氰、百菌清的敏感性[15],该法不适合检测对非内吸性药剂及非内吸性药剂与内吸性药剂混剂的敏感性。而FAO 1982年推荐的叶盘漂浮法仅适合于检测马铃薯晚疫病菌对有良好跨层传导性药剂(如甲霜灵)的敏感性[16],国内被用于检测黄瓜或葡萄霜霉病菌、马铃薯或番茄晚疫病菌对内吸性药剂的敏感性[20-21],该法不适合检测对混剂及非内吸性药剂的敏感性,因而使用范围较窄。为了扩大适用检测药剂范围,可采用叶盘法,即以药液喷雾处理叶盘,以喷雾孢子囊悬浮液接种叶盘,检测马铃薯晚疫病菌对苯基酰胺类药剂噁霜灵及其他类型药剂的敏感性[22]。也可采用叶盘 微 量 滴 定 板 法 (leaf segment microtiter plate test)[23],以喷雾施药及喷雾孢子囊接种的方法处理置于24孔微量滴定板孔中2%琼脂培养基上的叶盘,检测马铃薯晚疫病菌或葡萄霜霉病菌对所有防治卵菌病害药剂的敏感性。
[1] Bradshaw N J,Vaughan T B.The effect of phenylamide fungicides on the control of potato late blight(Phytophthora infestans)in England and Wales from 1978to 1992[J].Plant Pathology,1996,45:249-269.
[2] Dawn E F,Paul B S,Jean B R.Characterization of isolates of Phytophthora infestans from tomato and potato in North Carolina from 1993to 1995[J].Plant Disease,1998,83(7):633-638.
[3] Hermansen A,Hannukkala A,Nerstad R,et al.Variation in populations of Phytophthora infestans in Finland and Norway:mating type,metalaxyl resistance and virulence phenotype[J].Plant Pathology,2000,49(1):11-22.
[4] Reis A,Smart C D,Fry W E,et al.Characterization of isolates of Phytophthora infestans from southern and southeastern Brazil from 1998to 2000[J].Plant Disease,2003,87(8):896-900.
[5] Kim Byung-Sup,Zhang Xuan-Zhe,Chung Eun-Kyoung,et al.Sensitivity of Phytophthora infestans isolates to fungicides metalaxyl and ethaboxam in Korea[J].Plant Pathology,2003,19(3):143-147.
[6] Gisi U,Walder F,Resheat-Eini Z,et al.Changes of genotype,sensitivity and aggressiveness in Phytophthora infestans isolates collected in European countries in 1997,2006and 2007[J].Phytopathology,2011,159(4):223-232.
[7] 朱小琼,车兴壁,国立耘,等.六省市致病疫霉交配型及其对几种杀菌剂的敏感性[J].植物保护,2004,30(4):20-23.
[8] 陈庆河,翁启勇,谢世勇,等.福建省致病疫霉交配型分布及对甲霜灵的抗药性[J].植物保护学报,2004,31(2):151-156.
[9] 赵志坚,曹继芬,李灿辉,等.云南致病疫霉交配型、甲霜灵敏感性、mtDNA单倍型及其群体演替研究[J].中国农业科学,2007,40(4):727-734.
[10]姚国胜,吕国朝,杨志辉,等.马铃薯晚疫病菌对甲霜灵敏感性及交配型测定[J].华北农学报,2007,22(S1):260-262.
[11]毕朝位,车兴壁,马金成,等.致病疫霉对甲霜灵抗性及抗性水平测定[J].西南农业大学学报,2002,4(4):307-309.
[12]袁善奎,赵志华,刘西莉,等.马铃薯晚疫病菌对甲霜灵和霜脲氰的敏感性检测[J].农药学学报,2005,7(3):237-241.
[13]陈良华,杨志辉,丁明亚,等.河北、吉林两省马铃薯晚疫病菌对3种杀菌剂的敏感性测定[J].中国农学通报,2009,25(13):171-174.
[14]沈江卫,杨志辉,朱杰华,等.马铃薯晚疫病菌对嘧菌酯和精甲霜灵的敏感性测定[J].农药,2008,47(6):457-461.
[15]Oyarzun P J,Pozo A,Ordonez M E,et al.Host specificity of Phytophthora infestans on tomato and potato in Ecuador[J].Phytopathology,1998,88(3):265-271.
[16]Schwinn F,Sozzi D.Recommended methods for the detection and measurement of resistance of plant pathogens to fungicides[J].FAO Plant Protection Bulletin,1982,30(2):39-42
[17]Dowley L J,Griffin D,O’sullivan E.Two decades of monitoring irish populations of Phytophthora infestans for phenylamide resistance[J].Potato Research,2002,45(1):79-84.
[18]Davidse L C.Phenylamide fungicides:biochemical action and resistance[M]∥ Lyr H,eds.Modern Selective Fungicides(2nd ed.).Jena:Gustav Fisher,1995:347-354.
[19]Perez W,Lara J,Forbes G A.Resistance to metalaxyl-M and cymoxanil in a dominant clonal lineage of Phytophthora infestans in Huánuco,Peru,an area of continuous potato production[J].European Journal of Plant Pathology,2009,125(1):87-95.
[20]王文桥,马志强,张小风,等.致病疫霉抗药性、交配型和适合度[J].植物病理学报,2002,32(3):278-283.
[21]王文桥,刘国容,严乐恩,等,黄瓜和葡萄霜霉病菌的抗药性监测[J].南京农业大学学报,1996,19(S1):127-131.
[22]Schwinn F,Sozzi D.Determination of the sensitivity of Phytophthora infestans to phenylamides:a leaf disc method[J].EPPO Bulletin,1992,22:306-308.
[23]Edel D,Sierotzki H.Leaf segment microtiter plate test.http:∥www.frac.info/frac/Monitoring_Methods/anhang/PHYTIN_in_vivo_method_Syngenta_2007_V1.pdf.
