红毛五加提取物诱导卵巢癌细胞系OVCAR3凋亡
2012-09-03欧阳资章龙启才
欧阳资章 龙启才

[摘要] 目的 研究红毛五加提取物的抗肿瘤活性。 方法 分别采用MTT法、形态学、流式细胞术方法检测纯氯仿洗脱部分对肿瘤细胞OVCAR3的生长抑制及促凋亡。 结果 MTT法可见氯仿洗脱部分对体外培养的卵巢上皮癌细胞OVCAR3的生长有抑制作用,高、低剂量组抑制率分别为20.6%、11.4%;形态学以及流式细胞术都可见氯仿洗脱部分可以促进OVCAR3凋亡。 结论 红毛五加纯氯仿洗脱部分对肿瘤细胞株OVCAR3细胞有促凋亡的作用。
[关键词] 红毛五加;凋亡;OVCAR3;卵巢癌
[中图分类号] R-33[文献标识码] A[文章编号] 1674-4721(2012)07(c)-0010-03
Apoptosis of ovarian cancer cell lines OVCAR-3 induced by the extract Acanthopanax giraldii Harms
OUYANG Zizhang1 LONG Qicai2
1. The People′s Hospital of Qingyuan City in Guangdong Province, Qingyuan 511518, China; 2. College of Pharmacy, Sun Yat-sun University, Guangdong Province, Guangzhou 510006, China
[Abstract] Objective To investigate the anti-tumor activity of extract from Acanthopanax giraldii Harms. Methods Growth inhibition and promote apoptosis of cancer cell lines OVCAR3 by the chloroform eluting parts were measured by MTT method, morphological method and flow cytometry methods respectively. Results The chloroform eluting parts had the inhibitory action on the growth of ovarian cancer cell lines OVCAR-3 cultured in vitro. Inhibitory ratios of high and low dose group were 20.6% and 11.4% respectively. The chloroform eluting parts could inhance the apoptosis of OVCAR3 in morphological method and flow cytometry methods. Conclusion The chloroform eluting parts from Acanthopanax giraldii Harms has the effect to promote the apoptosis of cancer cell lines OVCAR3.
[Key words] Acanthopanax giraldii Harms; Apoptosis; OVCAR3; Ovarian cancer
紅毛五加为五加科植物,以茎皮入药,性温、味辛、入肝肾经。具有祛风除湿,通关节、强筋骨之功效,主治风寒湿痹、足膝无力等症[1],现代药理试验证明红毛五加多糖对体外培养胃癌细胞抑制作用[2],能通过抑制原癌基因,激活抑癌基因和细胞因子,从而诱导胃癌细胞凋亡[3],在抗肿瘤的同时对健康人细胞无影响[4]。红毛五加茎皮挥发油成分对体外培养人白血病粒细胞有明显抑制癌细胞生长效应,抑制率达90%[5]。COX-2在肿瘤的发生发展过程中有重要作用,COX-2 通过旁分泌和自分泌直接地或通过上调芳香族酶的活性间接地促进肿瘤细胞的生长[6-8]。在前期的实验中,笔者提取分离的红毛五加正丁醇萃取部分经氯仿洗脱部分能通过抑制COX-2,从而抑制炎症因子PGE2产生,具有抑制炎症反应的作用。在此文中,笔者以人卵巢上皮癌细胞 OVCAR3为模型细胞研究此部分提取分离物是否也具有抑制肿瘤细胞生长的作用。
1 材料与方法
1.1 实验材料
红毛五加由中山大学药学院杨得坡教授鉴定为红毛五加(Acanthopanax giraldii Harms.)的茎皮;红毛五加提取物为红毛五加正丁醇萃取部分经氯仿洗脱部分;人卵巢上皮癌细胞OVCAR3(中山大学实验动物中心细胞库);DMEM培养基(美国Gibco公司,批号:1380549);胎牛血清(杭州四季青公司,批号:080919);Hoechst33258(美国Sigma公司,批号为:CE294011);碘化嘧啶PI(美国Sigma公司,批号:247208120);MTT(碧云天生物技术研究所,批号:080721);塞来昔布(美国辉瑞公司,批号:639T);实验中所用甲醇、氯仿、石油醚、乙酸乙酯、乙醇等试剂均为分析纯;CO2培养箱(德国 HERAEUS公司);超净工作台(HEAL FORCE公司);DMI4000B倒置显微镜(德国Leica公司);Thermo 多功能酶标仪(美国 Thermo Fisher Scientific 公司);流式细胞仪(美国 BD FACS Calibur)。
1.2 试验方法
1.2.1 MTT法检测纯氯仿洗脱组分对OVCAR3细胞生长抑制作用取对数生长期OVCAR3细胞,以每孔103个细胞接种于96孔培养板中,每孔体积为200 μL,将培养板放入CO2孵箱,在37℃,5%CO2以及饱和条件下,培养24 h,吸弃培养液,每孔加入180 μL培养基,随即按照试验分组加入20μL试验药物,对照组加入20 μL培养基,使药物达到相应的药物浓度,孵育48 h,每孔加入MTT溶液(5 mg/L)20 μL,37℃继续孵育4 h,小心吸弃孔内培养上清液,PBS洗涤3次,每孔加入150 mL DMSO,振荡10 min,使甲臜充分溶解,选择490 nm波长,在酶标仪上测定各孔光吸收值,记录结果。
1.2.2 形态学检测纯氯仿洗脱部分对OVCAR3细胞促凋亡作用取洁净的盖玻片于70%乙醇浸泡5 min,无菌超净台内吹干,将盖玻片置于6孔板内,接种细胞10-6,培养过夜,吸弃培养液,加入新鲜培养基0.9 mL,加入药物0.1 mL,使药物达到试验浓度,正常对照组加入培养基,继续培养48 h,吸弃培养液,加入0.5 mL固定液,固定15 min,去固定液,用PBS洗涤2次,每次3 min,吸尽液体,加入0.5 mL Hoechst33258染色液,染色5 min,荧光显微镜照相。
1.2.3 流式细胞仪检测纯氯仿洗脱部分对OVCAR3细胞周期阻滞作用取对数生长期细胞,用0.25%胰蛋白酶消化用含10%胎牛血清的DMEM培养液配成细胞悬液,以每孔106个细胞接种于6孔培养板中,每孔体积为1 mL,培养过夜,吸弃培养液,加入新鲜培养基0.9 mL,同时加入药物0.1 mL,使药物达到试验浓度,正常对照组加入培养基,继续培养48 h,用0.25%胰蛋白酶消化细胞,调整待测细胞的密度为1×106个/mL,取1 mL细胞,1 000转/min,4℃离心10 min,弃除上清液,加入1 mL冷的PBS,轻轻振摇使细胞悬浮,1 000 rpm 4℃离心10 min弃去上清液,重复步骤3,4两次,将细胞重悬浮于200 μL结合缓冲液,加入5 μL的PI,轻轻混匀,避光室温反应15 min,加入300 μL结合缓冲液,立即用流式细胞仪检测。
1.3 统计分析
数据以均数±标准差(x±s)表示,抑制率以百分率表示,采用SPSS 17.0 for Windows软件对数据进行两独立样本资料t检验(抑制率以卡方检验),P < 0.05为差异有统计学意义。
2 结果
2.1 纯氯仿洗脱部分对癌细胞生长的抑制作用
正常对照组细胞24 h培养后的OD值为0.543±0.013,塞来昔布作用后的OD值为0.504±0.018,与正常对照组比较,差异有统计学意义(P < 0.05),氯仿洗脱部分40 mg/L作用后的OD值为0.511±0.010,10 mg/L作用后的OD值为0.528±0.010,氯仿洗脱部分两个剂量组的OD值与正常对照组比较,差异有统计学意义(P < 0.05),高、低剂量组的抑制率分别为20.6%、11.4%,见表1。
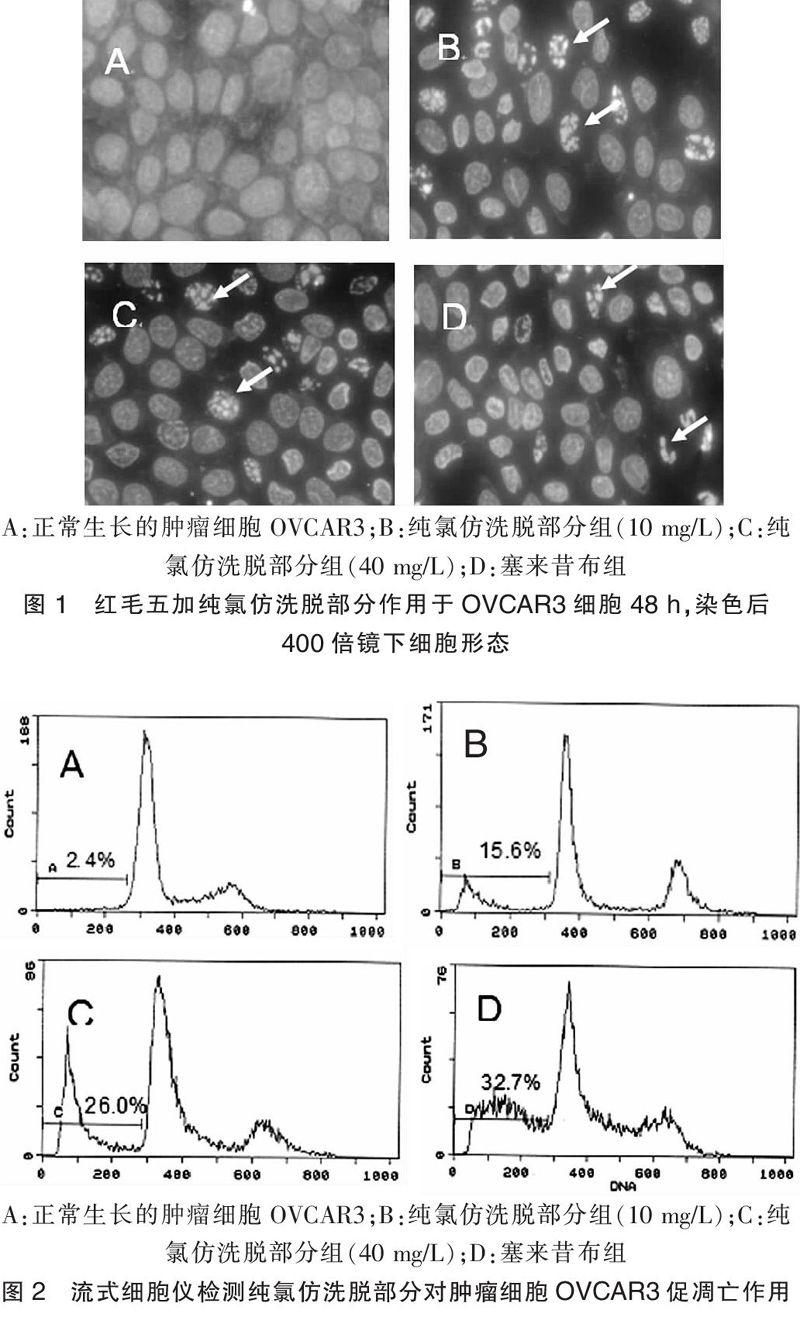
2.2 形态学结果
正常细胞多角型,核为椭圆型,核大,核质均匀;细胞核浓缩,核形状有长棒状、环形、不规则形,且荧光增强为凋亡细胞。如图1所示,正常对照组未见凋亡细胞,而塞来昔布组可见典型的凋亡细胞,且凋亡细胞数量较多。试验药物的高,低剂量组同样可见典型的凋亡细胞。
2.3 流式结果
见图2。如图2所示,纯氯仿洗脱部分高、低、以及阳性药物剂量组都可以促进细胞凋亡,凋亡率分别为26.0%、15.0%、32.7%,与形态学结果基本一致。
3 讨论
红毛五加为五加科植物,来源广泛,具有多种作用,如抗炎、抗肿瘤、调节人体免疫力等作用,以前的研究表明红毛五加多糖具有抗肿瘤作用,但未见红毛五加其他成分是否具有抗肿瘤作用研究。在前期的研究中,笔者对红毛五加抗炎成分进行了初步筛选,并研究了其抗炎的作用机制与抑制COX-2有关。COX-2高表达与肿瘤有关,卵巢恶性肿瘤的发病率居女性生殖器官恶性肿瘤的前几位。研究发现,COX-2 在卵巢肿瘤细胞中高表达,而在正常的卵巢上皮中不表达[9-11],COX-2 的表达与卵巢癌的级别呈正相关[12]。既然COX-2与肿瘤的发生和发展密切相关,通过调节COX-2 来防治肿瘤已成为当今肿瘤学研究的热点之一。NSAIDs有可能通过抑制COX-2合成而抑制肿瘤血管生成起到抑制肿瘤的效果[13-15]。既然红毛五加中的乙醇提取物中纯氯仿洗脱液中含有抑制COX-2活性的成分,所以笔者设计了实验探讨纯氯仿洗脱部分是否对卵巢肿瘤细胞的生长有抑制作用。笔者采用体外实验的方法,分别用MTT法检测了红毛五加抗炎有效成分对OVCAR3细胞的毒性作用促凋亡作用,并以Hoechst染色法及流式细胞术测定法测定了红毛五加中的乙醇提取物中纯氯仿洗脱部分对OVCAR3细胞的促凋亡作用,结果初步证明了红毛五加的抗肿瘤作用。考虑到红毛五加有效成分有抑制COX-2活性的作用,可以推测其促肿瘤细胞OVCAR3凋亡是通过抑制COX而实現的。当然本试验只是初步的抗肿瘤试验,而且是体外试验,至于在体是否有抗肿瘤作用还需进一步的动物试验以验证。
总之,本实验证明红毛五加抗炎有效成分,即红毛五加中的乙醇提取物中纯氯仿洗脱部分对OVCAR3细胞有促凋亡的作用。
[参考文献]
[1]江苏新医学院. 中药大辞典(上册)[M]. 上海:上海科技出版社,1986:1018.
[2]吕晓英,李田,孙菊华.红毛五加多糖诱导体外人胃癌细胞凋亡的研究[J].实用癌症杂志,2001,16(1):6-8.
[3]吕晓英,马东瑞,李田,等.红毛五加多糖对体外人胃癌细胞基因及细胞因子表达的影响[J].实用肿瘤杂志,2001,16(1):45-46.
[4]吕晓英,蒋刚,苏勉减. 红毛五加多糖对体外人胃癌细胞的抑制作用特点及机制[J]. 肿瘤防治研究,2001,28(4):256-258.
[5]王满霞,张莅峡,刘红,等. 红毛五加茎皮挥发油成分对体外培养人白血病粒细胞生物学效应的研究[J]. 中国中药杂志,1994,19(9):558-560.
[6]Dohadwala M,Luo J,Zhu L,et al. Non-small cell lung cancer cyclooxygenase-2-dependent invasion is mediated by CD44[J].J Biol Chem,2001,276(24):20809-20812.
[7]Leahy KM,Ornberg RL,Wang Y,et al. Cyclooxygenase-2 inhibition by celecoxib reduces proliferation and induces apoptosis in angiogenic endothelial cells in vivo[J]. Cancer Res,2002,62(3):625-631.
[8]Costa C,Soares R,Reis-Filho JS,et al. Cyclo-oxygenase 2 expression is associated with angiogenesis and lymph node metastasis in human breast cancer[J].J Clin Pathol,2002,55(6):429-434.
[9]Shigemasa K,Tian X,Gu L,et al. Expression of cyclooxygenase-2 and its relationship to p53 accumulation in ovarian adenocarcinomas[J]. Int J Oncol,2003,22(1):99-105.
[10]Landen CN Jr,Mathur SP,Richardson MS,et al. Expression of cyclooxygenase-2 in cervical,endometrial,and ovarian malignancies[J]. Am J Obstet Gynecol,2003,188(5):1174-1176.
[11]Li S,Miner K,Fannin R,et al. Cyclooxygenase-1 and 2 in normal and malignant human ovarian epithelium[J]. Gynecol Oncol,2004,92(2):622-627.
[12]Denkert C,Kobel M,Pest S,et al. Expression of cyclooxygenase 2 is an independent prognostic factor in human ovarian carcinoma[J]. Am J Pathol,2002,160(3):893-903.
[13]Creminon C,Habib A,Maclouf J,et al. Differential measurement of constitutive (COX-1) and inducible (COX-2) cyclooxygenase expression in human umbilical vein endothelial cells using specific immunometric enzyme immunoassays[J]. Biochim Biophys Acta,1995,1254(3):341-348.
[14]Marx J. Cancer research Anti-inflammatories inhibit cancer growth--but how[J]. Science,2001,291(5504):581-582.
[15]Mertz PM,DeWitt DL,Stetler-Stevenson WG,et al. Interleukin 10 suppression of monocyte prostaglandin H synthase-2. Mechanism of inhibition of prostaglandin-dependent matrix metalloproteinase production[J]. J Biol Chem,1994,269(33):21322-21329.
(收稿日期:2012-06-05本文編辑:林利利)
