高糖诱导肾小球系膜细胞表达TNF-α的机制探讨*
2012-08-30黄国良
张 怡,黄国良
(福建医科大学附属协和医院内分泌研究所,福州 350001)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病常见和严重的慢性并发症之一,近年来炎症因子及炎症反应成为了DN的新视点。肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)是糖尿病肾病时的主要相关炎症因子,已有研究证实糖尿病肾病时血清中TNF-α表达明显升高,且与C反应蛋白(C-reactive protein,CRP)水平及DN的程度一致[1]。TNF-α通过与受体的结合,激活许多信号传导通路,导致多种转录因子的表达,有证据证明TNF-α参与DN病理生理机制,调控糖尿病肾损伤不同效应。我们可通过阻断其产生的通路来预防DN的发生,但目前对于其产生的机制尚未有研究报道。本研究在体外模拟糖尿病高血糖环境,就高糖环境下肾小球系膜细胞表达TNF-α的机制方面进行初步的研究和探讨。
1 材料与方法
1.1 材料和试剂
人肾小球系膜细胞株为福建医科大学附属协和医院内分泌研究所保藏,常规细胞培养。p38MAPK特异性抑制剂SB203580购自sigma公司,NF-κ B特异性抑制剂 PDTC购自碧云天生物技术研究所,总RNA提取试剂Trizol购自加拿大Bio Basic Inc公司,RIPA裂解液、细胞核蛋白与细胞浆蛋白抽提试剂盒均购自碧云天生物技术研究所,RT-PCR试剂盒购自Fermentas公司,磷酸化p38MAPK蛋白一抗购自Cell signaling technology,NF-κ Bp65蛋白一抗购自碧云天生物技术研究所,PCR扩增仪为美国ABI公司产品,凝胶成像分析系统为Tanon Gis产品,垂直电泳系统和电转系统为Bio-Rad公司产品。
1.2 肾小球系膜细胞培养及处理
肾小球系膜细胞以105cells/well密度接种于6孔培养板中,用含10%胎牛血清的1640培养液进行培养,37℃、5%CO2温箱孵育至亚融合状态后更换为无血清培养液培养24 h使之同步化,然后根据实验分组要求换用加入各种处理因素的1%胎牛血清培养液继续培养。实验分组为低糖对照组(5.6 mmol/L);高糖组(20 mmol/L);高糖(20 mmol/L)+SB203580(10 μ mol/L)组 ;高 糖(20 mmol/L)+PDTC(10 μ mol/L)组 。SB203580或PDTC预处理系膜细胞30 min后,再加入高糖溶剂使培养液葡萄糖终浓度达到20 mmol/L。作用48 h后分别测定系膜细胞TNF-αmRNA、磷酸化p38MAPK蛋白、NF-κ B p65蛋白表达。
1.3 RT-PCR方法检测系膜细胞TNF-αmRNA表达
细胞用PBS迅速冲洗2次,提取细胞总RNA,用紫外分光光度计测定其浓度和纯度,计算样品总RNA浓度。取总RNA 2 μ g,进行逆转录反应。TNF-α引物(上游 5'-CAGAGGGAAGAGTTCCCCAG-3',下游5'-CCTTGGTCTGGTAGGAGACG-3')是根据Li等的序列设计[2],由 Invitrogen公司合成的,可扩增出长度为325 bp的TNF-αcDNA片段;β-actin引物(上游5'-GGCATGGGTCAGAAGGATTCC-3',下游5'-ATGTCACGCACGATTTCCCGC-3')为福建医科大学协和临床医学院血液研究所馈赠,可扩增出长度为500 bp的β-actin cDNA片段。PCR反应条件:TNF-α:94℃变性40 s,64℃退火40 s,72℃延伸40 s;β-actin:94℃变性30 s,58℃退火30s,72℃延伸30 s,共进行35个循环,首次循环前先在94℃预变性5 min,最后一轮循环后在72℃终末延伸7 min。PCR产物于含1%Goldview核酸染料的1.5%琼脂糖凝胶电泳,以DNA Marker(600 bp)作为标准分子量标记,电泳后于紫外透射仪观察并拍照,应用凝胶图像分析系统软件对目的电泳条带进行分析,以相应的内参电泳条带作为参照,结果以两者之积分吸光度的比值表示。每组样本数是3例。
1.4 Western blot法检测系膜细胞磷酸化p38MAPK蛋白及NF-κ B p65蛋白表达
细胞用PBS迅速冲洗2次,加入RIPA裂解液在冰上孵育30 min,4℃、14 000 r/min离心 15 min提取总蛋白;按照试剂盒说明书操作提取细胞核蛋白与细胞浆蛋白。按照BCA试剂盒说明书操作测定各组蛋白浓度,以Western blot法分别检测细胞内磷酸化p38MAPK蛋白水平、细胞核与细胞浆NF-κ B p65蛋白水平。经图像分析系统对目的条带及内参条带进行扫描和灰度分析,结果以两者灰度比值表示。每组样本数是3例。
1.5 统计学处理
2 结果
2.1 SB203580、PDTC对高糖培养系膜细胞 TNF-αmRNA表达的影响
与低糖对照组相比,高糖组系膜细胞TNF-αmRNA表达明显增加(P<0.01)。而与高糖组相比,SB203580组、PDTC组系膜细胞TNF-αmRNA表达均明显降低(P<0.01)。表明高糖可诱导系膜细胞内TNF-α在基因水平的表达,抑制系膜细胞p38MAPK、NF-κ B活性可明显抑制高糖诱导系膜细胞内TNF-α的表达(表1)。
Tab.1 Changes of TNF-αmRNA expression in glomerular mesangial cells(±s,n=3)

Tab.1 Changes of TNF-αmRNA expression in glomerular mesangial cells(±s,n=3)
HG:High glucose group;SB203580:p38MAPK specific inhibitor;PDTC:NF-κ B specific inhibitor;TNF-α:Tumor necrosis factor-α**P<0.01 vs control group;##P<0.01 vs HG group
Control 0.3772±0.0332 HG 0.8890±0.0228**SB203580 0.4963±0.0284##PDTC 0.4734±0.0292##
2.2 SB203580对高糖培养系膜细胞磷酸化p38MAPK表达的影响
与低糖对照组相比,高糖组系膜细胞磷酸化p38MAPK蛋白表达增加(P<0.01)。与高糖组相比,SB203580组系膜细胞磷酸化p38MAPK蛋白表达减少(P<0.01,图1)。表明高糖可诱导系膜细胞内p38MAPK蛋白活化,SB203580明显抑制了高糖诱导系膜细胞内p38MAPK蛋白的活化(图2)。

Fig.1 Expression of phosphorylation p38MAPK in glomerular mesangial cells stimulated by SB203580 and high glucose
2.3 SB203580对高糖培养系膜细胞NF-κ B p65蛋白表达的影响
与低糖对照组相比,高糖组系膜细胞NF-κ B p65蛋白在胞核内表达增加(P<0.01),胞浆内表达减少(P<0.01)。而与高糖组相比,SB203580组系膜细胞NF-κ B p65蛋白在胞核内表达减少(P<0.01),胞浆内表达增加(P<0.01,图3)。表明高糖可诱导系膜细胞内NF-κ B蛋白转核活化,SB203580可明显抑制高糖诱导系膜细胞内NF-κ B蛋白的活化(图4)。
3 讨论
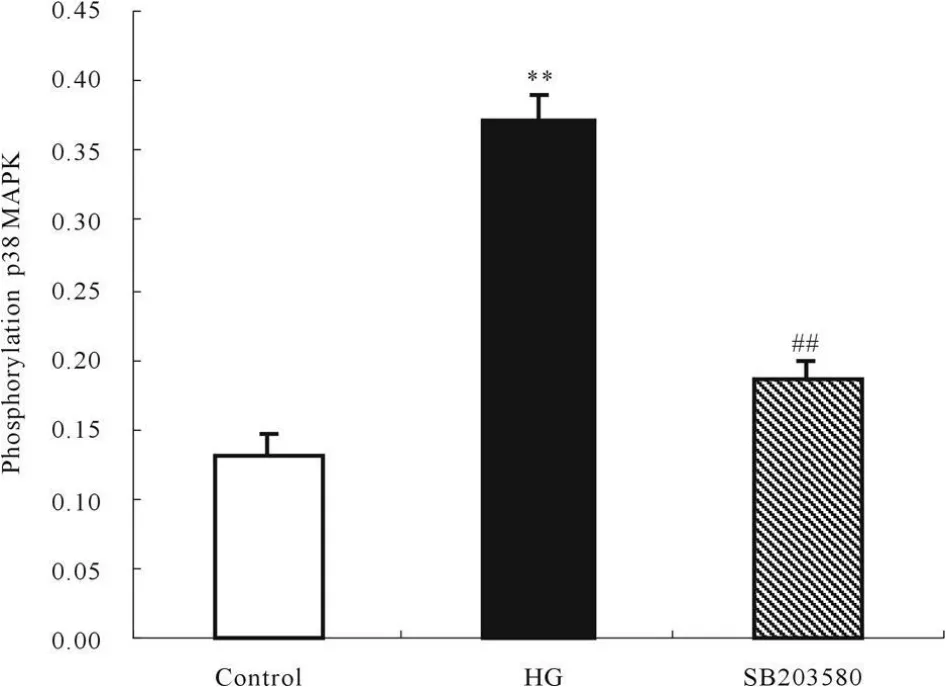
Fig.2 Effect of SB203580 on phosphorylation p38MAPK expression in glomerular mesangial cells(±s,n=3)

Fig.3 Expression of NF-κ B p65 in glomerular mesangial cells stimulated by SB203580 and high glucose

Fig.4 Effect of SB203580 on NF-κ B p65 expression inglomerular mesangial cells(±s,n=3)
近年来的研究表明慢性低度炎症可能诱导了2型糖尿病患者的肾脏病变,而前炎症因子是导致慢性低度炎症的始发及促进因素之一,TNF-α是目前研究较为广泛的前炎症因子。TNF-α参与多种生理和免疫过程,具有抗肿瘤、促进细胞生长、诱导细胞分化凋亡、影响糖脂代谢、诱导多种细胞因子产生等生物功能。Navarro等研究发现,DN患者与糖尿病无肾病改变患者相比血浆及尿液中TNF-α的表达明显升高,且与DN病理分期成正相关[3]。与此研究一致,本实验结果显示,高糖培养肾小球系膜细胞内TNF-αmRNA表达升高。Bai等的研究发现,p38MAPK抑制剂及NF-κ B抑制剂均可抑制高半胱氨酸诱导的人脐静脉内皮细胞表达TNF-α[4]。故我们猜测,p38MAPK抑制剂及NF-κ B抑制剂亦可抑制高糖诱导系膜细胞表达TNF-α。
p38MAPK是MAPK家族的一员,是调节许多细胞功能的一个重要激活信号分子,磷酸化 p38MAPK为其活性形式。本研究发现,高糖可诱导肾小球系膜细胞内p38MAPK活化,而p38MAPK特异性抑制剂SB203580可明显抑制TNF-αmRNA表达,表明p38MAPK参与介导高糖诱导TNF-α表达。
NF-κ B是由Rel蛋白家族的成员以同源或异源二聚体的形式组成的一组转录因子,参与细胞内的信号传递,调控多种基因的表达。Navarro等研究发现,链脲霉素诱导糖尿病肾病大鼠的肾脏组织中NF-κ B亚单位p50及p65明显升高,与血糖、尿白蛋白排泄率(urinary albumin excretion rates,UAER)及血肌酐升高呈明显正相关[5]。我们的研究也发现,高糖可诱导肾小球系膜细胞内NF-κ B蛋白转核活化,NF-κ B特异性抑制剂PDTC可明显抑制TNF-αmRNA表达。同时本研究显示,SB203580可明显抑制高糖诱导肾小球系膜细胞内NF-κ B蛋白转核活化,表明p38MAPK与NF-κ B存在相互作用,二者共同参与介导高糖诱导系膜细胞内TNF-α表达,且存在交叉作用。
本研究初步阐明了高糖诱导肾小球系膜细胞表达TNF-α的相关机制,为糖尿病肾病的治疗提供全新的理论基础,同时也为临床提供新的更为有效的诊治手段。
[1]马直勉,李海永.血清C-反应蛋白、TNF-α、IL-6与 2型糖尿病肾病的关系[J].国际免疫学杂志,2007,30(6):367-369.
[2]Li H,Li X W,Duan L,et al.Inhibition of lovastatin on proliferation and expression of proinflammatory cytokines in cultured human glomerular mesangial cells[J].Chinese Medical Journal,2003,116(9):1366-1369.
[3]Navarro J F,Mora C,GomezM,et al.Influence of renalinvolvement on peripheral blood mononuclear cell expression behaviour of tumour necrosis factor-α and interleukin-6 in type 2 diabetic patients[J].NephrolDialTransplant,2008,23(3):919-926.
[4]Bai Y P,Liu Y H,Chen J,et al.Rosiglitazone attenuates NF-kappaB-dependent ICAM-1 and TNF-alpha production caused by homocysteineviainhibiting ERK1/2/p38MAPK activation[J].Biochem Biophys Res Commun,2007,360(1):20-26.
[5]Navarro J F,Mora C.Diabetes,inflammation,proinflammatory cytokines,and diabetic nephropathy[J].Scientific World J,2006,6:908-917.
