霍乱弧菌O139胶体金免疫层析快速检测法的建立
2012-08-21王玉金杨书豪庞向宇孙晨阳李珊珊
王玉金,杨书豪,刘 丽,庞向宇,孙晨阳,李珊珊
霍乱(Cholera)是由霍乱弧菌(Vibriocholerae)所引起的烈性肠道传染病,它和鼠疫、黄热病一起,被世界卫生组织(WHO)规定为必须实施国际卫生检疫的三种传染病之一,在中国属法定管理的两种“甲类”传染病之一。霍乱是一种重要的急性肠道传染病,以发病急、传播快、波及范围广、能引起大流行为特征。霍乱病原菌包括O1群和O139群。人类历史上已有的七次霍乱大流行,均由O1群霍乱弧菌引起。自1992年起,印度和孟加拉国先后发生O139霍乱,并造成广泛传播,我国也有O139霍乱的爆发或输入性病例[1]。尽早快速诊断该病原体,对于迅速控制传染源、减少病死率具有重要意义。常规的分离技术包括增菌、培养、生化和血清学鉴定,需要时间较长,不适合口岸现场检测。采用霍乱弧菌O139群的特异性单克隆抗体开发的胶体金试纸条,可快速、简便、准确地检测霍乱弧菌[2]。本研究应用双抗体夹心法及胶体金免疫层析法制备霍乱弧菌O139群胶体金免疫层析试纸条,简便快速,并与常规培养法结果进行对比分析,其特异性和灵敏度均较好。
1 材料与方法
1.1 材料 所有菌株均由中国医学细菌保藏管理中心和中国疾病预防控制中心传染病预防控制所卫生部医学分子细菌学重点实验室提供;抗霍乱弧菌O139群单抗 由本所细胞室提供,3H2用于标记,2G8用于包被;兔抗鼠IgG由本所细胞室制备,血清双向琼脂扩散效价≥1∶64;氯金酸(HAuCl4·4H2O)Sigma公司产品;硝酸纤维素微孔滤膜(NC)美国Millipore公司产品。
1.2 胶体金标记物的制备
1.2.1 胶体金溶液的制备 参照文献[3]进行。取0.01%HAuCl4水溶液100 m L,加入10 g/L柠檬酸三钠水溶液2 m L,加热煮沸15~30 min,直至颜色变红,即为胶体金溶液。
1.2.2 胶体金标记的最佳p H测定 取10μg/m L单抗3H21.0 m L,分别加入1.0 m L p H 值为6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2的 胶 体 金溶液中,混匀,室温下放置5 min;再分别加入10%NaCl溶液0.1 m L,混匀,静置2 h后观察结果,确定金标记最佳p H值。
1.2.3 最适标记蛋白浓度的测定 取10支试管,各加入1.0 m L胶体金溶液,将单抗3H2分别稀释成13μg/m L、12μg/m L、11μg/m L、10μg/m L、9 μg/m L、8μg/m L、7μg/m L、6μg/m L、5μg/m L,各取1.0 m L按顺序加入上述胶体金溶液中。对照管加入1.0 m L稀释液(不含蛋白质),混匀,室温下放置5 min;再分别加入10%NaCl溶液0.1 m L,混匀,静置2h后观察结果,确定最适标记蛋白浓度。
1.2.4 单克隆抗体3H2胶体金标记物的制备 参照文献[4]。取胶体金100 m L,用0.1 mol/L K2CO3调p H值,在搅拌下快速加入单克隆抗体3H2,继续搅拌30 min后,加入BSA至10 g/L;再继续搅拌15 min,3 000 r/min离心5 min,弃沉淀;上清液再12 000 r/min离心15 min,小心吸弃上清液,沉淀物以p H7.0浓度为0.01 mol/L PBS-2%BSA 溶液溶解,即为胶体金标记溶液,将玻璃纤维浸泡于胶体金标记溶液中,待完全浸泡均匀后,取出干燥,即成单克隆抗体3 H2胶体金标记物。
1.3 包被膜的制备
1.3.1 包被抗体浓度的确定 纯化的单抗2G8和兔抗鼠IgG分别用0.5、1、2、3、4、5 mg/m L的浓度用自动点膜机包被制备成包被膜,与同一批胶体金标记物装配成试纸条,观察结果,确定包被抗体的最佳浓度。
1.3.2 单克隆抗体2G8及多抗兔抗鼠IgG的包被
参照文献[5]。分别将两种抗体装入两支洁净专用扫描笔中;设定测试带(2G8)和质控带(兔抗鼠IgG)宽度均为0.1 cm,二者间距为1 cm,位于NC膜中部;将程序输入自动点膜机,进入工作状态;按启动键,开始包被,做标记符号。将包被有抗体的NC膜置p H7.0浓度为0.01 mol/L PBS-1%BSA 封闭液中37℃60 min,干燥,即为包被膜。
1.4 试纸条组装 取洁净PVC板,将包被膜用双面胶固着于PVC板固定位置上;将棉浆板连接在NC膜上端,玻璃纤维连接包被膜下端;胶体金标记物附着在玻璃纤维下,与包被膜衔接;色膜覆盖于棉浆板之上;MARK标志膜覆盖于玻璃纤维之上;均匀、轻微滚动式推进,加强粘和力;用切割机将贴好的板切割成所需宽度的条,即为成品试纸条。
1.5 测试方法 将霍乱弧菌O139群胶体金免疫层析试纸条带MARK标志线一端插入装有样品的容器中,样品通过玻璃纤维的层析作用上行与胶体金标记物(Au-3 H2)结合形成抗原抗体(Au-3 H2-O139)复合物,再移行至包被膜上抗O139单抗(2G8)带区,即和2G8结合,构成(Au-3 H2-O139-2G8)双抗体夹心复合物,呈现出目测可见的红色条带,全部试验过程仅需5~10min。测定结果判断:阴性:试纸条测试带不显色仅质控带显色,出现1条红线;阳性:试纸条测试带和质控带均显色,出现2条红线;若试纸条质控带无红线出现,则测试无效。1.6 胶体金免疫层析试纸条的特异性检测 用试纸条对霍乱弧菌O139群样品、霍乱弧菌O1群、霍乱弧菌O22群、霍乱弧菌O155群、大肠杆菌、副溶血弧菌、麦氏弧菌、伤寒及各型副伤寒杆菌、粪链球菌、河弧菌、耶尔森氏菌、痢疾杆菌、变形杆菌、出血性大肠杆菌O157∶H7、金黄色葡萄球菌进行检测试验,试验重复3次。
1.7 胶体金免疫层析试纸条的敏感性检测 将霍乱弧菌O139群菌悬液系列稀释到109cfu/m L数量级,再以样品处理液10倍系列稀释到1×108、1×107、1×106、1×105、1×104、1×103cfu/m L。分别用胶体金免疫层析试纸条检测,观察结果。
1.8 胶体金免疫层析试纸条的稳定性 将试纸条置2℃~8℃干燥保存,每月定期抽检至第13个月,与新制备的试纸条平行检测阳性和阴性,比较两者的检测结果。
1.9 临床考核 用霍乱弧菌O139群胶体金免疫层析试纸条,与细菌培养法对比检测临床标本184例,以考核检测试纸条法与细菌培养法的符合率。
2 结 果
2.1 胶体金标记的最佳p H测定 胶体金溶液p H由6.3至6.8,颜色有蓝灰变成暗红,当胶体金溶液为6.9、7.0、7.1、7.2时,免疫胶体金溶液稳定,颜色鲜艳,胶体金标记蛋白时最佳p H为6.9。
2.2 最适标记蛋白浓度的测定 含蛋白质量少不能稳定的胶体金溶液各管呈现由红变蓝聚沉现象,而加入蛋白质达到或超过最低稳定量,试管胶体金溶液则保持红色不变。由表1得知稳定胶体金的最低蛋白量为9μg/m L,再加此量的20%即为稳定1 m L胶体金所需蛋白质(抗体)的实际用量。因此,霍乱弧菌O139群最佳标记蛋白量为每毫升胶体金中加入11μg标记单抗3H2。
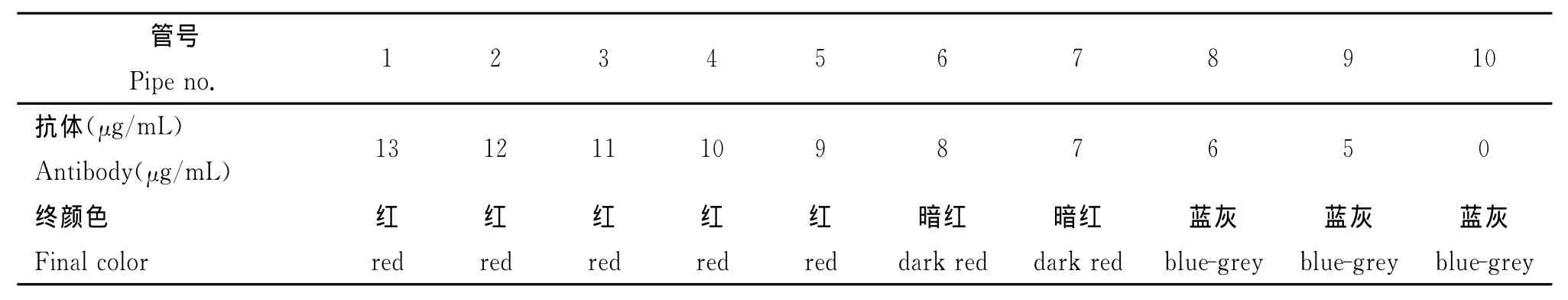
表1 免疫胶体金标记蛋白用量的测定Tab.1 Optimization on the amount of antibody in labeling colloidal gold
2.3 胶体金标记溶液的最适稀释度 分别将100 m L胶体金标记单抗3H2制备的胶体金标记沉淀物用p H7.0,浓度为 0.01 mol/L PBS-2%BSA 溶液溶解稀释为50 m L(原体积的50%)、40 m L(原体积的40%)、30 m L(原体积的30%)、20 m L(原体积的20%),分别按0.1 m L/cm2的用量分散到玻璃纤维上,干燥后与同一批包被膜装配成试纸条,测试结果如表2,结果表明,胶体金标记溶液采用其浓度为原体积的40%制备成的胶体金标记物,即可满足测试要求。
2.4 包被抗体浓度的确定 测试结果如表3,结果采用2G82mg/m L、兔抗鼠IgG 4 mg/m L的包被量即可满足所需灵敏度的要求,增加包被抗体的浓度不提高测试灵敏度。
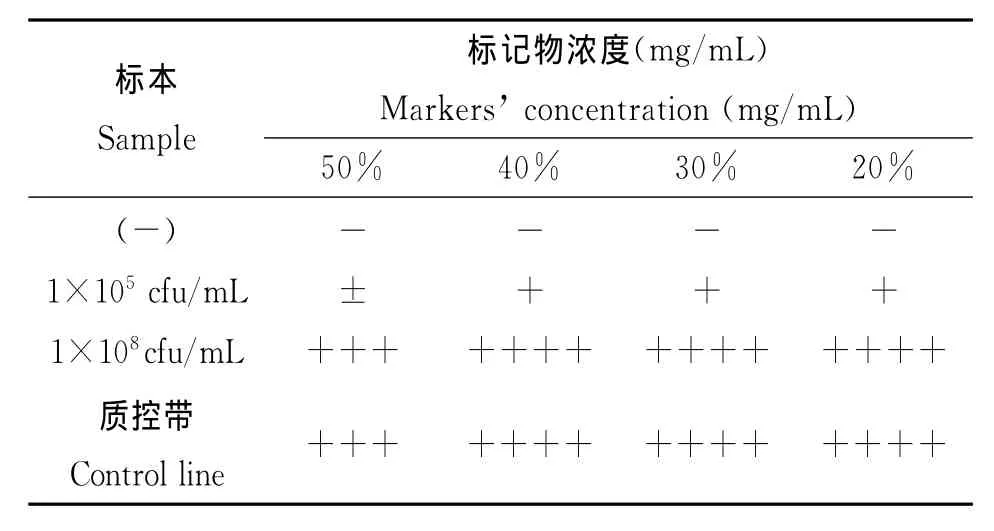
表2 不同浓度胶体金标记物的检测结果Tab.2 Detection results of colloidal gold with different concentrations
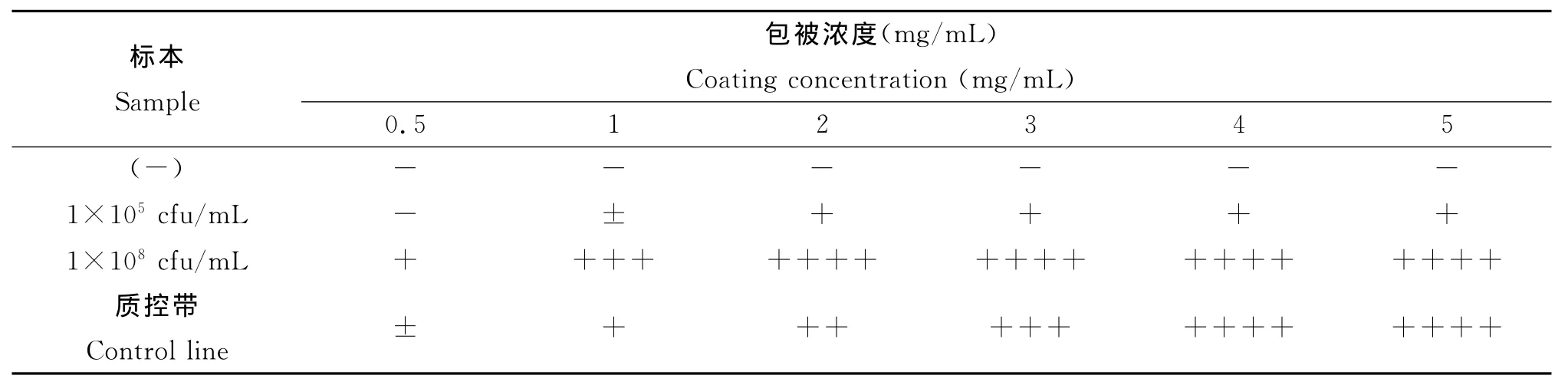
表3 不同包被浓度的检测结果Tab.3 Detection results of different coating concentrations
2.5 胶体金免疫层析试纸条的特异性 用试纸条检测霍乱弧菌样品,结果为阳性,检测霍乱弧菌O1群霍乱弧菌O22群、霍乱弧菌O155群、大肠杆菌、副溶血弧菌、麦氏弧菌、伤寒及各型副伤寒杆菌、粪链球菌、河弧菌、耶尔森氏菌、痢疾杆菌、变形杆菌、出血性大肠杆菌O157∶H7、金黄色葡萄球菌,全部为阴性。
2.6 胶体金免疫层析试纸条的敏感性 用试纸条检测稀释度1×108、1×107、1×106、1×105cfu/m L霍乱弧菌O139群样品,在检测线与质控线处均出现红色条带,表明检测结果为阳性;而1×104cfu/m L霍乱弧菌O139群样品检测线处显色可疑;1×103cfu/m L霍乱弧菌O139群样品仅在质控线处出现明显的红色条带,表明检测结果为阴性。因此,该试纸条灵敏度为1×105cfu/m L。
2.7 胶体金免疫层析试纸条的稳定性 将试纸条置2℃~8℃干燥保存,每月定期抽检至第13个月,与新制备的试纸条平行检测阳性和阴性,均未发现特异性和敏感性降低。
2.8 临床考核 用霍乱弧菌O139群胶体金免疫层析试纸条,与细菌培养法在临床标本的对比试验中,特异性和灵敏度均达到100%,具体数据见表4。
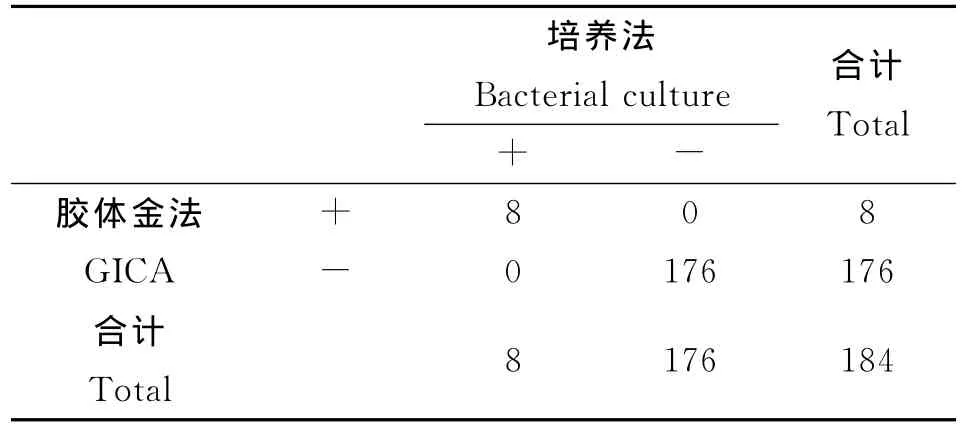
表4 胶体金试纸条与细菌培养法对比Tab.4 Comparison on colloidal gold immunochromatography and bacterial culture
3 讨 论
免疫胶体金技术是20世纪70年代初期由Faulk和Taylor始创,最初用于免疫电镜技术。目前金标记技术常与膜载体配合,形成特定的免疫检测方式,如免疫渗滤试验和免疫层析试验等。免疫层析试纸条就是此技术用于体外快速诊断的一个重要发展方向,是在现代单克隆抗体技术、胶体金免疫层析技术和新材料技术基础上发展起来的新型检测技术。近年来该技术发展迅速,已经在临床诊断特别是床边检测(POCT)中得到了广泛应用,如传染病、早孕、肿瘤等的检测。目前已有些非临床检测的应用,如毒素、农药残留、环境监测、动物源性食品的现场快速检测[6]等。我们建立的霍乱弧菌O139胶体金免疫层析快速检测法具有操作简便、快速灵敏、不需仪器设备、能够同时检测大量样品等优点。适用于多种食品样品中霍乱弧菌O139的检测,可用于出入境口岸对可疑污染食品的应急现场快速筛查。进一步提高免疫层析试验的敏感性、实现多元检测、实现定量或半定量检测是我们今后努力的方向。
[1]Wen YM.Modern medical microbiology[M].Shanghai:Shanghai Medical University Press,1999:331-349.(in Chinese)
闻玉梅.现代医学微生物学[M].上海:上海医科大学出版社,1999:331-349.
[2]le Roux WJ,Masoabi D,de Wet CM,et al.Evaluation of a rapid polymerase chain reaction based identification technique forVibriocholeraeisolates[J].Water Sci Technol,2004,50(1):229-232.
[3]Shen GX,Zhou RL.Modern immunology experiment technology[M].Wuhan:Hubei Science and Technology Press,1998:131-137.(in Chinese)
沈关心,周汝麟.现代免疫学实验技术[M].武汉:湖北科学技术出版社,1998:131-137.
[4]Dar VS,Ghosh S,Broor S.Rapid detection of rotavirus by colloidal gold particles labeled with monoclonal antibody[J].J Virol Methods,1994,47(1-2):51-58.DOI:10.1016/0166-0934(94)90065-5
[5]Wang YJ,Hu YL,Yang SH,et al.Development of colloidal gold immunochromatographic assay for rapid detection of chloramphenicol residue[J].Henan Sci,2011,29(12):1455-1457.(in Chinese)
王玉金,胡宜亮,杨书豪,等.氯霉素残留胶体金免疫层析快速检测方法的研制[J].河南科学,2011,29(12):1455-1457.
[6]Qi GY,Zhi XY,Ren WW,et al.Application progress of colloidalgold immunochromatographic assay(GICA)in animalderived food[J].J Northeast Agri Univ,2010,41(4):156-160.(in Chinese)
祁光宇,智晓莹,任维维,等.胶体金免疫层析技术在动物源性食品中的应用[J].东北农业大学学报,2010,41(4):156-160.
