江西省黄鼬和鼬獾狂犬病流行病学监测*
2012-08-21赵敬慧张守峰苗富春王林栋李易潞扈荣良
赵敬慧,张守峰,刘 晔,陈 奇,苗富春,2,王林栋,李易潞,扈荣良
2.吉林农业大学动物科学技术学院,长春 130118
狂犬病(Rabies)是由狂犬病病毒(Rabies virus,RABV)引起的一种古老的人兽共患传染病,死亡率几乎为100%。狂犬病在我国大部分地区流行,严重危害公共卫生安全。在我国,除犬外野生动物可能也是重要的传播宿主和贮存宿主,野生动物狂犬病尚无系统研究。鼬獾(Melogalemoschata)是一种在我国华东、东南丘陵地区广泛分布的小型鼬科动物。本研究室对江西、浙江、安徽等地区野生动物鼬獾进行的狂犬病流行病学调查表明,上述地区鼬獾种群内存在狂犬病的独立传播,与人狂犬病关系密切[1-2];并有一株鼬獾狂犬病毒变异株JX09-17(fb)与浙江地区犬源分离株同源性较高,可能与犬狂犬病溢出有关[3]。
该地区另一种数量较大夜行野生动物——黄鼬(Mustelasibirica),俗称黄鼠狼,广泛分布于我国各地区,生活习性与鼬獾相似,昼伏夜出,与鼬獾同为夜行动物。黄鼬狂犬病在波多黎各、格林纳达、多米尼加、古巴、南非和加勒比海岸地区均有报道,而且黄鼬分离株与犬源分离株核酸同源性较高,不同地区黄鼬分离株彼此差异较大,可能是分别感染了不同的狂犬病病毒株[4-9]。国内并没有黄鼬狂犬病的报道,为了解我国黄鼬是否携带狂犬病病毒,以及黄鼬、鼬獾、犬3种动物之间是否存在交叉感染,针对江西省部分地区野生动物黄鼬及鼬獾进行狂犬病流行病学监测,确定其狂犬病感染状况,为我国狂犬病的防治策略的制定提供依据。
1 材料与方法
1.1 样品采集2011年11月到2012年2月,在江西省共收集黄鼬脑组织样品1 102份,鼬獾脑组织样品210份,见表1。

表1 黄鼬、鼬獾脑组织样品来源地区分布Tab.1 Original place distribution of samples
1.2 直接免疫荧光检测(FAT) 按直接免疫荧光法进行狂犬病病原检测[11]。取小脑和脑干组织少许,在载玻片上制备组织触片;脑组织触片自然风干,置于80%丙酮溶液内固定(4℃,20 min),取出自然风干;以PBS(0.01 mol/L,p H7.4)稀释FITC标记的抗狂犬病病毒核蛋白单克隆抗体 (由本实验室制备)为工作液;将触片置于染液内,37℃染色60 min;以洗液(1L PBS中加0.5 m L Tween-20)浸洗染色后触片,洗涤3次;洗涤后滴加80%甘油1~2滴,加盖玻片后荧光显微镜下观察。阴性对照为正常鼠脑组织,阳性对照为狂犬病病毒BD06株鼠脑毒。
1.3 狂犬病病毒分离 采用小鼠脑内接种方法[10],对FAT检测阳性的样品进行病毒分离。制成10%悬液,于4℃以2 000 r/min离心20 min,取上清接种。1~3日龄昆明种乳鼠(购自长春生物制品研究所实验动物中心),约10只/窝,乳鼠和母鼠同笼饲养。乳鼠脑内接种0.03 m L/只,观察5~21 d。取发病或死亡的小鼠脑组织用于FAT和RTPCR检测。
1.4 N基因和G基因的扩增与序列测定 狂犬病阳性脑组织,TRIzol法提取总RNA,以特异引物进行反转录,用2对引物进行PCR,扩增狂犬病病毒核蛋白和糖蛋白全基因序列,反应体系为:模板2 μL,10× PCR buffer 5μL,d NTP Master Mix 4 μL,Ex-taq DNA 聚合酶0.5μL,上下游引物各1 μL,双蒸水补至总体积50μL。反应条件为:95℃变性3 min后,于95℃30 s,52℃30 s,72℃100 s循环扩增30次,最后72℃延伸10 min。阴性对照为正常鼠脑组织,阳性对照为狂犬病病毒BD06株。PCR产物经1%琼脂糖凝胶电泳鉴定。如扩增获得1.7 kb(N基因)与1.8 kb(G基因)左右条带,回收PCR产物,送Ta KaRa公司,用扩增引物对PCR产物直接测序。拼接后核蛋白基因ORF(1 353 bp)及糖蛋白基因ORF(1 575 bp),见表2。

表2 N基因和G基因扩增引物Tab.2 Primers for amplification of N and G genes
1.5 DNA序列与分析 文件转换使用Clustal W软件包,用MEG4软件以邻位相连法构建系统发生树。本研究中用于比较分析的狂犬病毒N基因和G基因序列来源于GenBank,见图3,各毒株信息:GenBank登录号/毒株/宿主/来源地区/分离时间。
2 结 果
2.1 样品检测与病毒分离 1 102份黄鼬脑组织样品FAT检测结果呈阴性。210份鼬獾脑组织样品FAT阳性4份,可见明亮的苹果绿或黄绿色荧光颗粒,呈不同形状和大小。阳性鼬獾样品脑内接种3日龄乳鼠,共分离到4株狂犬病毒,分别命名为JX12-64、JX12-67、JX12-102、JX12-234,这4株街毒在乳鼠脑内接种后在7~15 d发病。发病乳鼠脑组织FAT呈阳性,见图1。
2.2 基因扩增产物鉴定 取5μL PCR产物进行1.0%琼脂糖凝胶电泳,结果4株狂犬病病毒在1.7 kb及1.8 kb处均可见目的条带,与预期大小相符,见图2。
2.3 GenBank登录号 4株新分离鼬獾源狂犬病病毒N基因和G基因序列已录入GenBank,登录号(图3):JX12-64 N基因JQ950446,G基因JQ950447;JX12-67 N 基因JQ950448,G 基因JQ950449;JX12-102 N基因JQ950450,G基因JQ950451;JX12-234 N基因JQ950452,G基因JQ950453。
2.4 基于N基因和G基因构建系统进化树分析见图3,JX12-64,JX12-67,JX12-102,JX12-234,这4株狂犬病病毒同属基因1型,病毒之间N基因和G基因的同源性较高,分别为99.6%~100%和99.7%~100%,与浙江鼬獾分离株(ZJ-LA,F02等)和部分江西其他鼬獾分离株(JX08-45,JX08-48,JX08-47)同源性也较高,分别为99.6%~100%和99.7%~100%,进化关系较近,处在同一进化分支,而且与疫苗株(CTN181和CTN7)同源性较高,分别为94.6%~95.1%和92.9%~93.6%,与浙江和福建犬源分离株(ZJ-QZ,D01,FJ008,FJ009等)同源性88.2%~88.8%和87.6%~87.7%。

图1 FAT检测黄鼬和鼬獾脑涂片(A)鼬獾阳性脑组织涂片;(B)正常黄鼬脑组织涂片;(C)阴性对照;(D)阳性对照Fig.1 FAT of ferret badger and yellow mongoose brainA:Brain of ferret badger with suspected rabies;B:Yellow mongoose brain;C:Negative control;D:Positive control
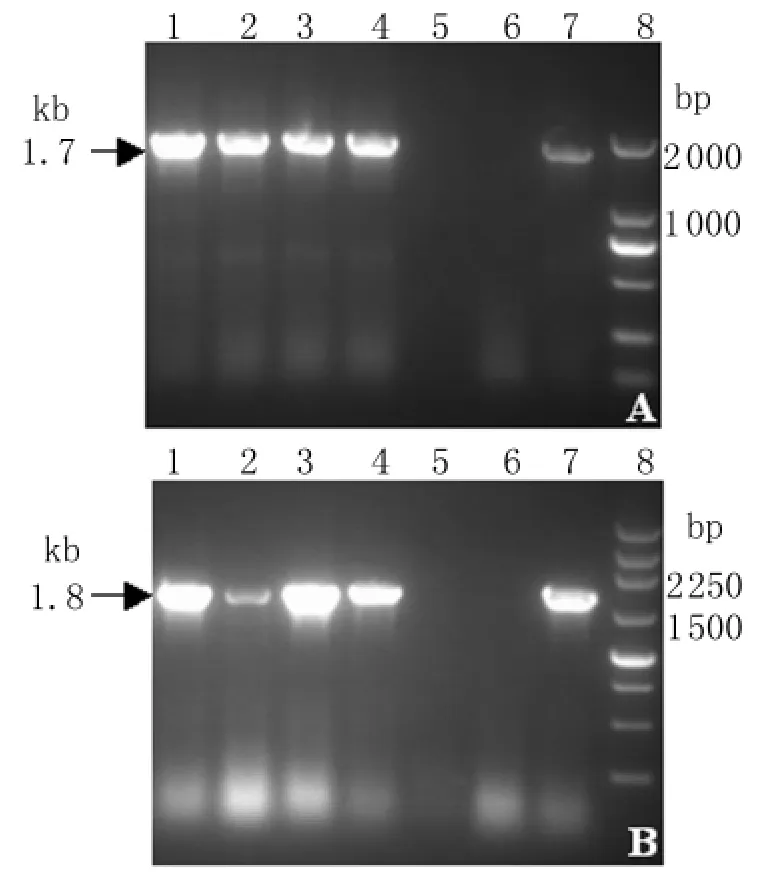
图2 鼬獾狂犬病病毒N基因和G基因RT-PCR结果(A)N 基 因 1~4:JX12-64,JX12-67,JX12-102,JX12-234;5:空白对照;6:阴性对照;7:阳性对照;8:DL2000 Marker;(B)G 基 因 1~4:JX12-64,JX12-67,JX12-102,JX12-234;5:空白对照;6:阴性对照;7:阳性对照;8:250 bp MarkerFig.2 RT-PCR results of N and G genes from ferret badger rabies virus(A)N-gene;Lane 1 to 4:JX12-64,JX12-67,JX12-102,and JX12-234,respectively;5:PCR-negative control;6: Uninfected brain negative control;7:Positive control;8:DL2000 marker(B)G-gene.Lane 1 to 4:JX12-64,JX12-67,JX12-102,and JX12-234,respectively;5:PCR-negative control;6: Uninfected brain negative control;7:Positive control;8:250 bp marker
3 讨 论
黄鼬狂犬病主要报道于加勒比海沿岸地区,最早报道于1950年波多黎各,而后在古巴、格林纳达、多米尼加和南非等地也有报道[4-9]。我国并没有黄鼬狂犬病的相关报道,本研究首次对我国江西省黄鼬和鼬獾进行了狂犬病流行病学监测,不仅对该地区黄鼬和鼬獾感染狂犬病情况有初步了解,同时,为野生动物狂犬病相关研究提供流行病学数据,也为野生动物狂犬病控制提供依据。

图3 基于我国RV流行毒株N基因(A)和G基因(B)构建系统进化树(A)N基因;(B)G基因;各毒株信息:GenBank登录号/毒株/宿主/来源地区/分离时间Fig.3 The neighbor-joining phylogenetic tree of representative Chinese rabies virus isolates,using the N and G gene sequencesA:N gene;B:G gene;Information of RV:Gen-Bank no./isolate/host/origin/isolation date
黄鼬与鼬獾脑组织样品主要来源于江西省的新建县、安义县、永修县、高安县、南昌县、景德镇等地区,集中在江西省北部环鄱阳湖地区。对鄱阳湖地区野生动物黄鼬和鼬獾进行狂犬病流行病学监测,一方面因为这一地区鼬獾种群内存在狂犬病的流行,黄鼬与鼬獾都是夜行动物,有交叉感染的可能;另一方面鄱阳湖近年来持续干旱,枯水期提前,丰水期推迟,2011年年初到年底,湖区水域面积减少近三分之二,甚至部分地区出现饮水困难的情况,生态环境的变化可能导致野生动物的活动范围与区域的改变,也可能会增加狂犬病扩散传播的几率。本次监测结果显示,1 102份黄鼬样品,FAT结果都为阴性,210份鼬獾样品,FAT阳性4份,经MIT分离获得4株狂犬病病毒。对这4株病毒N基因和G基因遗传进化分析,新分离4株鼬獾源狂犬病病毒同属基因1型,同源性较高,与浙江省鼬獾分离株(ZJLA,F02等)和江西省其它鼬獾分离株(JX08-45,JX08-48,JX08-47)同源性在96%以上,遗传进化关系也较近,处在同一进化分支,但与浙江和福建犬源分离株(ZJ-QZ,D01,FJ008,FJ009等)同源性88%左右,与疫苗株CTN181和CTN7同源性较高。CTN181是上世纪50年代分离自我国山东淄博的疫苗株,与广东分离株(GN07)和贵州分离株(Guizhou_A101和 Guizhou_A103)同源性较高,遗传进化关系也较近,而且与本研究分离的鼬獾源狂犬病病毒同处一个进化分支。这一分支的病毒曾经于上世纪60年代左右在我国广泛流行[11],为何近年来在鼬獾种群内流行,是由犬传播给鼬獾,还是由于鼬獾就是作为重要的贮存宿主,将病毒传播给犬和人,这需要长期的监测分析与研究。此前有研究显示,鼬獾源狂犬病病毒JX09-17(fb)株与江西、浙江、河北等地犬源分离株同源性较高,而与浙江和江西鼬獾分离株同源性相对较低,可能是由于犬狂犬病的溢出导致鼬獾感染[3],这仍需进一步研究来确定。
以上结果表明,采样地区黄鼬样品中未发现狂犬病病毒感染,而鼬獾感染狂犬病病毒阳性率较高,说明在鼬獾种群内存在狂犬病的流行。从犬与鼬獾狂犬病病毒株同源性较低的情况来看,二者交叉传播或溢出的可能较低,黄鼬和鼬獾尽管都属于夜行动物,但二者交互感染的可能性很低。江西省野生动物种类繁多,数量较大,因此应加强该地区野生动物狂犬病的监测。
[1]Liu Y,Zhang SF,Wu XF,et al.Ferret badger rabies origin and its revisited importance as potential source of rabies transmission in Southeast China[J].BMC Infect Dis,2010,10:234.DOI:10.1186/1471-2334-10-234
[2]Zhang SF,Tang Q,Wu XF,et al.Rabies in ferret badgers:Southeastern China[J].Emerg Infect Dis,2009,15(6):946-949.DOI:10.3201/eid1506.081485
[3]Zhang SF,Zhao JH,Liu Y,et al.Characterization of a rabies virus isolate from a ferret badger(Melogalemoschata)with unique molecular differences in glycoprotein antigenic site III[J].Virus Res,2010,149(2):143-151.DOI:10.1016/j.virusres.2010.01.010
[5]Everard CO,Everard JD.Mongoose rabies[J].Clin Infect Dis[J].1988,10(Suppl 4):S610-S614.DOI:10.1093/clinids/10.Supplement_4.S610
[6]Nel LH,Sabeta CT,von Teichman BV,et al.Mongoose rabies in southern Africa:a re-evaluation based on molecular epidemiology[J].Virus Res,2005,109(2):165-173.DOI:10.1016/j.virusres.2004.12.003
[7]Everard CO,Everard JD.Mongoose rabies in the Caribbean[J].Ann N Y Acad Sci,1992,653:356-366.DOI:10.1111/j.1749-6632.1992.tb19662
[8]Davis PL,Rambaut A,Bourhy H,et al.The evolutionary dynamics of canid and mongoose rabies virus in southern Africa[J].Arch Virol,2007,152(7):1251-1258.DOI:10.1007/s00705-007-0962-9
[9]Van Zyl N,Markotter W,Nel LH.Evolutionary history of African mongoose rabies[J].Virus Res,2010,150(1-2):93-102.DOI:10.1016/j.virusres.2010.02.018
[10]Meslin FX,Kaplan MM,Koprowski H.Laboratory techniques in rabies[M].4th ed.Geneva:World Health Organization,1996,69-80.
[11]Yu J,Li H,Tang Q,et al.The spatial and temporal dynamics of rabies in China[J].PloS Negl Trop Dis,2012,6(5):e1640.DOI:10.1371/journal.pntd.0001640
