钙拮抗剂硝苯吡啶对大鼠心肌缺血再灌注损伤的作用
2012-08-20谷思洋邓立菊姜宏宇
谷思洋,邓立菊,姜宏宇
(1.吉林大学第一医院 干部病房,吉林,长春 130021;2.大庆龙南医院,黑龙江,大庆 163453)
钙拮抗剂硝苯吡啶对大鼠心肌缺血再灌注损伤的作用
谷思洋1,2,邓立菊2,姜宏宇1*
(1.吉林大学第一医院 干部病房,吉林,长春 130021;2.大庆龙南医院,黑龙江,大庆 163453)
目的 研究钙拮抗剂(Calcium antagonists)硝苯吡啶(Nifedipine)对离体大鼠心肌缺血再灌注损伤的作用。方法30只体重在260-300g的 Wistar雄性大鼠随机分为三组:对照组、模型组、Nifedipine组(1μmmol/L)。大鼠麻醉后取出心脏,悬挂于Langendorff灌流装置上行主动脉逆行灌流,制备大鼠离体心脏缺血30min、再灌注120min模型;对照组行150min正常灌流。测定心肌梗死面积,检测SOD(Superoxidedismutas超氧化物歧化酶)及 MDA(malonaldehyde丙二醛)的含量,免疫组化方法行PKCδ(The protein kinase C蛋白激酶C)的测定,用RT-PCR法测定NCX(Na+/Ca2+exchanger钠钙交换体)及SERCA2α(Sareoplasmie reticulum calcium adenodine triphosphatase肌浆网钙泵)的表达。结果硝苯吡啶组心肌梗死面积较模型组明显缩小(P<0.01);冠脉灌流液中SOD活性明显升高(P<0.01);MDA含量显著下降(P<0.01);药物组的PKC含量水平较模型组增多(P<0.05),药物组 NCX mRNA的表达水平较模型组降低,存在显著差异(P<0.05)。结论钙拮抗剂Nifedipine对大鼠心肌缺血再灌注损伤有保护作用。
硝苯吡啶(Nifedipine);缺血/再灌注;心肌梗死;钠钙交换体(NCX)
(ChinJLabDiagn,2012,16:0210)
本研究采用大鼠离体心肌缺血/再灌注模型,观察Nifedipine对缺血/再灌注心肌损伤的影响。
1 材料与方法
1.1 动物与仪器
体重在260-300g的wistar雄性大鼠(吉大动物实验中心,动物合格证号:SCXK—吉2007-0003);Langendorff灌流装置(成都泰盟科技有限公司);分光光度计(上海尤尼柯有限公司);BI-2000图像分析系统(成都泰盟科技有限公司);OLYMPUS显微镜。
1.2 药品与试剂
1.2.1 硝苯吡啶(Nifedipine),购自瑞士 Enzo life sciences公司。溶于二甲基亚砜(DMSO)中,配成1mmol/L贮备液,分装成300μl小瓶,4℃冰箱中保存,应用前取出37℃水浴中融化。用KH液稀释成1μmol/L浓度。
1.2.2 KH 工作液 NaCl 6.92g,NaHCO32.1g,KC1 0.35g,CaC120.2g,MgSO40.14g,KH2PO40.16g,葡萄糖2.0g,加去离子水1000ml,在磁力搅拌机上充分搅拌溶解,溶解后将pH调整为 (7.4±0.5)。
1.2.3 TTC染液 将0.5g TTC粉末加入装有50 ml 1×PBS液的棕色瓶中,37℃水浴箱中15min,振荡,制成TTC溶液,现用现配。SOD、MDA试剂盒由南京建成生物公司提供。PKCδ抗体由美国SAB signalway antibody生物工司提供。Trizol、DEPC、M-MLV反转录酶、Taq酶(宝生物工程大连有限公司);引物由上海生工生物技术有限公司合成;其余试剂均为国产分析纯试剂。
1.3 实验方法
1.3.1 离体大鼠心脏Langendorff灌流模型制备
测大鼠体重,以0.4g/kg水合氯醛腹腔麻醉大鼠,腹腔内注入5mg/kg肝素钠,开胸,迅速摘出心脏置于预先用95%O2+5%CO2混合气体(1.5L/min)所饱和的4℃KH液中。经主动脉逆行插管悬挂于Langendorff灌流装置上,调整悬挂位置使左、右冠脉分别得到充分的灌流,保持自搏心率,在10 kPa恒压、37℃恒温下以1.5L/min 95%O2+5%CO2流量通气,充分氧合的KH液按10ml/min灌流,剪去左心耳,将充水导管球囊插入左心室,向球囊内注水约0.2-0.4ml,将左心室舒张压调至1.1 kPa以上,记录灌流压、左心室压力(美国MP150多导电生理记录仪)及灌流量,稳定后15min后开始心肌缺血再灌注模型的制备。
1.3.2 大鼠心脏缺血/再灌注的模型制备 选择30 min的不完全缺血(即将左、右冠脉灌流量减到原灌流量的5%)及2h再灌注(10ml/min的KH液)。
1.3.3 试剂稀释及实验分组 将预先分装的硝苯吡啶,用KH液释成1μmol/L浓度。将30只大鼠随机分为3组,每组10只。组一:对照组;组二:为模型组;组三:在缺血时向主动脉内注入1μmol/L钙拮抗剂硝苯吡啶(硝苯吡啶组)。
1.4 检测指标
1.4.1 SOD、MDA及心肌梗死面积检测 收集灌流结束前1min的冠脉流液,根据试剂盒测量SOD、MDA的活性。实验结束时取下心脏放入-20℃冰箱中冷冻1h,然后将心脏以心尖为起点切成1mm间隔横断切片,放入37℃氯化三苯基四氮唑(TTC)中染色30min,再置于4%多聚甲醛液中24h,于吉林大学设备处进行实体图像采集,梗死区(TTC未染色的白色区)和非梗死区 (TTC染成红色区),然后用BI-2000图像分析系统计算心肌梗死面积(即梗死面积占全心面积的百分比)。
1.4.2 心肌PKCδ表达 免疫组织化学染色法:取心肌标本4%多聚甲醛固定,石蜡包埋,做成5μm切片,行HE染色。SP法行PKCδ免疫组织化学染色。切片常规脱蜡至水,置入3%H2O2孵育15 min,以封阻内源性过氧化物酶。PBS浸泡3min×2次;用0.01M柠檬酸盐缓冲液抗原修复自然冷却后取出,PBS冲洗3min×2次。滴加山羊血清封阻,室温下孵育10min。滴加PKCδ一抗(1∶100稀释)37℃湿盒中孵育75min。PBS冲洗3min×3次。滴加生物素标记的二抗,湿盒中37℃孵育20 min。PBS冲洗3min×3次。滴加辣根过氧化物酶标记链酶卵白素,37℃孵育15min。PBS冲洗3 min×3次。DAB显色1min,自来水冲洗10min,苏木精复染1min,自来水冲洗10min,梯度乙醇脱水,二甲苯透明,中性树胶封片。在阴性对照切片中,滴加PBS替代PKCδ单克隆抗体,其余步骤不变。心肌PKCδ表达鉴定:细胞呈棕黄色染色者为阳性细胞,利用BI-2000图像分析软件分析组化图片平均光密度值。
1.4.3 NCX与SERCA 2α的 mRNA表达 NCX与SERCA2α行RT-PCR:用Trizol抽提总RNA,测定RNA浓度和纯度。取4μg总RNA反转录生成cDNA文库。1μl模板用于目的基因的PCR扩增。引物顺序为SERCA2a,上 游 引 物:5′-ATGAGATCACAGCTATG ACTGGTG-3′,下 游 引物:5′-GCATTGCACATCTCTATGGTGACTAG-3′,产物:620bp;NCX,上游引物:5′-AATGAGCTTGGTGGCTTCACA-3′,下 游 引 物:5′-CCGCCGATACAGCAGCAC-3′,产物:861bp;GAPDH(内 参 照 ),上 游 引 物:5′-GCCATCAACGACCCCTTCATTG-3′,下 游 引 物:5′-TGCCAGTGAGCTTCCCGTTC-3′,产物:597bp。反应条件为SERCA2a:94℃ 5min,94℃ 3min,56℃30s,72℃30s,35次循环,72℃ 10min;NCX:94℃ 5 min,94℃3min,53℃30s,72℃30s,35次循环,72℃10min;G APDH:94℃5min,94℃3min,56℃30s,72℃30s,35次循环,72℃10min。取扩增产物进行琼脂糖凝胶电泳,凝胶成像系统进行灰度扫描,用靶基因/GAPDH表示靶基因mRNA相对表达水平。
1.5 统计学处理
2 结果
2.1 SOD及MDA的影响大鼠离体心脏经过15 min平衡灌注,30min不完全缺血及2h再灌住,冠脉灌流液中,硝苯吡啶同模型组比较,SOD活性明显升高(P<0.01),MDA 含量显著下降(P<0.01)。见表1。
表1 大鼠离体心脏冠脉流液中SOD、MDA含量比较(±s,n=10)
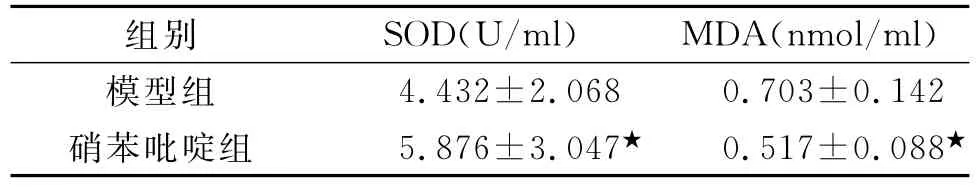
表1 大鼠离体心脏冠脉流液中SOD、MDA含量比较(±s,n=10)
注:与模型组比较,★P<0.01
组别 SOD(U/ml) MDA(nmol/ml)4.432±2.068 0.703±0.142硝苯吡啶组 5.876±3.047★ 0.517±0.088模型组★
2.2 对大鼠离体心脏心肌梗死面积的影响对照组无心肌梗死出现;硝苯吡啶组梗死面积较模型组明显减小,与模型组比较差异有显著性(P<0.01)。见表2。
2.3 HE染色与PKCδ表达结果心肌组织HE染色后400倍光镜下见:对照组:心肌细胞排列规则,无间质水肿;模型组:心肌细胞间质水肿,肌纤维肿胀,排列无序,横纹消失,肌浆内出现空泡变性,可见较多粒细胞灶状浸润,并可见少量红细胞渗漏,个别细胞出现溶解、坏死;药物组:心肌细胞轻度水肿,界限清楚,细胞排列相对规则,间质无水肿,可见少量中性粒细胞浸润,无红细胞渗漏。通过对心肌组织PKC平均光密度的研究发现,对照组的PKC表达水平较低,缺血再灌注组PKC表达较对照组增多,且主要分布于胞浆中;硝苯吡啶组PKC水平较缺血再灌注组药物组均能使PKC含量增加(P<0.01),并能使心肌细胞的PKC从细胞核或细胞浆移位到细胞膜上,分布发生改变。见表3。
表2 各实验组在缺血再灌注损伤中的心肌梗死面积比较(±s,n=10)

表2 各实验组在缺血再灌注损伤中的心肌梗死面积比较(±s,n=10)
注:与模型组比较,★P<0.01
组别 梗死面积(%)对照组 无模型组 31.6±0.081硝苯吡啶组 21.6±0.091★
表3 心肌组织免疫组化PKC表达平均光密度的比较(±s,n=10)

表3 心肌组织免疫组化PKC表达平均光密度的比较(±s,n=10)
注:与正常组比较,●P<0.01;与模型组比较,★P<0.01
组别 n 10 0.237±0.018模型组 10 0.296±0.011●硝苯吡啶组 10 0.321±0.014平均光密度对照组★
2.4 NCX及SERCA2αmRNA表达扩增条带清晰明亮,与预先设计的 NCX、SERCA2α、GAPDH基因片段大小一致 (图5)。模型组NCX mRNA的表达比正常组显著升高(P<0.01);硝苯吡啶组NCX mRNA的表达水平较模型组降低,存在显著差异(P<0.01)。模型组SERCA2αmRNA的表达比对照组显著降低(P<0.01);硝苯吡啶组SERCA2αmRNA的表达水平较模型组显著增高(P<0.01)。见表4。
表4 各组NCX1mRNA和SERCA2αmRNA表达比较(±s,n=10)

表4 各组NCX1mRNA和SERCA2αmRNA表达比较(±s,n=10)
注:与对照组比较,●P<0.01;与模型组比较,★P<0.01
组别 n NCX1/GAPDH SERCA2α/10 0.236±0.059 0.487±0.049模型组 10 0.457±0.068● 0.154±0.053●硝苯吡啶组 10 0.305±0.047★ 0.204±0.041 GAPDH对照组★
3 讨论
一般所称钙拮抗剂(Calcium antagonists),是指阻滞离子从胞外经钙通道流入胞内的药物,能抑制跨膜钙内流及细胞内的钙释放,降低细胞内游离钙浓度及其利用率,抑制ATP酶的活性,降低心肌收缩力;使平滑肌细胞松弛,血管扩张,降低外周血管阻力[1]。由于钙拮抗剂增加缺血区血流,负性肌力作用又降低了局部代谢,有利于维持缺血心肌的氧供需平衡,因此可缩小缺血范围,减轻局部代谢紊乱及再灌注性细胞损害的程度。钙拮抗剂通过阻断心肌细胞膜钙通道,降低细胞内钙浓度、拮抗钙超载,治疗心肌缺血再灌注损伤已成为目前的一种共识[2-5]。在心肌缺血后坏死尚未形成前给药效果更佳。有报道证实[6]:应用钙离子拮抗剂对损伤的心肌细胞有一定的保护作用,对改善心肌功能有明显的效果。
本实验为Langendorff灌流装置上行主动脉逆行灌流,制备大鼠离体心脏缺血30min、再灌注120 min模型,模拟临床上心肌缺血-再灌注损伤患者的病理生理过程,观察硝苯吡啶对离体大鼠心脏的保护作用。结果显示,硝苯吡啶组心肌梗死面积较模型组、对照组明显缩小(P<0.01),药物对离体大鼠心肌有保护作用。MDA为氧自由基攻击生物膜不饱和脂肪酸发生脂质过氧化反应的终产物,其值间接反映机体组织细胞受自由基损伤程度;SOD为细胞内一种抗氧化酶,它可清除超氧阴离子,保护机体免受氧自由基损伤,其值间接反映机体清除氧自由基的能力,缺血再灌注时自由基生成增加,同时其清除能力下降,脂质过氧化加强;应用药物后冠脉灌流液中SOD活性明显升高(P<0.01);MDA含量显著下降(P<0.01),证明药物对大鼠心肌有保护。心肌细胞内游离的Ca2+浓度升高可直接激活Ca2+依赖性PKC(a),使其从细胞浆转移到细胞膜上或通过激活Ca2+依赖性磷酯酶C使与其相联的Gq蛋白激活不依赖于钙的PKC-δ和PKC-ε,使其从胞浆转移到细胞膜上。PKC的激活可引发底物蛋白质磷酸化、细胞内钙稳态、线粒体ATP敏感性钾离子通道、腺苷、缓激肽、受体的信息传递等一系列变化,是一种重要的机体内源性保护中间环节,通过催化多种蛋白质磷酸化,进而对细胞产生保护作用,减轻细胞损伤。药物组的PKC含量水平较模型组增多(P<0.01)。本研究发现缺血再灌注损伤心肌中PKC的表达较对照组大鼠心肌中测定量高,说明在缺血再灌注后,心肌产生损伤,PKC由静止状态转为激活状态,表达增多,以保护受损伤心肌。心肌缺血再灌注时,钠钙交换体(sodium-calcium exchanger,NCX)反向转运使Ca2+内流增加,导致细胞钙超载,是缺血再灌注造成细胞结构损伤、心律失常和收缩功能障碍的重要机制[7],正常心脏的NCX1和SERCA2α在细胞水平上保持相对平衡。NCX是缺血/再灌注时 Ca2+进入细胞的主要途径[8,9],阻断NCX介导的钙流入可得到良好的心肌保护作用[10],肌浆网钙泵(SERCA2α)主要作用是将胞质内Ca2+摄回至肌浆网内,药物组NCX mRNA的表达水平较模型组降低,存在显著差异(P<0.01),药物组SERCA2αmRNA的表达水平较模型组显著增高(P<0.01),实验证明使用硝苯吡啶对离体大鼠心肌有保护作用。钙拮抗剂Nifedipine减轻缺血再灌注心肌细胞损伤,对大鼠心肌缺血再灌注损伤有保护作用。
[1]Zhang WG.Can we use calcium antagonist better in antihypertensive therapy[J].Pharmacol Res,1996,34(5/6):187.
[2]Hoffman JJ,Gilbert TB,Poston RS,et al.Myocardial reperfusion injury:etiology,mechanisms,and therapies[J].J Extra Corpor Technol,2004,36(4):391.
[3]Moukarbel GV,Ayoub CM,Abchee AB,et al.Pharmacological therapy for myocardial reperfusion injury[J].Current Opinion In Pharmacology,2004,4(2):147.
[4]Gao F F,Hao S Y,Shi G G,et al.Cardiac electrophysiological and antiarrhythmic cffects of N-n-buty haloperidol indide[J].Cell physiolo Biochem,2010,25(4-5):433.
[5]Huang Z,Shi G,Gao F,et al.Effects of N-n-buty haloperidol indide on L-type calcium channels and intracellular free calcium in rat ventricular myocytes[J].Biochem Cell Biol,2007,85(2):182.
[6]刘 颖,程 翔,廖玉华.地尔硫卓对心脏缺血/再灌注后心肌炎症的影响[J].中国药理学通报,2010,2(1):56.
[7]Christopher RW,Valentino Piacentino Ⅱ,Kenneth SG,et al.Na+-Ca2+exchange current and submembrane[Ca2+]during the cardiac action potential[J].Circ Res,2002,90(1):182.
[8]Ohtsuka M,Takano H,Suzuki M,et al.Role of Na+-Ca2+exchanger in myocardial ischemia/reperfusion injury:evaluation using a heterozygous Na+-Ca2+exchanger knockout mousemodel[J].Biochem Biophys Res Commun,2004,314:849.
[9]Satoh H,Mukai M,Urushida T,et al.Importance of Ca2+influx by Na+/Ca2+exchange under normal and sodium-loaded conditions inmammalian ventricles[J].Mol Cell Biochem,2003,242(1-2):11-17.
[10]Lee C,Hryshko LV.SEA0400:a novel sodium-calcium exchange inhibitor with cardioprotective properties[J].Cardiovasc Drug Rev,2004,22:334.
Protective Effect of Calcium Antagonist Nifedipine on Myocardial Ischemia-reperfusion Injury in Isolated Rat Hearts
GU Si-yang,DENGLi-ju,JIANGHong-yu.(FirstHospital,JilinUniversity,Changchun130021,China)
ObjectiveStudy the protective effect of Calcium Antagonist Nifedipine,on myocardial ischemia-reperfusion injury in isolated rat hearts.MethodsRat myocardial ischemia-reperfusion injury model was established by consisting of a 30min(reducing perfusion flow level of left and right coronary to 5%of the original irrigation flow)ischemic period and 2hreperfusion,the isolated rat hearts were perfused on modified Langendorff apparatus.The rats were divided into control group,ischemia/reperfusion(I/R)group,Nifedipine group,then detected the myocardial infarct area,the levels of SOD and MDA,and PKCδwere detected by immunoHistochemistry,Semi-quantitative RT-PCR was employed to measure the mRNA levels of NCX and SERCA2a.Results(1)Compared with the I/R group,the myocardial infarct area was significantly lower,(2)SOD activity increased significantly and MDA decreased significantly;(3)Nifedipine group,compared with model group,levels of PKC increased (P<0.05);(4)expression of NCX mRNA in Nifedipine group was lower than the model group,there were significant differences(P<0.05);expression of SERCA2αmRNA in Nifedipine group was significantly increased compared with the model group(P<0.05).ConclusionThe calcium antagonist Nifedipine on myocardial ischemia-reperfusion injury has a protective effect.
book=211,ebook=93
myocardial infarction;Nifedipine;Ischemia-reperfusion;NCX
R364.1
A
1007-4287(2012)02-0210-04
吉林省自然科学基金资助(201115066)
*通讯作者
2011-01-08)
