PEG 介导细胞融合最适条件的探讨
2012-08-14白洪志
王 惠,郭 峰,关 超,张 梅,关 萍*,白洪志
(1.沈阳农业大学生物科学技术学院,辽宁沈阳110866;2.沈阳农业大学土地与环境学院,辽宁沈阳110866)
细胞融合(cell fusion),又称细胞杂交,是指在外力的作用下2个或2个以上的细胞融合成一个双核或多核细胞的现象,因此又称细胞杂交。细胞融合技术是研究细胞遗传、基因定位、细胞免疫、病毒、肿瘤和培育生物新品种的重要手段[1-3],尤其是近年来发展起来的新研究技术有着更为重大的实践意义[4-7]。细胞融合的方法包括仙台病毒诱导法、物理融合技术(电融合技术)、聚乙二醇(polyethylene glycol,PEG)法等。其中PEG法诱导细胞融合以其容易制备、活性稳定、不需要特别的仪器设备、操作方便等优点,被普遍用于生物、遗传、医药等研究领域[8-9]。但 该 方 法 也 受 许 多 因 素 的 影 响[10-15],如PEG浓度、融合温度、融合时间等。
本试验选取鸡红细胞、兔红细胞、蟾蜍红细胞作为同源与异源细胞研究的试验材料,从PEG浓度、融合温度、融合时间三个方面进行单因素探索,以期找到融合率最高时的条件,达到更好的融合效果。
1 材料与方法
1.1 材料
1.1.1 试剂 不同浓度的PEG(Mr=4 000):250、500、750mL/L PEG;380g/L柠檬酸钠;8.5g/L生理盐水;GKN液;Hanks液;750mL/L酒精。
1.1.2 仪器 电子天平,恒温水浴锅,低速离心机,微量移液枪,光学显微镜。
1.2 方法
1.2.1 不同浓度PEG的配制 称取少许PEG(Mr=4 000)放入小烧杯中,沸水浴加热,使其熔化,分别移取等量的3份至刻度试管中,待冷至50℃时,分别加入预热的3倍体积、1倍体积、1/3体积的GKN液,混匀,配成250、500、750mL/L的PEG。
1.2.2 红细胞的采取及细胞悬液的制备 用灭菌的注射器吸入38g/L的柠檬酸钠2mL,从用750 mL/L酒精消过毒的鸡翼静脉处(兔是从耳缘静脉处,蟾蜍是从主动脉弓处)采取静脉血转入事先装有38g/L的柠檬酸钠的烧杯中使柠檬酸钠与血液的体积比为1∶4,放入4℃冰箱中保存。
取悬液1mL移入10mL的刻度离心管内,加入8.5g/L生理盐水4mL混匀,1 500r/min离心5 min;弃上清液(用吸管吸去),加8.5g/L生理盐水至5mL,混匀后1 500r/min再离心5min;重复上述操作,再离心洗涤1次;收集最后一次离心沉淀的红细胞,用手指轻弹底壁使沉淀松散[9]。用微量移液器移取细胞沉淀至干净试管中,加入9倍体积的GKN液,配成100mL/L的细胞悬液。
1.2.3 细胞融合的方法 试验分6组进行,同源3组,异源3组,分别为鸡-鸡、兔-兔、蟾蜍-蟾蜍、鸡-兔、鸡-蟾蜍和兔-蟾蜍的红细胞融合,每组10只试管进行单因素试验,筛选出每组融合的最佳条件。
1.2.3.1 PEG浓度对同源、异源红细胞融合最适条件的探索 分别取红细胞悬液200μL(同源组取200μL,异源组则分别取异源的两种红细胞各100 μL)至3个刻度离心管中,分别加入预热的100μL的250、500、750mL/L的PEG,放于37℃水浴锅内温浴5min后,再分别加入Hank's液5mL,静置2 min以终止PEG的作用;用微量移液器移取少量红细胞悬液至血球计数板上,盖上盖玻片,观察红细胞融合情况。
1.2.3.2 融合时间对同源、异源红细胞融合最适条件的探索 分别取红细胞悬液200μL(同1.2.3.1)至3个刻度离心管中,分别加入预热的100μL上一项试验中融合率最高时的PEG,放于37℃水浴锅内温浴5、10、15min后,再分别加入 Hank's液5 mL,终止PEG的作用,观察红细胞融合情况。
1.2.3.3 融合温度对同源、异源红细胞融合最适条件的探究 分别取红细胞悬液200μL(同1.2.3.1)至3个刻度离心管中,分别加入预热的100μL上一项试验中融合率最高时的PEG,分别放于23℃、30℃、37℃、44℃水浴锅内温浴上一项试验中测得的融合率最高时的融合时间,再分别加入Hank's液5 mL,终止PEG的作用,观察红细胞融合情况。
1.2.4 细胞融合率的计算 在显微镜视野里,每个视野下读取计数板中间大方格中四角中方格及中心中方格中融合的细胞及未融合的细胞数(注意区分融合细胞与重叠细胞[16]),用下面的公式计算每方格内的融合率,取平均值。
融合率=融合的细胞数/总细胞数×100%[17]
2 结果
2.1 PEG介导的红细胞融合的最适条件探索
2.1.1 PEG浓度对同源、异源红细胞融合最适条件的探索 在37℃、5min融合时间处理条件下,各种类型同源、异源红细胞融合时,PEG为250mL/L的融合率最低,PEG为750mL/L的融合率次之,PEG为500mL/L的融合率最高,其中,同源红细胞融合中,以兔同源红细胞融合率最高为37.8%,异源红细胞融合中,以兔-蟾蜍异源红细胞融合率最高为11.1%(表1)。

表1 不同浓度PEG同源、异源红细胞融合率Table 1 Cell fusion rates of isogenous,heterogenous erythrocytes in different PEG concentrations %
2.1.2 融合时间对同源、异源红细胞融合最适条件的探究 在PEG 500mL/L、37℃处理条件下,各种类型同源、异源红细胞融合时,融合时间5min的融合率最低,10min的融合率次之,15min的融合率最高(蟾蜍例外,在10min融合率最高)。其中,同源红细胞融合时,以兔同源红细胞融合率最高为38.2%,异源红细胞融合中,以兔-蟾蜍异源红细胞融合率最高为12.7%(表2)。

表2 不同融合时间同源、异源红细胞融合率Table 2 Cell fusion rates of isogenous,heterogenous erythrocytes in different response time %
2.1.3 融合温度对同源、异源红细胞融合最适条件的探究 在融合时间15min、PEG 500mL/L条件下,各种类型同源、异源红细胞融合时,融合温度23℃的融合率最低,30℃的融合率次之,37℃的融合率最高,温度升高至44℃时,融合率反而下降。其中,同源红细胞融合时,以兔同源红细胞融合率最高为39.3%,异源红细胞融合时,以兔-蟾蜍异源红细胞融合率最高为14.0%(表3)。
2.2 条件分析
2.2.1 PEG浓度对红细胞融合效果的影响 根据PEG诱导细胞融合的原理可知,PEG是乙二醇的多聚化合物,存在一系列不同分子量的多聚体。在不同浓度PEG溶液中,由于PEG-水之间的氢键结合,导致两个细胞接触点的质膜的脂类分子发生重组和疏散,由于两细胞接口处质膜的双分子层之间的相互亲和以及彼此的表面张力作用,从而促使细胞发生融合,理论上,所用PEG浓度越高,细胞融合效果应该越好。由表1试验数据可知,PEG为500 mL/L时,红细胞融合率最高,而PEG为750mL/L对细胞的毒性过大,试验过程也显示PEG为750 mL/L时质膜结构发生大的变化,出现部分细胞破碎。
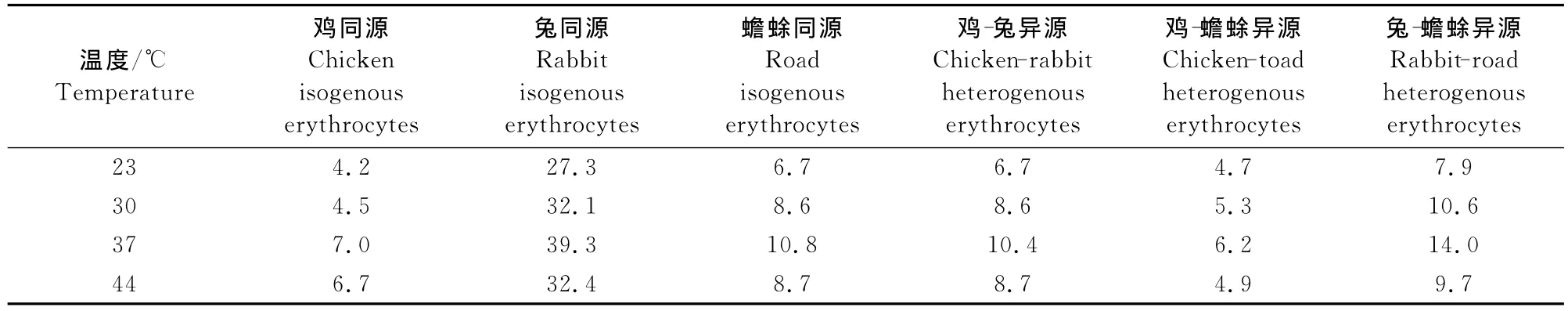
表3 不同融合温度同源、异源红细胞融合率Table 3 Cell fusion rates of isogenous,heterogenous erythrocytes in different reaction temperature %
2.2.2 融合时间对红细胞融合效果的影响 由表2可知,蟾蜍同源红细胞融合组的最适融合时间是10min,其余组均为15min,但仔细分析数据可发现,每组10min与15min时的融合率差距并不是很大。因此,可知融合时间对鸡红细胞的融合率影响不很明显,融合率不随时间的推移发生显著变化,这是由于PEG诱导细胞的膜间发生接触、黏连,使细胞开始融合,经离心去除PEG后,黏连的细胞便随融合的进程自然进行所致。
2.2.3 融合温度对红细胞融合效果的影响 由表3可知,各种类型同源、异源红细胞融合时,均表现随着温度的升高,融合率逐渐增高,在37℃时融合率达到最大,此后随着温度继续升高,融合率开始下降。理论研究可知,在一定范围内,细胞脂双层膜会随着温度的升高而流动性增强。流动性的增强也有益于细胞间细胞膜的融合,提高融合率,但过高温度也会使细胞因承受不了高温而失去活性,引起融合率降低。尤其是当融合的细胞是蟾蜍类的冷血动物时,其红细胞对温度更为敏感。
2.3 融合率的差异性分析
2.3.1 同源组融合率的差异性分析 同源红细胞融合时,鸡同源红细胞在PEG为500mL/L、37℃、15min条件下,融合率7.0%;兔同源红细胞在PEG为500mL/L、37℃、15min条件下,融合率39.3%;蟾蜍同源红细胞在PEG为500mL/L、37℃、10min条件下,融合率10.8%。都是最适条件,但融合率差距较大。从几何学的角度分析可以知道,兔红细胞呈球形,可以减少运动时的阻力,因此球形细胞比椭球形运动速度快,与其他细胞接触机会大大增高,导致融合率比椭球形的鸡红细胞、蟾蜍红细胞都高。且在相同细胞密度下,细胞体积越大,细胞间碰触的机会也高,这也是虽外观都为椭球形,但蟾蜍红细胞融合率高于鸡红细胞的原因。
2.3.2 异源组融合率的差异性分析 异源红细胞融合时,在最适条件下,鸡-兔异源红细胞融合率为10.4%,鸡-蟾蜍异源红细胞融合率为6.2%,兔-蟾蜍异源红细胞融合率为14.0%。鸡-兔异源红细胞、兔-蟾蜍异源红细胞融合效果都略高于鸡、蟾蜍同源时的融合效果,其原因均可归结为兔红细胞具有球形外观,其本身的运动性高于其他两种细胞,因此使得异源细胞间的接触机会高于鸡与蟾蜍同源接触机会,且在兔-蟾蜍异源红细胞融合时,视野下可看到由于兔与蟾蜍红细胞体积差距5倍左右,一个蟾蜍红细胞可同时与多个兔红细胞接触并进一步融合,使融合率有所提升。但整体可看出异源细胞间的融合率明显低于同源间,分析原因,可能由于不同物种间的差异性造成的。
综上,从单因素试验及结果分析中可以看出,除蟾蜍同源红细胞融合组的最适融合条件为PEG为500mL/L、37℃、10min反应时间,其余组,无论是恒温动物还是变温动物红细胞,其细胞融合的最适条件均为PEG 500mL/L、37℃、15min反应时间。但从融合率上可见兔红细胞同源融合率远高于其他各组,而整体上同源组的融合率高于异源组。
3 讨论
本试验采用鸡、兔、蟾蜍红细胞为原材料取材既简单方便又新鲜可行,且一次性采血量较大,可满足大量学生使用,成本不会增加。就融合条件而言,PEG最适浓度为500mL/L,这是由于PEG浓度过高时,其细胞反应液体环境黏滞度过高,可能会阻碍细胞融合。最适温度37℃,高于30℃,这是因为随着温度升高,细胞膜的流动性增强,有益于融合,而过高温度也会使细胞因承受不了高温而失去活性,引起融合率降低。而10min与15min反应时间的融合率差距并不是很大,对红细胞的融合率影响不太明显,融合率不随时间的推移发生显著变化,这是由于PEG诱导细胞的膜间发生接触、黏连,使细胞开始融合,经离心去除PEG后,黏连的细胞便随融合的进程自然进行所致。
PEG法诱导细胞融合以其容易制备、活性稳定、不需要特别的仪器设备、操作方便等优点,被普遍用于生物、遗传、医药等研究领域。因此,对PEG介导细胞融合的最适条件探究显得尤为必要。相信随着研究的不断深入,细胞融合技术的应用领域越来越广[18],产生的影响也日益显著。
[1] 崔彬彬,朱维红,冯大领.细胞融合技术研究进展[J].保定师范专科学校学报,2007,20(2):48-50.
[2] Elizabeth H,Cheneric N,Olson N.Unveiling the mechanisms of cell fusion[J].Science,2005,308:369-373.
[3] 冯 亮.细胞融合技术浅析[J].科海故事博览:科技创新,2009(1):157.
[4] Robinsona C.Analysis of mammary specific gene locus regulation in differentiated cells derived by somatic cell fusion[J].Exp Cell Res,2009,315(3):508-522.
[5] 杨 静,葛日萍.细胞杂交的电融合法与PEG融合法的比较研究[J].广州医学院学报,1995,23(4):4-8.
[6] Chen E H.Foetal fibroblasts introduced to cleaving mouse embryos contribute to full-term development[J].Reproduction,2007,133(1):207-218.
[7] 邓勇军,戎铁华,夏建川.树突状细胞/肿瘤细胞融合疫苗抗肿瘤免疫研究进展[J].肿瘤防治研究,2010,37(5):605-608.
[8] Teles F R.RNA-oligonucleotede quantification technique(ROQT)for the enumeration of uncultivated bacterial species in subgingival biofilms[J].Mol Oral Microbiol,2011,26(2):127-139.
[9] Zhang W,Mc Elhinny A,Nielsen A.Automated brighfield dual-color in situ hybridization for detection of mouse double minute 2gene amplification in sarcomas[J].Appl Immunohistochem Mol Morphol,2011,19(1):54-61.
[10] 鲁云风,杨柯金,杨建伟,等.蟾蜍红细胞融合条件的正交设计优化[J].生物技术,2009,19(6):44-45.
[11] 刘 哲,张 峰,佟丹丹,等.鸡红细胞体外融合最适条件的研究[J].辽东学院学报,2009,16(4):335-337.
[12] 仇 燕,李朝炜,苗 芳.聚乙二醇诱导鸡红细胞融合条件的优化[J].生物技术,2011,21(3):50-53.
[13] 马 云,何 昆,王晓玉,等,PEG诱导鸡红细胞融合影响因素探讨[J].德州学院学报,2011,27(2):54-57.
[14] 张 梅,关 萍,王振东,等.兔红细胞融合条件的正交设计优化研究[J].黑龙江畜牧兽医,2012(3):152-153.
[15] 华小黎,廖 婧,胡丽玲,等,聚乙二醇诱导细胞融合最适条件的筛选[J].中国医院药学杂志,2012,32(5):333-336.
[16] 王金发,何炎明.细胞生物学实验教程[M].北京:科学出版社,2011:150-152.
[17] 李 玟.细胞融合实验方法的改进[J].汕头大学医学院学报,2005,18(3):182-183.
[18] 颜士州.动植物杂交:开创生物新品种[J].发明与创新.2010(6):33-34.
