肿瘤早期检测技术研究现状及最新进展
2012-08-08作者衣丽婷刘静
【作者】衣丽婷,刘静,2*
1 清华大学医学院生物医学工程系,北京,100084
2 中国科学院理化技术研究所,北京,100190
1 肿瘤现状及早期检测的重要意义
近年来,恶性肿瘤已成为全球范围内严重危害人类健康及生命的重大疾病之一。人们谈“癌”色变,并普遍认为癌症为不治之症,这主要源于其治愈率低、死亡率高并具有广泛的分布性。在经济发达国家,癌症已成为使人致死的最主要原因;在发展中国家,癌症的死亡率在所有疾病的死亡率中位居第二位[1-2]。调查数据显示,2008年,全世界的癌症患者约有1270万人,其中死亡人数高达760万[3]。世界卫生组织(WHO)专家预测,癌症将成为人类生命的头号杀手[4]。
迄今,世界各国投入了大量的人力、物力用于肿瘤的预防、诊断和治疗。每年,美国癌症协会都会发布关于肿瘤早期诊断建议的指南[5],包括自检和临床检查的内容。该协会发布的导致全球主要经济损失的前十五位死亡原因[6]中,恶性肿瘤疾病导致的经济损失高居榜首。肿瘤的高致死率主要由于肿瘤细胞具有转移和侵袭能力,约90%肿瘤病人的死亡源于肿瘤的转移,然而早期的治疗干预则会提高治疗效果[7]。在肿瘤确诊之前若病灶已发生多处微小转移,即使有些恶性肿瘤如睾丸癌仍可能治愈,但希望大大降低[8]。由此看来,早期诊断和治疗对于提升肿瘤病人生存率具有至关重要的意义。发展中国家肿瘤患者的死亡率要高于经济发达国家,极有可能的原因就在于诊断不及时;此外,疾病普查范围小,在治疗时间和技术水平上存在局限性也是重要因素[9]。
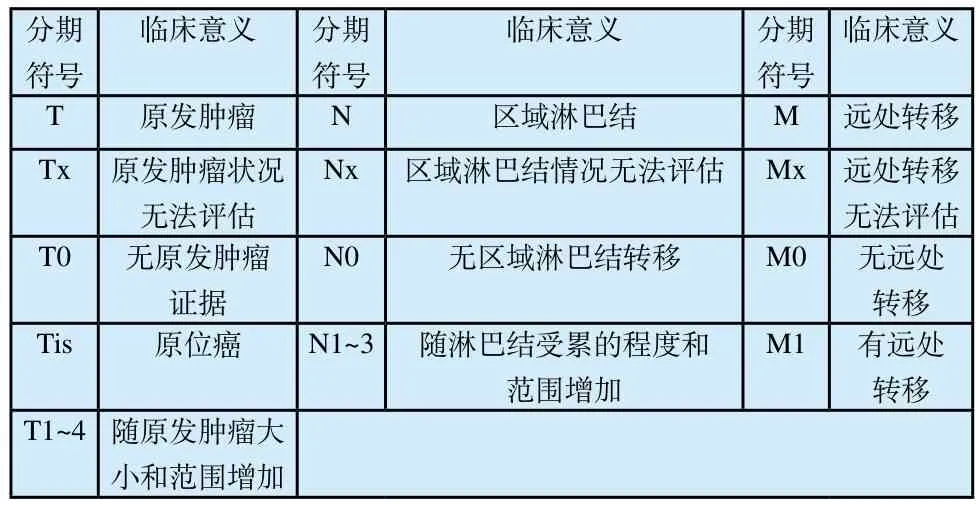
表1 TNM分期及临床意义Tab.1 TNM classification and clinical significance
肿瘤是一组复杂的疾病,从微观的基因变异,到宏观的器官侵害,不同病例之间存在着相似和差异。为了更好的描述恶性肿瘤的发展程度,便于医生对病情的掌握及病人对自身病况的认知,临床上采用肿瘤的分期系统来对此进行分类、划分。目前,国际上普遍采用也相对成熟的分期系统为TNM分期系统(表1)[4],[8],系美国癌症联合委员会(AJCC)和国际抗癌联盟(UICC)所建立,其中的具体分期随着研究的不断深入有所更新和调整。TNM分期分为临床分期和病理分期。在某些部位,还可以进一步分级。部分国家和地区对于某类肿瘤也存在着不同的分类方法。根据检测确定TNM中的T、N、M后,即可得出相应的总分期,即I期、II期、III期等,不同部位肿瘤的T、N、M中对应的总分期也略有差异[10]。国内学者公认I期属于肿瘤早期,治疗和预后都有较好效果。分期级别越高,肿瘤进展程度越高。
当前一些较为常用的检测手段,如X线、超声、PET-CT、核磁共振成像等影像方法在肿瘤诊断方面的作用是值得肯定的,但由于准确度等问题,它们在临床应用上仍存在局限性,有时甚至会与病理诊断结果存在出入。并且如核磁共振这一类检测对于一般家庭而言,多次检测所需的费用是无法承受的,这也就导致了在肿瘤检测时间上的延误;一些有一定放射性的检测方法,如X线、CT、PET或其组合,也不适于频繁检测;而通过穿刺获取病人组织样品并进行组织化学分析这一方法,耗时长、操作复杂且对病人损害较大。相比而言,肿瘤早期检测期望实现具有对正常人群及疑似患病人群初步诊断并允许频繁检测的目标,从这些角度来看,以上方法均不适合作为广泛人群肿瘤早期检测。
发展低成本、易操作、便携式、低损伤、高准确性和快速的肿瘤早期检测方法为当前所急需。相应方法的成功实现,将会对肿瘤病人治疗方案的制定提供有价值的信息资料,并且能对经过治疗的肿瘤病人病情起到即时的监测作用,保证最佳的治疗期,而这一点是传统检测方法所难以实现的。
2 肿瘤早期检测的切入点
实现肿瘤早期检测的首要任务就是要揭示肿瘤细胞与正常细胞,以及肿瘤组织与正常组织的区别,以此作为制定检测方案的依据。本文将从两方面进行评述:生物学特性,包括肿瘤细胞与正常细胞的本质差异、导致差异产生的根本原因;物理学特性,相应技术发展成熟,可望使整个检测过程简化、可靠。
2.1 肿瘤细胞的生物学特点
人类肿瘤细胞在发展的多阶段,表现出多种不同于正常细胞的生物学特征[14],这些特征主要保障和完成肿瘤的无限增殖功能和侵袭转移至其他身体部位的能力。正常的细胞经过程序性的调控,最终会走向凋亡,而肿瘤细胞由于基因的改变,生长不受限制,能跳过凋亡阶段,不断获取营养,不断增殖和代谢。
(1) 基因标记物
细胞发生癌变的本质为细胞内遗传物质的改变。所有人类体内都存在癌基因,癌症病人与健康人群的区别在于癌症病人的癌基因异常表达,抑癌基因丢失或失去活性。例如,结肠癌是因正常的上皮细胞发生APC基因的丧失或突变,DNA甲基化异常,Ras基因突变和DCC、p53基因丧失等基因改变而形成肿瘤。随着PCR方法的普及与发展,利用基因扩增检测异常基因的方法已有越来越广泛的应用。
(2) 蛋白质生物标记物
蛋白质是基因的产物,正常细胞发生癌变,基因异常表达,对应编码的蛋白质也会随之改变。大量研究表明,一些蛋白质在肿瘤组织中的表达高于正常组织表达水平。这些蛋白质生物标记物的出现已成为诊断肿瘤疾病的重要工具[15]。检测的基本原理主要为肿瘤特异性抗原与其对应抗体特异性结合。另外,通过蛋白质组学与其他技术的结合也是目前常用检测方法,如凝胶电泳、液相层析、质谱和核磁共振技术等。不同肿瘤细胞表达的生物标记物的种类和含量也有所不同,例如,PSA为前列腺癌的生物标记物,前列腺癌患者血清中PSA会有所升高;CA125为卵巢癌的生物标记物;AFP为肝癌的标记物等。表2中列出的是已知用于肿瘤诊断和预后的标记物[16]。在肿瘤检测中,这些常用的肿瘤标记物都有对应的阈值[17][18]。肿瘤蛋白质标记物的检测已作为医院判断病人是否患有肿瘤的常用辅助手段。
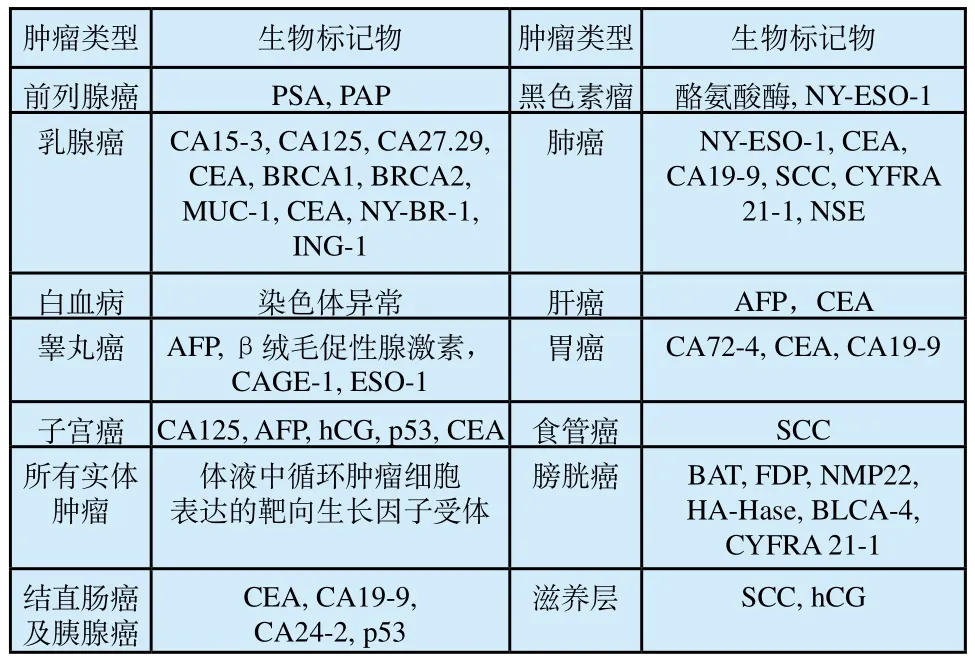
表2 已知与肿瘤诊断和预后相关的生物标记物[16]Tab.2 Known biomarker associated with cancer diagnosis and prognosis
2.2 肿瘤细胞的物理特性
肿瘤细胞在遗传因素或环境因素的作用下,基因、细胞结构发生改变,这种变化会导致其物理性质与正常细胞产生差异,也因如此,人们可以采用物理方法对肿瘤细胞进行检测。图1为肿瘤细胞接受信息的变化、肿瘤细胞结构改变以及与物理性质变化间的关系图,粗框内特性为可用以检测的物理量。针对这些物理量,已有大量的文献对应做出研究,例如,密度的改变可用密度梯度方法进行分离;细胞大小和变形性的改变可以用过滤的方法进行分选;气味的改变可以通过具有灵敏嗅觉的动物进行辨别等。以下对此分别讨论。
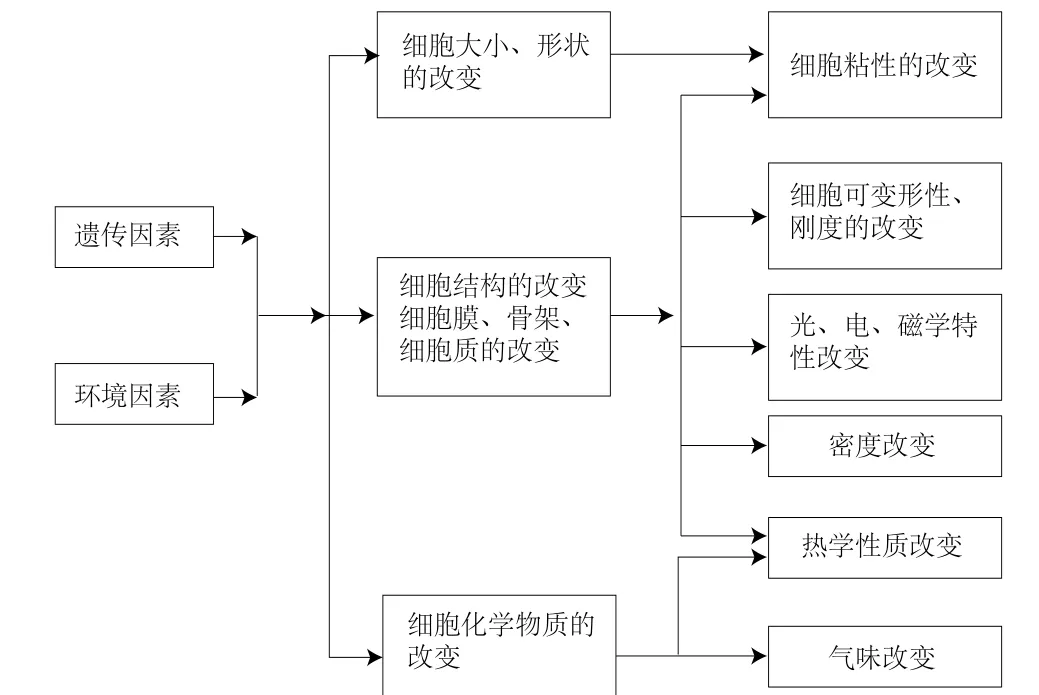
图1 肿瘤物理性质的改变Fig.1 Changes in physical properties of cancer cells
3 肿瘤检测的方法
3.1 典型途径
一般情况下,临床上肿瘤的常规诊疗流程[5]如图2所示。病人到医院就诊,医生通过询问家族病史、触诊、身体检查等环节做出初步判断。如果病情严重,有明显病变迹象,则需要直接在疑似部位取组织标本,穿刺活体检查,通过细胞生物学变化、病理学特征确诊。经体检后,如果疾病表象不明显,则需要继续进行常规检查,如血常规、尿常规、粪便潜血检查和肿瘤标记物等生化检查,以及初步的影像方法——B超、胸部X线等。若有必要,需要做更细致的特殊检查,包括CT、MRI、内镜和PET-CT等。如果这些较深入的检测方法证明肿瘤发生的可能性很大,则仍需要进一步穿刺活检。

图2 临床上肿瘤常规诊疗流程图Fig.2 Flow chart of cancer clinical diagnosis
近年来,肿瘤生物标记物的检测成为肿瘤检测的一大热点,随着蛋白质组学技术的发展,其在标记物的发现和早期诊断方面都作出了巨大贡献。生物学方面常用的技术有ELISA、2D-PAGE、多维蛋白质识别技术、蛋白质组学模式识别和蛋白质微阵列技术[19]。这些技术有的对于蛋白质样品需求量大,有的对肿瘤标记物抗体的敏感性有高要求,更重要的是这些方法耗时长,对操作者有较高的要求,且需要体积较大的辅助设备。
肿瘤影像检测无论是在实验室研究还是临床检测方面都起到了不可或缺的作用。影像资料提供的信息,可以辅助医生确定肿瘤的发生位置、大小、增殖和代谢等情况。过去的三十年,出现了大量的肿瘤分子影像检测方法并且得以广泛应用[20]。这些方法包括超声成像(ultrasonography)、光学成像、X线计算机断层成像(CT)、磁共振成象(MRI)、单光子发射断层成像(SPECT)与正电子发射断层成像(PET)等技术。近些年来,各种影像诊断技术已经有很大的进步,但在发挥独特优势的同时仍存在难以克服的缺陷。
3.2 肿瘤检测对象
肿瘤检测大体上可以分为两类:在体检测和体外检测。上文提到的影像技术大部分都是针对在体检测,优点是可以实现无损检测,但一般价格昂贵,病人只能到大型医院检查。体外检测划分种类较多,根据检测对象不同,主要包括:穿刺活检组织检测、体液、排泄物和分泌物检测等。其中体液检测又包括血液、唾液、尿液的检测。具体到实际检测的物质又分为基因、蛋白质和细胞的检测。外周循环血液中的循环肿瘤细胞(Circulating tumor cells, CTC)与蛋白质肿瘤生物标记物用成熟的物理方法检测较为简单,所以下文着重介绍这两种物质的检测方法。已有研究表明,多种上皮肿瘤都会向循环系统中释放CTC,如乳腺癌、膀胱癌、前列腺癌、直肠癌、宫颈癌和胰腺癌等。CTC可以提供有价值的临床信息,包括肿瘤复发的早期检测、监测辅助治疗的有效性和作为独立的预后因素。当上皮性肿瘤细胞进入循环中,也许大多数人会认为癌症已发生了转移,但实际并不总是这样,例如,尽管有的乳腺癌患者出现CTC表明预后效果很差,但这不代表癌症肯定发生了转移[21]。在恶性转移乳腺癌病人中CTC的数量若每7.5毫升超过5个癌细胞,则要比低于这一数值病人的生存率低很多[14]。病人所患癌症为原发性或转移性,外周血中CTC含量的增加,表示有可能将发生转移或得到很差的预后。CTC在血液中的含量十分微少,这就增加了检测的难度。如下将介绍几种目前分离CTC较有效的方法。
3.3 密度梯度离心
传统方法通过密度梯度离心分离单核细胞。由于同类肿瘤细胞具有接近的浮力密度,且该浮力密度与血液中的其他血细胞不同,所以设置不同的浓度梯度,也可以将肿瘤细胞加以分离。接下来对分离的肿瘤细胞上的生物标记物进行免疫化学染色,在荧光显微镜下识别肿瘤细胞[22-24]。图3为利用密度梯度离心原理,商业化分离血液中肿瘤细胞的方法——Oncoquick®[25]。该离心管具有一层多孔膜,管底部填充分离介质,经过离心后,密度较低的细胞,包括上皮细胞、肿瘤细胞和血小板的细胞被分离到管的上部,大部分的淋巴细胞和红细胞被分离到下层。这种方法操作简单,但肿瘤细胞可能会在血浆层有所残留,而且可能被红细胞等粘附,误差较大。所以,仅靠此方法分离肿瘤细胞,检测准确度较低,适合作为肿瘤细胞的初级分离。

图3 Oncoquick®,商业化分离CTC的方法[25]Fig.3 Oncoquick®.a commercially available method to isolate CTC.
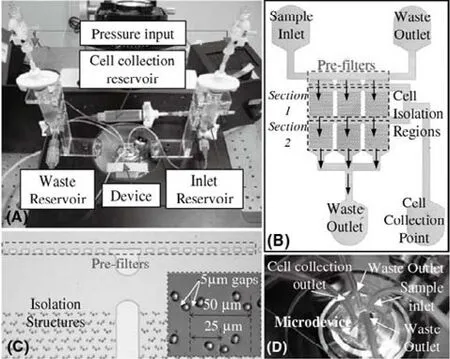
图4 分离肿瘤细胞的微流体装置[32](A)安装在倒置显微镜上的实验平台;(B)微装置的轮廓图;(C)初过滤部分的放大照片,及细胞分离结构的排布;(D)微流体的流体连接处。Fig.4 Microdevice for cancer cell isolation and enumeration.(A)Custom made experimental setup mounted on the inverted microscope.(B)Microdevice layout.(C)Enlarged view of pre- filters and arrays of cell isolation wells.(D)Fluidic connections to microdevice.
3.4 根据肿瘤细胞大小、刚度分离
肿瘤细胞与血液其他细胞的大小和刚度不同[26-27],利用该物理性质对血液中肿瘤细胞进行分离,是一种不需要标记的、较有效的方法。早在1964年,Seal第一次提出利用过滤的方法可以将肿瘤细胞从外周血中分离出来[28]。血细胞的典型尺寸如下:红细胞的直径范围为5~9 μm。早期研究表明,由于红细胞的可变形性,当滤孔直径仅大于3.3 μm时,人体正常红细胞即可以100%穿过[29];粒性白细胞的直径为10~15 μm;淋巴细胞的直径为7~18 μm;单核细胞的直径为12~20 μm[30]。而肿瘤细胞,如MCF-7的直径约为22.5 μm,NCI-H358直径约为18.1 μm,AGS直径约为14.9 μm,LNCaP细胞系测量直径为17±1.5 μm,大于大多数血细胞的直径[31]。根据细胞直径和刚度的不同,可以设计一定直径的滤孔,实现肿瘤细胞的分离。从各类细胞直径数值可以看出,肿瘤细胞与白细胞的直径数值有重叠处。为了解决这一问题,有的实验结合荧光染色的方法,或电裂解细胞后进行PCR扩增[31]等方法,区分这两种细胞;而有的研究如图4所示,通过白细胞变形能力强于肿瘤细胞,设计过滤缺口的方法进行分离,初过滤部分缺口的长度为20 μm,阻止细胞团块的进入,相邻分离层之间位移为25 μm,以此增加捕获率。通过几级筛孔的分离过滤,最终实现获得肿瘤细胞的目的。这种方法对乳腺癌细胞和结直肠癌细胞的分离效率可达80%[32]。一些利用生物标记物进行分离的方法,特异性不是很强,此时利用细胞的大小和变形性的分离方法就显示出其优势。这种方法简单,对细胞伤害性小,且由于不需要被固定,可以利用分离的细胞进一步研究。
3.5 抗原—抗体特异性结合分离法
虽然抗原抗体结合属于化学反应,目前大多数肿瘤细胞的分离方法或多或少都会涉及到抗原抗体免疫性特异结合。该方法应用广泛,且已有大量的研究。目前,研究中应用最成功的就是EpCAM,这种蛋白质一般在正常细胞很少表达。在市场上,商业化的检测肿瘤细胞的方法——CellSearch技术早已通过FDA认可。它是第一个实现CTC的检测和计数的技术,可以用于监测乳腺癌、直肠癌和前列腺癌等转移癌症病人的病情。其原理主要是利用连接EpCAM抗体的磁性珠子与肿瘤细胞发生特异性结合,通过免疫磁性分离。EpCAM在大多数的上皮肿瘤细胞表面有过量表达;CK在正常细胞的表达范围在0%~20%[33];但与血细胞相比缺乏CD45。因此,通过染色,若表型为EpCAM+、CK+、DAPI+、CD45-,则可确定为CTC。但由于肿瘤存在异质性,CellSearch技术在多个研究报道中敏感性不一,降低了其在临床的使用价值,仍需要进一步研究。

图5 分离全血中CTC的微流体装置[34, 35]左:(A)分离CTC的工作站;(B)全血流经微流体装置;(C)蚀刻在硅上的带有微柱的CTC芯片;(D)微流体装置捕捉到的加入全血中的NCI-H1650肺癌细胞的电子扫描照片。右:在左图芯片基础上发展的新一代人字形芯片。Fig.5 Isolation of CTCs from whole blood using a micro fluidic device.Left: (A)The workstation setup for CTC separation.(B)The CTC-chip with microposts etched in silicon.(C)Whole blood flowing through the micro fluidic device.(D)Scanning electron microscope image of a captured NCI-H1650 lung cancer cell spiked into blood.Right: A new generation herring-chip developed on the basis of the device on the left.
Haber及其小组同样利用EpCAM研究出一种分离CTC的微流体装置(图5),微流体装置的微柱上固定有EpCAM抗体,实验通过控制流速和剪切力大小,将血液中的肿瘤细胞从血液富集到微流体芯片上。这种方法能从血液中近十亿的血细胞中,分离出一个肿瘤细胞[34]。去年,该研究组重新改善这种微流体平台,达到商业化规格,且细胞捕获率也有所改善[35]。今年1月,有相应医疗设备及诊断公司计划与该团队合作,期待利用该方法研究出像家庭验孕这样简单的早期诊断装置[36]。不过,该方法虽然可以成功地将活的CTC成功分离出来,但是由于细胞固定在装置上,很难再次选择和利用。
有研究方法可以同时分离两种生物标记物——PSA和CA15-3[15],PSA是前列腺癌的生物标记物,CA15-3主要检测乳腺癌。该方法能够释放结合了抗体的肿瘤生物标记物,并利用纳米传感器定量检测。免疫特异性结合分离的方法,主要是利用肿瘤细胞和正常细胞表达的蛋白质不同,实验研究常用肿瘤生物标记物的抗原分离肿瘤细胞,表2中各肿瘤类型对应的标记物可用来检测该疾病,且分别已有大量研究。抗原抗体特异性结合的检测原理一般不作为单独的检测手段,而是作为其他检测手段的一种辅助检测方法。
3.6 电学方法
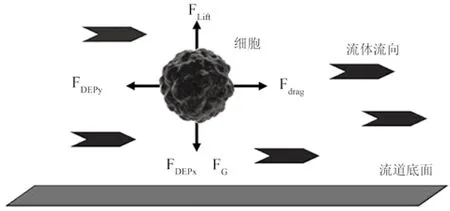
图6 细胞在介电亲和性通道内流动过程受力情况。重力(FG),介电力(FDEPx ,FDEPy),流体动力水平阻力(Fdrag)和浮力(FLift)Fig.6 Forces affecting cells within the dielectric affinity column: gravity(FG),dielectrophoresis(FDEPx, FDEPy), fluid drag(Fdrag)and hydrodynamic lift effects(FLift).
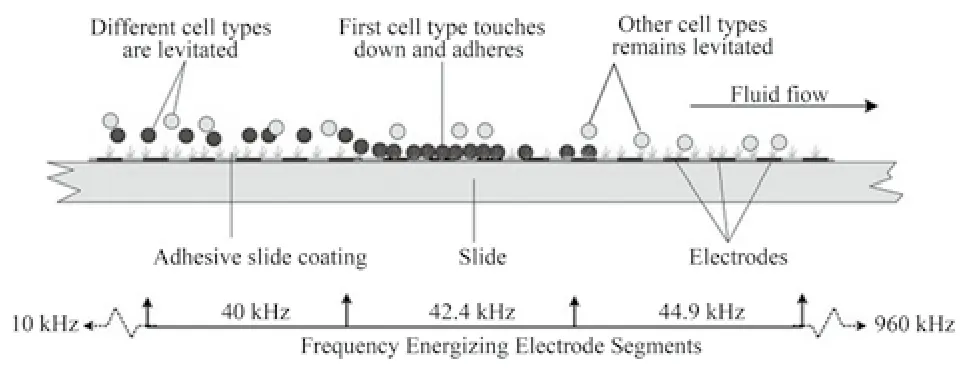
图7 根据介电性质分离肿瘤细胞[44]Fig.7 Isolating tumor cells by dielectrophoresis.
肿瘤细胞是变异了的正常细胞,电学性质方面也会有所差异。在当今生物医学工程领域,毫米或纳米级颗粒介电性的研究引起广泛关注。有研究对淋巴瘤细胞和骨髓瘤细胞的阻抗进行测量,通过实验数据来评价细胞的介电性,发现较低的特异性膜电容是恶性肿瘤显著的特点,行波介电泳的频率在1 MHz以上可实现这两种细胞的分离,并保持这两种细胞的活性[37]。细胞电荷性质的特异性不足以在不同的细胞混合物中作为区分方法,所以采用介电泳方法。介电泳方法通过改变电场激发微电极,从而吸引或排斥细胞,不同形态、大小的细胞在分离过程中受到介电力作用,电场的变化改变细胞整体受力情况[38~40],如图6所示。有很多研究利用介电泳的方法对不同的细胞进行分离,同样这一方法也被用来分离肿瘤细胞,有研究者已成功将乳腺癌细胞同血液中其他细胞分离开来[41~43]。如图7所示,分离过程中,在一定的流速下,细胞在入口处低频电信号的作用下受到排斥的介电泳作用力,防止细胞下沉并粘附在平面上;随着细胞的流动,电极激发频率增加,浮力减小,细胞在对应其介电特性的位置下沉停滞下来。该方法根据不同形态细胞的介电性质,在不同的频率下,细胞粘附在通道的特定位置上,以此将肿瘤细胞分离。肿瘤细胞的分离频率为40~60 kHz,这一部分的细胞依据它们是否在分裂期、细胞大小和复杂度来分离。受损的肿瘤细胞分离频率为60~120 kHz,粒细胞为70~90 kHz,淋巴细胞为85~105 kHz,红细胞分离频率为大于140 kHz[44]。介电泳分离方法虽然简单,但不同种类的肿瘤细胞的介电性质存在差异,对应的电信号频率也不同,仅就此而言,这种方法存在一定的局限性。循环肿瘤细胞在血液中的相对数量十分稀少,检测效率较低。介电泳方法为肿瘤细胞的分离方法,不进行细胞计数,为了确保细胞为肿瘤细胞还要进一步的病理检测,并与其他细胞计数方法联合使用。例如有研究者利用单克隆抗体将CTC富集在微流体芯片上,通过电导率的方法对捕获的肿瘤细胞进行计数等[45-46]。
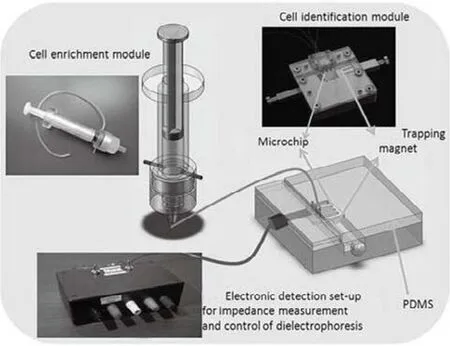
图8 整体系统方案设计[47]Fig.8 Schematic design of the integrated system.
阻抗检测也是一种常见的测量方式。图8是一种测量CTC的半集成电学生物传感器[47]。肿瘤细胞样品先经过免疫磁珠和过滤进行初分离,然后导入微芯片进一步免疫化学富集,通过阻抗谱学实现电子检测。这一方法不需要抗体标记、荧光染色,也不需要影像分析。斯坦福大学的研究者们用阻抗法对DNA、蛋白质和细胞的分离均进行过研究。他们通过设计微流道的方法,在微流道内固定与被检测体可以特异性结合的物质,其他未结合的物质将被冲洗掉,测量微通道的电阻,从而确定是否存在被检测物质,被检测物质的数量,同时起到分离的作用[48~50]。
除此之外,电学性质的改变还可以通过检测肿瘤标记物的电容性刻画[51]。从Mirsky 1997年的工作开始,电容方法测量化学、生化反应得以发展[52]。通过电学方法检测的重点是提高检测敏感度、稳定性和准确度。如果要发展电学检测肿瘤这一技术,那么提高这些标准是必经之路。
3.7 光学检测方法
光学方法检测是生物学上常用的检测方法,包括荧光、干涉、热透镜、表面离子共振和化学发光等。这些方法已在一些生物、化学物质检测上得到实现,其检测原理及特异性,在肿瘤检测上也发挥着重要作用。对于荧光标记的肿瘤细胞,自动数字显微镜(ADM)可作为一种可靠的检测手段[53-54],检测率可以达到每秒800个细胞。但对于血液中大量的细胞而言,这种速度是不够的。Krivacic等人选择一种光纤阵列扫描技术(FAST),其检测率是ADM的500倍,且具有较高的敏感性,特异性也有所提高[55]。微流体技术的发展,为光学检测提供了便利。集成化的微流体光学检测系统,在一定意义上简化了整个光学检测过程。
3.8 其他肿瘤检测新方法
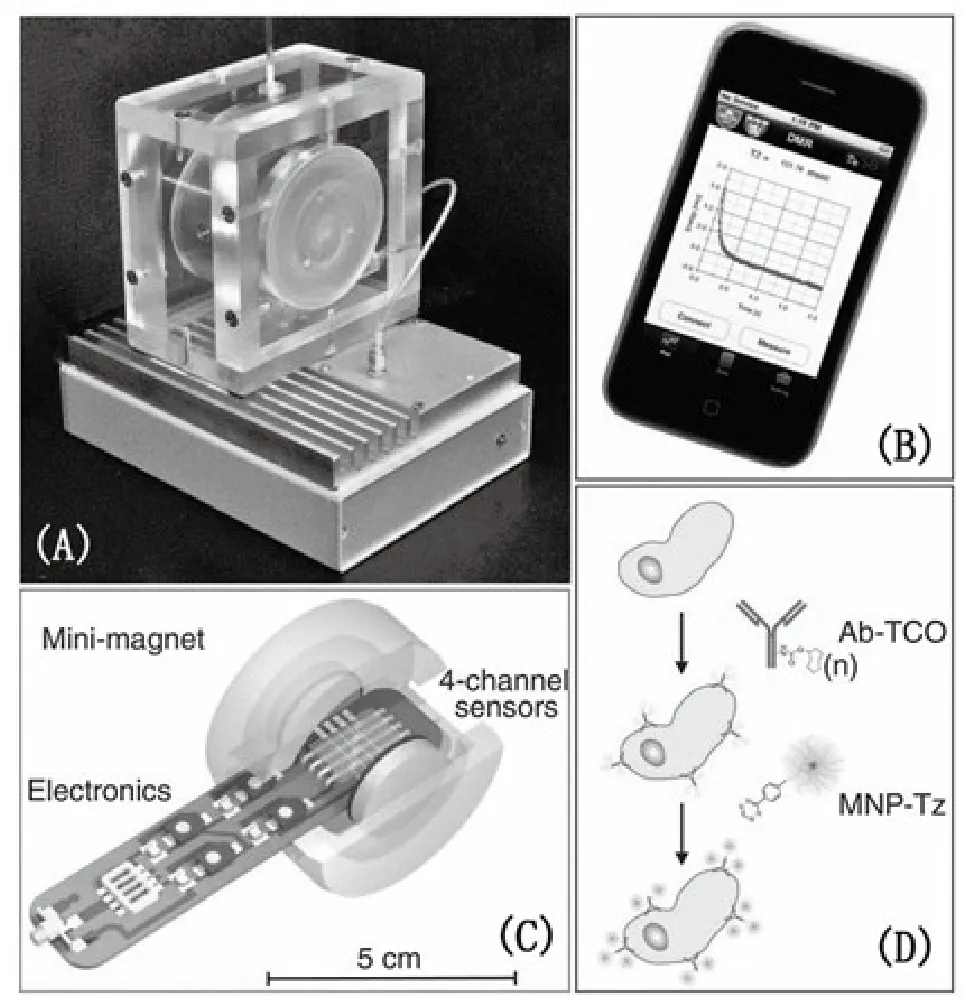
图9 μNMR临床分析系统[56](A)病人床边完整μNMR系统;(B)操作μNMR系统的智能手机界面;(C)内置微磁体的μNMR探针;(D)对病人穿刺获得细胞的生物处理。Fig.9 The μNMR clinical analysis system.(A)Complete μNMR system for use at the patient′ s bedside.(B)Smart phone interface for operating the μNMR system.(C)State-of-the-art μNMR probe used for sensing with the mini magnet.(D)Fine-needle aspirates from each patient sample were processed.
肿瘤检测是目前临床检测的热点。近年来,一些独特、创新且优势突出的检测方法不断涌现。美国麻省总医院的研究者们发明了一种利用微型NMR快速、多参数检测人类肿瘤细胞的方法[56]。图9所示为实现该检测方法的系统。容易看出其简单、易操作性体现在装置的小型化,仅手机系统就可达到控制装置和输出结果的效果。该小组实现了对来自50个病人活体穿刺组织的临床分析,并通过其他20位病人验证了实验结果。仅生物穿刺就可以获得足够数量的细胞,实现60分钟内对9种蛋白质标记物的分析。除此之外,该小组通过此技术对四种蛋白质标记物定性定量检测,在肿瘤诊断中达到96%的准确率,优于目前传统免疫化学临床分析结果。研究结果表明,蛋白质随着时间很快就会降解,这也就要求有快速的检测过程,最好可以在病患的床边检测。由于蛋白质的表达水平的原因,对于不同的病人即使是同一种肿瘤都具有异质性,这就对分子诊断和药物靶向治疗有很大的影响。该研究提出的这种定性的point-of-care微NMR技术在肿瘤的临床检测方面具有较大潜力。
3.9 结合纳米技术的肿瘤检测
纳米技术是近年来出现的高新技术,在过去的几年里得到了飞速发展,已成功应用到许多领域,包括医学、药学、化学及制造业等。纳米颗粒具有独特的光学、电学、化学、机械和物理性质,这在解决医学检测方面的难题上起到了巨大的促进作用。纳米材料根据材质和形状不同可分为很多种,如金纳米颗粒、磁纳米颗粒、碳纳米管、纳米孔和微悬臂等。不同的纳米颗粒具有不同的特性,因此应用的范围也有所差异。
金纳米颗粒由于其生物光学特性,在肿瘤细胞检测过程中,与肿瘤细胞相连,可作为光学标记物。金纳米颗粒膜电极在肿瘤生物标记物的检测过程中也起到一定作用。肿瘤细胞的检测信号不强,利用金纳米颗粒可以实现信号的放大。肿瘤病人和健康人的呼吸成分有所不同,据此进行诊断肺癌的研究。Peng等设计了9个交叉反应的化学阻抗传感器阵列,每一个传感器都能通过呼吸监测肺癌的方法检测到多种气体物质。这种化学阻抗传感器采用不同有机修饰的5 nm的金纳米颗粒。对于肺癌标记物,传感器反应灵敏,并且可检测多种浓度[57]。被检测的生物颗粒与固体界面的接触是很重要的,只有足够的接触才能达到足够的结合,有研究者利用碳纳米管,在芯片内建造碳纳米管“森林”,从而提高了微量检测物质的检测效率[58],充分利用了碳纳米管的尺寸和物理特性。
纳米孔内连接对应肿瘤标记物的抗体,当肿瘤标记物通过纳米孔,抗原抗体特异性结合,则引起阻抗的改变,检测阻抗的变化可确定肿瘤标记物的浓度[59]。鉴于纳米材料的优点,未来研究中应用纳米颗粒到检测中,在提高检测敏感性等方面仍值得挖掘。
4 肿瘤检测面临的问题与未来发展
如上所述,关于肿瘤检测的研究新的方法层出不穷,可喜进展。虽然它们各自具有独特的检测优势,但仍暴露出一些问题,影响肿瘤细胞的检测准确度、敏感性和特异性等结果。大量的研究根据肿瘤的上皮抗原进行分离,并且认为EpCAM是目前最优的肿瘤生物标记物,但有研究表明大多数恶性肿瘤的CTC会丢失上皮抗原。这就意味着这种方法有可能会漏检具有侵害性的CTC。事实上,研究发现134种组织类型不同的肿瘤细胞只有70%表达EpCAM[60]。一些抗原抗体在没有进行孵育的情况下很难反应,导致低敏感性和假阳性[61]。目前,尚没有一种100%特异性的肿瘤生物标记物。肿瘤细胞体积小、数量稀少,与正常细胞的整体差异不是特别明显,且不同部位的肿瘤及不同病人的同部位肿瘤的性质也可能有所不同,这都增加了检测的难度,它们恰恰是未来需要解决的。
从目前对肿瘤检测装置的研发趋势来看,人们越来越倾向于将检测装置予以微型化,微流体芯片就是其中颇具代表性的成果。此外,其他领域新技术的出现,也会带动肿瘤检测技术的进步,尤其是传感器、纳米技术等的介入更是如此。当然,如今应用于其他领域而同样适用于肿瘤检测的物质、方法或装置尚未被发现,这也是有待探索的一个方向。总体上,不局限于现有技术,充分地将多种在各自方面效能突出的方法结合起来,实现多模式的综合检测,不增加整个过程的复杂程度,完成高效、准确、低成本的检测过程是未来的研究重点。
5 小结
肿瘤早期检测长期困扰着致力于该领域的研究者们。本文深入讨论了该领域的最新进展,可以看到,大部分检测过程并不限于采用一种方法。例如,有些方法是通过密度梯度离心、电泳、抗原抗体、过滤等单一途径分离肿瘤细胞,然后再结合其他电学、化学、光学方法来确定肿瘤细胞数量。但在分离肿瘤细胞的过程中,单一方法有缺陷,需要多种方法结合才能准确分离肿瘤细胞,所以实验的研究定位在肿瘤的多模式检测上。目前应用于临床的肿瘤细胞分离方法几乎都不成熟,从这方面来讲,过往的研究方法仍需要改进,特别是新的检测理念和方法在未来的研究中至关重要。为了更简单的实现肿瘤分离,在研究过程中应将多种物理检测方法加以结合,实现多模式的检测。研究方法的组合,可以起到一加一大于二的效果,也令整个过程更加准确。该领域的最终目标是实现将肿瘤发现于早期,并予以及时治疗,从而缓解乃至解决这一人类所面临的重大难题。
[1]World Health Organization.The Global B of D: 2004 Update [M].Geneva: World Health Organization, 2008.
[2]赵平, 孔灵芝.中国肿瘤死亡报告-全国第三次死因回顾抽样调查[M].北京: 人民卫生出版社, 2010.
[3]World Health Organization Databank.WHO Statistical Information System[M].Geneva.http://www.who.int/en/, 2011-6-21.
[4]唐劲天, 郭亚军, 顾晋, 等.临床肿瘤学概论[M].北京: 清华大学出版社, 2011.
[5]Smith R A, Cokkinides V, Brooks D, et al.Cancer screening in the United States [J].2010.CA.Cancer J.Clin., 2010, 60:99-119.
[6]RioJ M, Hana R.The global economic cost of cancer [M].American Cancer Society, 2010.
[7]Cristofanilli M, Medndelsohn J.Circulating tumor cells in breast cancer: Advanced tools for “tailored” therapy [J].Proc Natl Acad Sci, 2006, 103(46): 17073-17074.
[8]波洛克,等著.孙燕, 汤钊猷译.UICC临床肿瘤学手册[M].北京:人民卫生出版社, 2006.
[9]Jemal A, Bray F, Melissa M.Global cancer statistics [J].CA Cancer J Clin, 2011, 61: 69-90.
[10]Edge S B, Byrd D R, Compton C C, et al.AJCC Cancer Staging Manual [M].7th ed.New York: Springer-Verlag, 2009
[11]National Cancer Institute.Surveillance Epidemiology and End Results Program [EB/OL].http://seer.cancer.gov/, 2011-6-22.
[12]Etzioni R, Urban N, Ramsey S, et al.The case for early detection [J].Nature Rev Cancer, 2003, 3: 243-252.
[13]Mathers C D, Loncar D.Projections of global mortality and burden of disease from 2002 to 2030 [J].PLoS Med, 2006, 3: e442.
[14]Hanahan D, Weinberg R A.The hallmarks of cancer [J].Cell, 2011,144(5): 646-674.
[15]Stern E, Vacic A, Rajan N K, Criscione J M, et al.Label-free biomarker detection from whole blood [J].Nature Nanotechnology,2009: 12-13.
[16]Tothill I E.Biosensors for cancer markers diagnosis [J].Seminars in Cell&Developmental Biology, 2009, 20(1): 55-62.
[17]Wu J, Fu Z, Yan F, Ju H.Biomedical and clinical applications of immunoassays and immunosensors for tumor markers [J].Trends Anal Chem, 2007, 26: 679-688.
[18]Wu J, Fu Z, Yan F, Ju H.A disposable two-throughput electrochemical immunosensor chip for simultaneous multianalyte determination of tumor markers [J].Biosens Bioelectron, 2007,23(1): 114-120.
[19]Wulfkuhle J D, Liotta L A, Petricoin E F.Proteomic applications for the early detection of cancer [J].Nat Rev Cancer, 2003, 3: 267-275.
[20]Weissleder R, Pittet M.Imaging in the era of molecular oncology[J].Nature, 2008, 452: 580-589.
[21]Jonathan W U.One-stop shop [J].Nature Reviews Molecular Cell Biology, 2010, 463(11): 1168.
[22]Baker M K, Mikhitarian K, Walid O, et al.Molecular detection of breast cancer cells in the peripheral blood of advanced-stage breast cancer patients using multimaker real-time reverse transcriptionpolymerase chain reaction and a novel porous barrier density gradient centrifugation technology [J].Clin.Cancer Res, 2003, 9:4865-4871.
[23]Lara O, Tong X D, Zborowski M, et al.Enrichment of rare cancer cells through depletion of normal cells using density and flowthrough, immunomagnetic cells separation [J].Exp.Hematology,2004, 32(10): 891-904.
[24]Pantel K, Brakenhoff R H.Dissecting the metastatic cascade [J].Nat Rev Cancer, 2004, 4: 448-456.
[25]Brechot P P, Benali N L.Circulating tumor cells (CTC) detection:Clinical impact and future directions [J].Cancer Letters, 2007,253(2): 180-204.
[26]Kuo J S, Zhao Y X, Schiro P G, et al.Deformability considerations in filtration of biological cells [J].Lab Chip, 2010, 10: 837-842.
[27]Hosoawa M, Hayata T, Fukuda Y, et al.Size-selective microcavity array for rapid and efficient detection of circulating tumor cells [J].Anal.Chem., 2010, 82(15): 6629-6635.
[28]Seal S H.A sieve for the isolation of cancer cells and other large cells from the blood [J].Cancer, 1964, 17(5): 637-642.
[29]Chien S, Usami S, Dellenba R J, et al.Shear-dependent deformation of erythrocytes in rheology of human blood [J].Am.J.Physiol,1970, 219(1): 136-142.
[30]Shapiro H M, Schildkraut E R, Curbelo R, et al.Combined blood cell counting and classification with fluorochrome stains and flow instrumentation [J].J Histochem Cytochem, 1976, 24(1): 396-401.
[31]Zheng S Y, Lin H, Liu J Q, et al.Membrane microfilter device for selective capture, electrolysis and genomic analysis of human circulating tumor cells [J].Journal of Chromatography A, 2007,1162(2): 154-161.
[32]Tan S J, Yobas l, Lee G Y H, et al.Microdevice for the isolation and enumeration of cancer cells from blood [J].Biomed Microdevices,2009, 11: 883-892.
[33]Fehm T, Solomayer E F, Meng S, et al.Methods for isolation circulating epithelial cells and criteria for their classification as carcinoma cells [J].Cytotherapy, 2005, 7: 171-185.
[34]Nagrath S, Sequist L V, Maheswaran S, et al.Isolation of circulating tumor cells in cancer patients by microchip technology[J].Nature, 2007, 450: 1235-1239.
[35]Stott S L, Hsu C H, Tsukrov D I, et al.Isolation of circulating tumor cells using a microvortex-generating herringbone-chip [J].Proc Natl Acad Sci, 2010, 107(43): 18392-18397.
[36]Dolgin E.New technologies aim to take cancer out of circulation [J].Nat Med, 2011, 17(3): 26.
[37]Cen E G, Dalton C, Li Y L, et al.A combined dielectrophoresis,traveling wave dielectrophoresis and electrorotation microchip for the manipulation and characterization of human malignant cells [J].J Microbiol Methods, 2004, 58(3): 387-401.
[38]Becker F F, Wang X B, Huang Y, et al.Separation of human breast cancer cells from blood by different dielectric affinity [J].Proc Natl Acad Sci, 1995, 92(3): 860-864.
[39]Gascoyne P R C, Wang X B, Huang Y, et al.Dielectrophoretic separation of cancer cells from blood [J].IEEE Industry Applications Society, 1997, 33(3): 670-678.
[40]Gascoyne P R C, Noshari J, Anderson T J, et al.Isolation of rare cells from cell mixtures by dielectrophoresis [J].Electrophoresis,2009, 30: 1388-1398.
[41]Cristofanilli M, Krishnamurthy S, Das C M, et al.Dielectric cell separation of fine needle aspirates from tumor xenografts [J].J Sep.Sci, 2008, 31: 3732-3739.
[42]Das C M, Becker F, Vernon S, et al.Dielectrophorephic segregation of different human cell types on microscope slides [J].Anal Chem,2005, 77: 2708-2719.
[43]Kim Y H, Lee J W, An J M, et al.Effect of a blind spot in a dielectrophoretic field on the separation of human breast cancer cells [J].J Mech Sci Technol, 2009, 23: 3132-3139.
[44]Cristofanilli M, Krishnamurthy S, Das C M, et al.Dielectric cell separation of fine needle aspirates from tumor xenografts [J].J Sep Sci, 2008, 31: 3732-3739.
[45]Adams A A, Okagbare P I, Feng J, et al.Highly efficient circulating tumor cell isolation from whole blood and label-free enumeration using polymer-based micro fluidics with an integrated conductivity sensor [J].J Am Chem Soc, 2008, 130: 8633-8641.
[46]Dharmasiri U, Njoroge S K, Witek M A, et al.High-throughput selection, enumeration electrokinetic, manipulation, and molecular profiling of low-abundance circulating tumor cells using a micro fluidic system [J].Anal Chem, 2011, 83: 2301-2309.
[47]Chung Y-K, Reboud J, Lee K C, et al.An electrical biosensor for the detection of circulating tumor cells [J].Biosensors and Bioelectronics, 2011, 26(5): 2520-2526.
[48]Javanmard M, Talasaz A H, Nemat-Gorgani M, et al.Early diagnosis of cancer by electrical detection of nucleic acid biomarkers [A].International Conference on Solid-State Sensors and Actuators and Microsystems, Transducers[C], 2009: 947-950.
[49]Javanmard M, Talasaz A H, Nemat-Gorgani M, et al.Electrical detection of protein bimarkers using bioactivated microfluidic channels [J].Lab Chip, 2009, 9: 1429-1434.
[50]Javanmard M, Talasaz A H.Targeted cell detection based on microchannel gating [J].Biomicro fluidics, 2007, 1(4): 004103-1-10.
[51]Carrara S, Bhalla V, Stagni C, et al.Label-free cancer markers detection by capacitance biochip [J].Sensors and Actuators B,2009, 136: 163-172.
[52]Mirsky V M, Riepl M, Wolfbeis O S.Capacitive monitoring of protein immobilization and antigen-antibody reactions on monomolecular alkylthiol films on gold electrodes [J].Biosens Bioelectron, 1997, 12: 977-989.
[53]Borgen E, Naume B, Nesland J M, et al.Use of automated microscope for the detection of disseminated tumor cells in bone marrow samples [J].Cytometry, 2001, 46: 215-221.
[54]Witzig T E, Bossy B, Kimlinger T, et al.Detection of circulating cytokeratin-positive cells in the blood of breast cancer patients using immunomagnetic enrichment and digital microscopy [J].Clin Cancer Res, 2002, 8: 1085-1091.
[55]Krivacic R T, Ladanyi A, Curry D N, et al.A rare-cell detector for cancer [J].Proc Natl Acad Sci, 2004, 101(29): 10501-10504.
[56]Haun J B, Castro C M, Wang R, et al.Micro-NMR for rapid molecular analysis of human tumor samples [J].Sci Transl Med,2011, 3(71): 1-13.
[57]Peng G, Tisch U, Adams O, et al.Diagnosing lung cancer in exhaled breath using gold nanoparticles [J].Nature Nanotechnology, 2009, 4: 669-673.
[58]Chen G D, Fachin F, Fernandez-Suarez M, et al.Nanoporous elements in micro fluidics for mutiscale manipulation of bioparticles[J].Small, 2011, 7(8): 1061-1067.
[59]Kim J, Gonzalez-Martin A.Nanopore membrane-based electrochemical immunoassay [J].J Solid State Electrochem, 2009,13: 1037-1042.
[60]Went P T, Lugli A, Meier S, et al.Frequent EpCAM protein expression in human carcinomas [J].Hum Pathol, 2004, 35: 122-128.
[61]Jiang H, Weng X, Li D Q.Micro fluidic whole-blood immunoassays[J].Micro fluidics and Nano fluidics, 2011, 10(5): 941-964.
