培养液组胺的检测及鲣鱼产组胺菌的生物活性评价
2012-07-19周秀锦周向阳吴祖芳
周秀锦,杨 建,周向阳,沈 飚,吴祖芳
(1.舟山出入境检验检疫局,浙江舟山 316100;2.应用海洋生物技术教育部重点实验室,宁波大学生命科学与生物工程学院,浙江宁波 315211)
鲣鱼(Eleotridae),俗称为炸弹鱼,属鲈形总目、金枪鱼亚目、金枪鱼科、鲣属,我国只产一种;鲣鱼肉中含有丰富的血红蛋白和肌红蛋白,在有生命活动的组织内,血红蛋白与肌红蛋白处于平衡状态,而鱼体死后经氧化生成的高铁肌红蛋白则呈现不良的棕红色[1]。一般认为,肌红蛋白的化学状态是影响鱼肉颜色的根本所在[2]。同时由于鱼肉中的组氨酸在组胺细菌脱羧酶的作用下,发生脱羧反应生成组胺[3]。海水中存有污染鱼类的组胺菌,组胺生成菌普遍存在于海水鱼的体表,也生活在活鱼的鳃和内脏中。鱼死亡时,在贮藏或加工过程中体内组氨酸经过内源性或外源性微生物产生的脱羧酸酶降解后产生的对产品品质(感官指标)劣化或人体有一定毒害的化学物质[4]。鲣鱼罐头是我国某些沿海城市重要的出口水产加工品,畅销日本、欧洲等国家;自中国加入世界贸易组织,出口量不断增加,但是组胺含量超标,一直是制约产品出口的主要瓶颈,因组胺含量超标而引起的中毒事件也时有发生[5-7]。本文建立了培养基中组胺的高效液相色谱法(HPLC)检测方法,确定从鲣鱼鱼肉组织中分离产组胺微生物,研究菌株的生长和产组胺特性,研究结果可为冷冻水产品组胺含量相关的质量安全控制提供重要依据。
1 材料与方法
1.1 实验材料与试剂
冷冻鲣鱼(捕捞于中国东海,捕捞后于-30℃下速冻,-18℃保藏),浙江舟山企业提供(2010年4月),无菌袋包装、冷藏,于5 h内运到实验室,-18℃保藏,以备试验用。
组胺标准品购自Sigma公司,丹磺酰氯购自ACROS公司,L-组氨酸和1,7-二氨基庚烷购自阿拉丁试剂公司,乙腈和甲醇购自迪马公司;色谱分析所用试剂:色谱纯;其他试剂:均为化学纯和分析纯。
组胺发酵培养基:L-组氨酸10 g,大豆蛋白胨17g,NaCl 3.0 g,磷酸氢二钾2.5 g,丙酮酸钠10.0 g,葡萄糖2.5 g,蒸馏水1 000 mL,调pH 7.0,分装试管。培养基于1.01×105Pa高压下,121℃蒸汽灭菌15 min。
1.2 仪器与设备
LRH-190-S恒温恒湿培养箱,购自广东省医疗器械厂;LDZX-40BI立式蒸汽灭菌锅,购自上海申安医疗器械厂;安捷伦LC1100液相色谱仪,购自美国安捷伦公司。
1.3 方法
1.3.1 培养液中组胺检测方法的建立
1.3.1.1 发酵液预处理
取各菌株发酵液及空白对照各1 mL于5 mL离心管,依次加入100 μL 2 mol/L氢氧化钠,20 μL 100 mg/L 1,7-二氨基庚烷(内标物,用0.1 mol/L盐酸配制而成)标准使用液,300 μL饱和碳酸氢钠,再加入2 mL丹酰氯衍生剂溶液(用色谱级丙酮配制成浓度为10 mg/mL)进行衍生,震荡混匀后于60℃烘箱内放置45 min,再加入100 μL氨水放置40 min,最后用乙腈定容至5 mL,震荡混匀,取1 mL经0.22 μm微孔滤膜过滤后进样。
1.3.1.2 标准曲线预处理
取 0 μL、50 μL、100 μL、200 μL、500 μL 和 1 000 μL 的 10 μg/mL 组胺标准溶液,经 1.3.1.2 加入 20 μL 100 mg/L 1,7-二氨基庚烷……衍生处理后,通过高效液相测定。
1.3.1.3
色谱条件:流动相A:0.01 mol/L乙酸铵,流动相B:乙腈与0.01 mol/L乙酸铵9:1混合;流动相A:流动相B=2:8,流速1.0 mL/min,紫外检测器波长254 nm,进样量20 μL。
1.3.2 待测菌株产组胺能力的测定
取1 mL初步分离菌株菌悬液接种于9 mL组胺发酵培养基中(此时菌液浓度约为104 CFU/mL),并设置空白对照组(不接种菌株),35℃下静置恒温培养36 h,检测发酵液是否有组胺产生。
1.3.3 温度对产组胺菌株生长和产组胺的影响
取1 mL产组胺菌株的菌悬液接种至9 mL组胺发酵培养基中,分成五组分别于4℃、20℃、25℃、30℃和35℃下静置培养36 h,每个温度均设置空白对照;取1 mL通过高效液相色谱法测定组胺含量。
1.3.4 pH对产组胺菌株生长和产组胺的影响
取1 mL菌悬液接种于9 mL pH为4,5,6,7和8的组胺发酵培养基中(每个pH设置空白对照),30℃培养箱中静置培养36 h;测定发酵液中的组胺含量。
2 结果与分析
2.1 培养液中组胺检测方法的建立
2.1.1 样品前处理的优化
在样品处理过程中加入100 μL 2 mol/L氢氧化钠溶液,调整培养液pH呈碱性,致使组胺能游离便于衍生。衍生化后添加乙腈,充分沉淀培养液中的蛋白质,减少待测液中的大分子物质,保护检测系统的稳定,延长色谱柱的使用寿命。
2.1.2 标准工作曲线
组胺的线性范围、校正曲线方程和相关系数见表1。组胺标准溶液和内标物色谱图如图1所示。
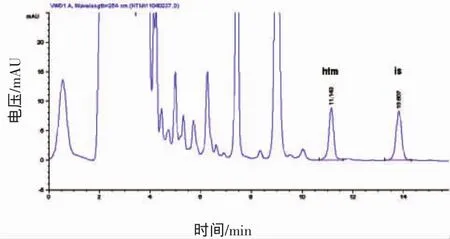
图1 组胺标准溶液和内标色谱图Fig.1 Chromatogram of histamine standard and internal

表1 组胺的线性范围、校正曲线方程和相关系数Tab.1 The linearity of standard curve
注:表中x,y分别为组胺与内标浓度比和峰面积比.
2.1.3 回收率和精密度、方法的测定低限
在空白培养液中添加 0.5 μg/mL、2.0 μg/mL、10.0 μg/mL 的组胺,按本文的实验方法操作,所得回收率和室内精密度见表2。由表2可知,此方法的平均加标回收率为104.1%~103.8%,回收率较好。

表2 培养液中组胺回收率与精密度试验数据Tab.2 Results of recovery test and precision of the method from fortified samples(n=6)
在空白培养液样品中添加0.5 μg/mL的组胺标准溶液,按本文的实验方法操作,回收率均在100%~107%之间,相对标准偏差<15%,符合残留分析的要求。空白样品和加标后样品组胺的色谱对比图如
图2。根据回收率试验,本方法的测定低限为 0.5 μg/mL。

图2 空白样品和加标后样品组胺的色谱对比图Fig.2 Chromatogram of spiked histamine sample and bank sample by HPLC
2.2 温度对产组胺菌株产组胺的影响
将产组胺菌株菌悬液接种至组胺发酵培养基中(此时菌浓度约为104CFU/mL),分成5组(每组至少3个平行)在4℃、20℃、25℃、30℃和35℃条件下静置培养36 h(每个温度均设置空白对照),测定培养液中组胺含量,结果如图3。
从图3可以看出,4℃时,均未检测J2和J4产生组胺,表明此温度下2株菌不能产生组胺,20~35℃温度范围内,组氨酸脱羧酶均有较强活性,且J2和J4分别在25℃和30℃时活性达到最强,检测到组胺最大生成量分别为5.49 mg/L和12.47 mg/L,降低或升高温度均使活性减弱。其中J2生长最适温度与产组胺最适温度不同,表明该菌生长最适温度与酶作用的最适温度不同。
2.3 pH对产组胺菌株产组胺的影响
将组胺发酵培养基pH分别调至4,5,6,7和8,然后取1 mL J2和J4菌悬液接种于装有9 mL培养基的试管中,35℃静置培养36 h(每个pH均设置空白对照),测定培养液中组胺含量,结果如图4。
由图4可以看出,菌株J2和J4在pH=5时有最大组胺生成量9.86 mg/L和12.02 mg/L,且都随着pH升高而降低,两株菌在pH=4时组胺产生量少于在pH=5时,这可能与该pH下细菌总数有关。

图3 温度对J2和J4产组胺的影响Fig.3 Effect of the temperature on histamine production of histamine-forming bacteria

图4 pH对菌株J2和J4产组胺的影响Fig.4 Effect of the pH on histamine production of histamine-forming bacteria
3 讨论
利用高效液相色谱内标法检测发酵液中组胺含量,发酵液前处理的方法在CHEN等[5]所用方法的基础上稍作修改,但他们在组胺测定时,采用流动相梯度洗涤样液,与本实验有很大区别;本方法的回收率在101.10%左右,检出限为0.50 μg/mL,这完全能够满足组胺测定需要。
菌株J2和J4均在pH=5左右有最大组胺产生量,这与RODTONG等[8]研究产气肠杆菌Enterobacter aerogenes、摩根氏菌Morganella morganii和变形杆菌Proteus vulgaris的结果类似。SANTOS[9]在较早的研究发现中就发现,细菌作为自身一个防御机制,酸性条件将有利于它们产生组氨酸脱羧酶。
4 结语
1)建立了利用高效液相色谱内标法测定细菌发酵液中组胺含量的方法,本方法组胺标准曲线相关相关系数和组胺回收率均较高且检测限低,因此能够满足准确测定微量组胺含量的需要。
2)通过分离筛选从鲣鱼内脏中分离得到两株产组胺微生物J2和J4,菌株J2和J4的最适生长温度分别为30℃和25℃,其生物量分别达到12.67 log(CFU/mL)和12.71 log(CFU/mL);其最适pH分别为7和6,其最大生物量分别达到10.32 log(CFU/mL)和10.39 log(CFU/mL);菌株J2和J4产组胺最适温度分别为25℃和30℃,其组胺产生量达到5.49 mg/L和12.47 mg/L;且在最适产组胺pH=5的条件下组胺产生量分别达到9.86 mg/L和12.02 mg/L。
[1]王国永,林乐杰.远洋金枪鱼钓船的超低温制冷系统[J].渔业现代化,2001(6):34-35.
[2]王海燕,彭增起.肌红蛋白的功能特性[J].肉类工业,2001(7):36-40.
[3]TAO Z,NAKANO T,YAMAGUCHI T,et al.Production and diffusion of histamine in the muscle of scomhroid fishes[J].Fish--eries Science,2002,68:1 394-1 397.
[4]KUNG H F,WANG T Y,HUANG Y R,et al.Isolation and identification of histamine-forming bacteria in tuna sandwich[J].Food Control,2009,20:1 013-1 017.
[5]CHEN H C,HUANG Y R,HSU H H,et al.Determination of histamine and biogenic amines in fish cubes(Tetrapturus angustirostris)implicated in a food-borne poisoning[J].Food Control,2010,21:13-18.
[6]CHANG S C,KUNG H F,CHEN H C,et al.Determination of histamine and bacterial isolation in swordfish fillets(Xiphias gladius)implicated in a food borne poisoning[J].Food Control,2008,19:16-21.
[7]CHEN H C,KUNG H F,CHEN W C,et al.Determination of histamine and histamine-forming bacteria in tuna dumpling implicated in a food-borne poisoning[J].Food Chemistry,2008,106:612-618.
[8]RODTONG S,NAWONG S,YONGWATDIGUL J.Histamine accumulation and histamine-forming bacteria in Indian anchovy(Stolephorus indicus)[J].Food Microbiology,2005,22:475-482.
[9]SANTOS M H S.Biogenic amines:their importance in foods[J].International Journal of Food Microbiology,1996,29:213-231.
