西流湖界面沉积物中溶磷细菌筛选及其溶磷能力研究
2012-07-14屈建航王福芳晏加照胡元森
屈建航,王福芳,晏加照,胡元森,赵 江
(河南工业大学生物工程学院,河南郑州450001)
水体富营养化一直是全球备受关注的环境污染问题.据报道磷(P)是水体富营养化的限制性因素[1,2],一般认为,水体中总磷的质量浓度大于0.02 mg·L-1,水体即处于富营养化状态[3].沉积物作为水体系统的内源P库,构成了水体潜在的P污染源.水-沉积物间P循环及其生物驱动机制成为控制水体富营养化的关键性研究,并以水-沉积物界面为重要位点[4].沉积物中蕴藏丰富的微生物种质资源[5],其中溶磷细菌(Phosphate-solubilizing bacteria)能够将不溶性磷酸盐溶解转化为可溶性有效磷,直接参与水体系统磷物质循环.LI等[6]对富营养化官厅水库沉积物的溶磷细菌垂直分布研究表明,溶磷细菌的数量与沉积物的磷含量呈正相关关系,对磷循环有重要作用.目前国内外对溶磷细菌的研究多集中在土壤,尤其是植物根部[7],旨在提高土壤磷的利用率,或为生物磷肥的研制提供菌种资源,而对沉积物中的溶磷细菌的研究相对较为薄弱.本研究以河南省郑州市西流湖界面沉积物为对象,从中筛选溶磷细菌,鉴定种属并研究其溶磷能力,以期探明沉积物中溶磷细菌这一特定细菌种群的生态组成,及其对水体富营养化的作用.
1 材料与方法
1.1 样品来源
沉积物样品采集自河南省郑州市西流湖,于自封袋常温带回实验室,立即使用.对上覆水和经3 000 r·min-1离心20 min制备的沉积物间隙水,用0.22 μm微孔滤膜过滤后,用PHS-3C酸度计测定pH值,磷钼蓝比色法[8]测定可溶性磷含量.
1.2 培养基
无机磷培养基[6]:葡萄糖 10.0 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.3 g,NaCl 0.3 g,KCl 0.3 g,FeSO40.03 g,MnSO4·H2O 0.03 g,蒸馏水 1 000 mL,pH 值 7.0 ~ 7.2,115 ℃ 灭菌 30 min,无菌Ca3(PO4)210 g单独加入.固体培养基加琼脂15 g.
1.3 溶磷菌的筛选
10 g新鲜沉积物样品,放入90 mL无菌生理盐水中,玻璃珠震荡制备沉积物菌悬液,10倍梯度稀释法进行无机磷培养基平板涂布,28℃培养。定期观察生长及溶磷圈产生情况,挑取溶磷圈较大的代表性菌落,纯化并保存于牛肉膏斜面培养基.
1.4 溶磷能力测定
1.4.1 定性测定 新鲜菌株点接于无机磷培养基平板,28℃倒置培养,定期观察透明圈的大小,记录菌落直径(d)和溶磷圈直径(D),以D/d的大小定性判定溶磷能力.试验设置平行.
1.4.2 定量测定 100 mL无机磷培养基装入300 mL三角瓶,将新鲜菌株使用不含磷源的分离培养基洗涤,制成种子液,2 mL接种,28℃,140 r·min-1摇床培养.每菌3个重复,取平均值.设置接种等量灭活菌液的对照组作为空白,以排除菌种本身携带以及培养基的基础磷干扰.定期对培养液取样并离心,取上清液以钼蓝比色法测定磷含量,以上清液磷含量与总磷含量的比值计算溶磷得率,所有数据去除对应空白对照的磷量.同时使用PHS-3C酸度计,测定培养液的pH值变化.
1.5 16S rDNA系统发育分析
用无菌牙签挑取少量单菌落菌体重悬于20 μL无菌ddH2O中,沸水浴煮沸10 min,立即置于冰上 5 min,4 ℃下 12 000 r·min-1离心 5 min,使用时取1.5 μL上清液作为DNA模板;同时以1.5 μL无菌重蒸水为模版作为阴性对照.PCR扩增引物使用原核生物16S rDNA通用引物Escherichia coli 27f和 1 495R[9].扩增条件为 94 ℃ 3 min;94℃ 45 s,58 ℃ 45 s,72 ℃ 2 min,30 个循环;72℃ 10 min.扩增产物琼脂糖凝胶电泳检测后,由上海生工生物公司测定核苷酸序列.测序结果使用BLAST程序[10]与 GenBank数据库中的序列(http://www.ncbi.nlm.nih.gov/)进行比对分析,下载相关序列,MEGA 3.1软件[11]构建系统发育树.
2 结果与分析
2.1 沉积物样品的理化特性
取样点上覆水 pH值6.56,可溶性磷含量0.020 mg·L-1,沉积物呈黑色,腥臭味,间隙水 pH值 6.85,可溶性磷含量 0.261 mg·L-1.
2.2 溶磷菌的定性筛选
定期观察稀释涂布的无机磷平板,结果显示,具有不同程度大小的溶磷圈菌株,数量丰富.对溶磷圈相对较大的菌分离纯化,最终初筛出4株,分别为PS-1,PS-4,PS-11和PS-13,培养5 d时的溶磷圈和菌落直径结果见表1.

表1 溶磷菌的定性溶磷能力Table 1 Phosphate solubilization capacity of the strains in solid plate
2.3 溶磷能力的定量结果及pH值变化
将测试菌株接种于无机磷液体培养基,定期测定培养液上清液中的可溶性磷含量和pH值,并计算溶磷得率,结果见表2.在试验条件下,4株溶磷细菌从48 h开始表现出明显的溶磷能力,溶磷量最高值出现在72 h或者96 h,其中PS-1菌溶磷能力最强,为 580 mg·L-1,溶磷率 28.71%;而 PS-13溶磷量相对较低,溶磷率为14.10%.溶磷细菌在固体培养基平板和液体培养条件下,表现出不同的相对溶磷能力.
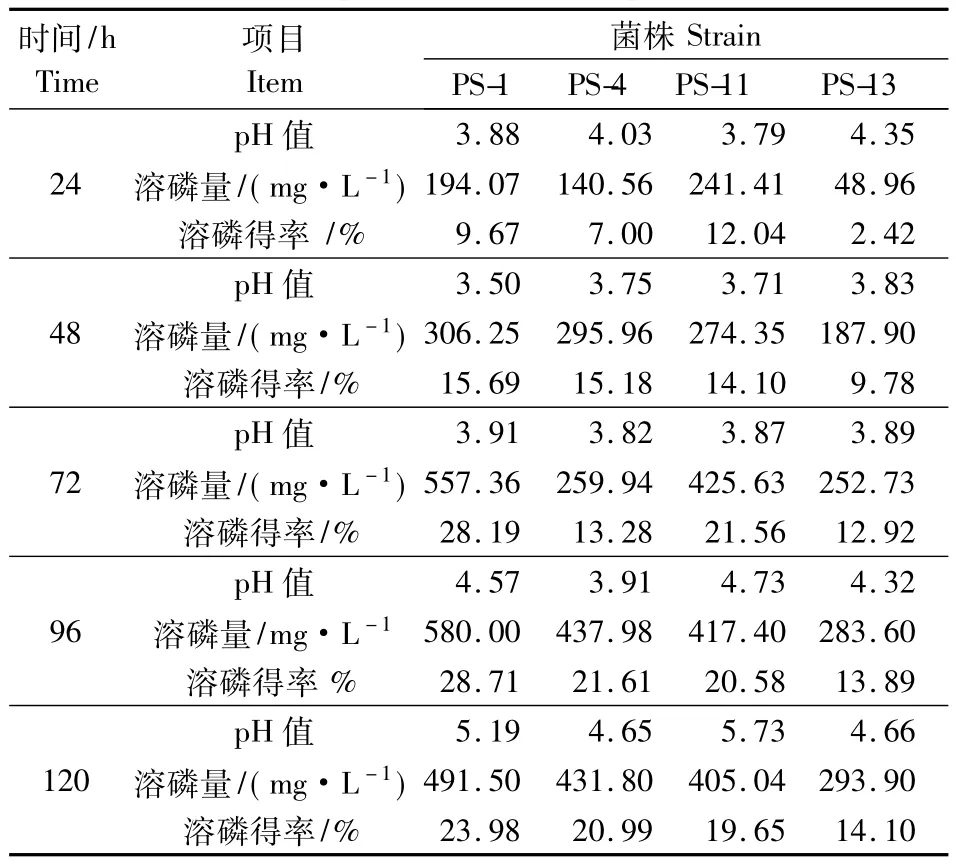
表2 溶磷菌的溶磷能力及培养液pH值变化Table 2 Phosphate solubilization capacity of the strains in liquid medium and pH changes
本研究中的4株细菌在无机磷液体培养基中的pH值,12 h之内降到了4.0左右,其中PS-1菌株pH值下降最为明显,在48 h时pH值降到3.5,各菌的溶磷能力均出现在pH值下降之后,溶出的可溶性磷含量逐渐提高,后期随着pH值的逐步回升,可溶性磷含量出现明显的下降趋势(图1).pH值和溶磷率之间存在一定的负相关关系.
2.4 溶磷菌的16S rDNA系统发育鉴定
对筛选获得的溶磷细菌 PS-1,PS-4,PS-11和PS-13进行16S rDNA的PCR扩增和核苷酸测序,测得序列提交GenBank数据库,登录号分别为JN106383,JN106384,JN106385 和 JN106386.Gen-Bank BLAST比对结果表明,菌株PS-1与Pseudomonas fluorescens[12]同源性最高,为 99%,PS-4 与Pseudomonas mandelii[13]同源性最高,为 99% ,PS-11与 Pseudomonas putida[14]同源性最高,为99%,PS-13的最相近菌为 Aeromonas salmonicida[15],同源性100%.分别下载各自的相关序列,并使用MEGA 3.1软件进行系统发育树的构建,结果显示(图2),菌株PS-1,PS-4和PS-11属于假单胞菌属Pseudomonas sp.,PS-13 为气单胞菌属 Aeromonas sp.
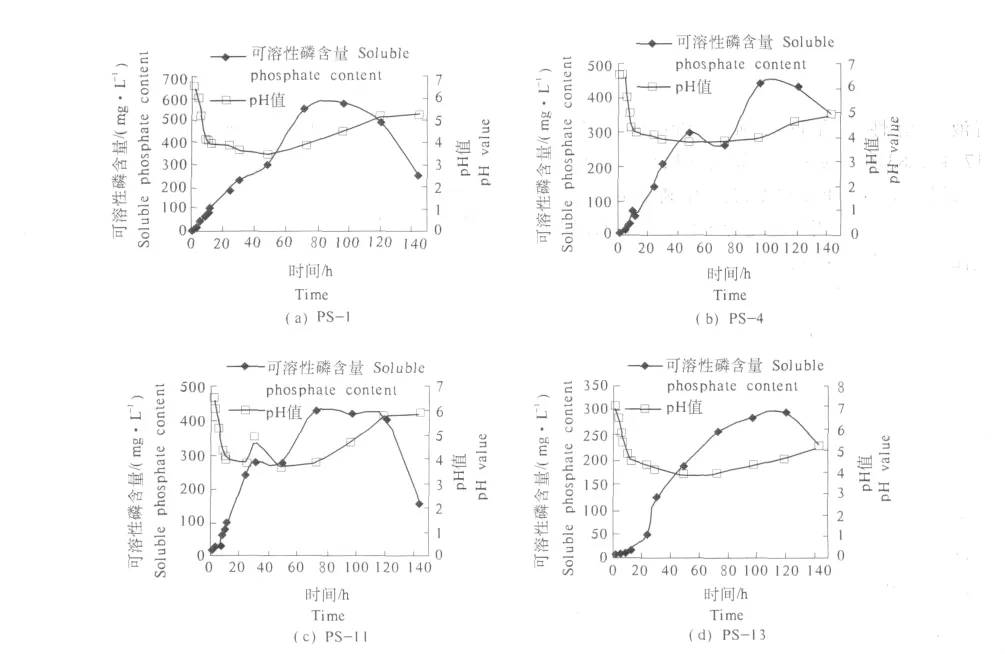
图1 溶磷菌在培养液中的溶P能力及pH值变化Fig.1 Changes of soluble phosphate content and pH value over time of strains

图2 溶磷菌的16S rDNA系统发育树Fig.2 Phylogenetic tree based on the 16S rDNA sequences of phosphate solubilizing bacteria
3 结论与讨论
水-沉积物界面是水体营养物质循环的关键,0~20 cm深度范围内的沉积物主要影响水-沉积物界面的磷循环,被认为是广义的界面沉积物[16].本研究以无机磷酸钙为磷源,从郑州市西流湖界面小于5 cm深度的沉积物中筛选出4株高效溶磷细菌,其中 PS-1,PS-4和 PS-11属于假单胞菌属Pseudomonas sp.,PS-13为气单胞菌属 Aeromonas sp.,在无机磷培养基中28℃培养96 h溶出的上清液可溶性磷含量分别达 580.00,437.98,417.40,283.60 mg·L-1.界面沉积物作为水 - 沉积物间磷循环的重要位点,其中溶磷细菌的含量丰富,溶磷菌株的获得及鉴定为了解其生态状况及后续深入研究奠定了基础.
当前报道的溶解无机磷的细菌多以假单胞菌属为主.气单胞菌属常见于淡水或污水,兼性厌氧,被认为具有肠杆科菌的一些特征,部分种具有假单胞菌和弧菌属的某些菌的特征[17].目前多数研究者认为pH值条件与菌株溶磷能力之间存在明显相关,本研究中4株溶磷细菌的溶磷率和培养液pH值之间呈一定的负相关关系,也体现了这一点.但也有研究表明,培养介质pH值下降并非微生物溶磷的必要条件,有机酸是溶磷的一个方面,伴随着呼吸作用或NH+4同化作用产生质子也可使难溶性磷溶解[18].关于微生物溶磷的详细机理,还有待深入研究.
[1] SCHINDLER D W,HECKY R E,FINDLAY D L,et al.Eutrophication of lakes cannot be controlled by reducing nitrogen input:results of a 37-year whole-ecosystem experiment[J].Proceedings of the National Academy of Sciences,2008,105:11254-11258.
[2] 王振华,王圣瑞,刘元英,等.Fe和Al对湖泊沉积物中磷赋存形态的影响[J].环境科学研究,2012,25(5):556-562.
[3] 魏 浪,夏 霆,严志程,等.乌江上游梯级水库水体富营养化研究[J].水资源保护,2010,26(4):39-42,66.
[4] SφONDERGAARD M,JENSEN J P,JEPPESEN E.Role of sediment and internal loading of phosphorus in shallow lakes[J].Hydrobiologia,2003,506:135-144.
[5] QU J H,YUAN H L,WANG E T,et al.Bacterial diversity in sediments of the eutrophic Guanting Reservoir,China,estimated by analyses of 16S rDNA sequence[J].Biodiversity and Conservation,2008,17(7):1667-1683.
[6] LI C,YUAN H L,HUANG H Z.Vertical distribution of phosphorus and P-dissolving/decomposing bacteria in the sediment of Guanting Reservoir[J].Science in China Ser.D Earth Science,2005,48(Supp.Ⅱ):285-294.
[7] OLIVEIRA C A,ALVES V M C,MARRIEL I E,et al.Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome[J].Soil Biology and Biochemistry,2009,41:1782-1787.
[8] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:243-248.
[9] QU J H,YUAN H L,LI H F,et al.Flavobacterium cauense sp.nov.,isolated from sediment of a eutrophic lake[J].International Journal of Systematic and Evolutionary Microbiology,2009,59:2666-2669.
[10] ALTSCHUL S F,MADDEN T L,SCHÄFFER A A,et al.Gapped BLAST and PSI-BLAST:a new generation of protein database search programs[J].Nucleic Acids Research,1997,25(17):3389-3402.
[11] KUMAR S,TAMURA K,NEI M.MEGA3:Integrated software for Molecular Evolutionary Genetics Analysis and sequence alignment[J].Briefings in Bioinformatics,2004,5(2):150-163.
[12] CASTAGNO L N,ESTRELLA M J,SANNAZZARO A I,et al.Phosphate-solubilization mechanism and in vitro plant growth promotion activity mediated by Pantoea eucalypti isolated from Lotus tenuis rhizosphere in the Salado River Basin(Argentina)[J].Journal of Applied Microbiology,2011,110(5):1151-1165.
[13] SOARES A,GUIEYSSE B,DELGADO O,et al.Aerobic biodegradation of nonylphenol by cold-adapted bacteria[J].Biotechnology Letters,2003,25(9):731-738.
[14] MERIMAA M,HEINARU E,LIIVAK M,et al.Grouping of phenol hydroxylase and catechol 2,3-dioxygenase genes among phenol-and p-cresol-degrading Pseudomonas species and biotypes[J].Archives of Microbiology,2006,186(4):287-296.
[15] MARTINEZ-MURCIA A J,BENLLOCH S,COLLINS M D.Phylogenetic interrelationships of members of the genera Aeromonas and Plesiomonas as determined by 16S ribosomal DNA sequencing:lack of congruence with results of DNA-DNA hybridizations[J].International Journal of Systematic Bacteriology,1992,42(3):412-421.
[16] SφONDERGAARD M,JENSEN J P,JEPPESEN E.Internal phosphorus loading in shallow Danish lakes[J].Hydrobiologia,1999,408/409:145-152.
[17] BERGEY D H,HARRISON F C,BREED R S,et al.Bergey’s Manual of Determinative Bacteriology[M].Baltimore:Williams& Wilkins,1923.
[18] 盛 荣,肖和艾,谭周进,等.土壤解磷微生物及其磷素有效性转化机理研究进展[J].土壤通报,2010,41(6):1505-1510.
