转化生长因子β2对人晶状体上皮细胞间质转分化的影响*
2012-06-20朱玉广钟莹莹杜孝楠孙学泉
朱 艳,朱玉广,钟莹莹,杜孝楠,张 荣,孙学泉
潍坊医学院附属医院眼科中心潍坊261031
后囊膜混浊(posterior capsular opacification,PCO)是现代白内障术后最常见的并发症[1]。有研究[2]表明,人晶状体上皮细胞(human lens epithelial cells,HLECs)的间质转分化(epithelial mesenchymal transition,EMT)是PCO的主要病理改变,其中多种细胞因子参与了其发生过程。转化生长因子β2(transforming growth factor-β2,TGF-β2)可以诱导EMT的发生,从而参与了胚胎发育、创伤修复和肿瘤发生等多种生物过程[3-5]。该研究利用培养的HLECs,观察 TGF-β2 对 HLECs增殖的影响,并对TGF-β2 诱导后 HLECs中 E-钙黏素(E-cadherin)、α平滑肌肌动蛋白(α-SMA)和F-肌动蛋白(F-actin)等与EMT相关蛋白的表达进行研究,探讨TGF-β2对HLECs EMT的影响,制作适合 PCO研究的HLECs模型。
1 材料与方法
1.1 主要试剂 DMEM培养液、胎牛血清(GIBCO公司)、兔抗人α-SMA抗体(美国Sigma公司)(按1∶200稀释),兔抗人E-cadherin多克隆抗体(美国Santa Cruz公司)(按1∶100稀释),兔抗人 F-actin多克隆抗体(北京中杉金桥生物技术有限公司),RT试剂盒、PCR扩增试剂盒(Casarray公司)。
1.2 HLECs的培养与传代 晶状体取自角膜移植术后供体眼球(死亡时间 <24 h,患者年龄 <40岁)。体积分数70%乙醇消毒供体眼球,庆大霉素冲洗。在超净工作台上解剖眼球,去除角膜和虹膜,沿赤道部剪开晶状体,将前囊膜切成1 mm×1 mm左右的小块,种植于培养皿,滴加DMEM培养液2滴,培养皿放入培养箱30 min~1 h贴壁。取出培养皿,滴加含体积分数15%胎牛血清的DMEM培养液,放入CO2培养箱中培养。以后每3~4 d换1次培养液。1~2周近融合,待细胞达约90%融合时,2.5 g/L胰蛋白酶消化传代。传代后增殖明显,选择传4代的细胞进行实验[6-7]。
1.3 MTT法检测TGF-β2对HLECs增殖的影响
HLECs以1×104/孔接种于96孔培养板中,每孔接种 100 μL,培养24 h 后滴加 TGF-β2,使之终质量浓度分别为 0 ng/L(对照组)和 10、33、100、333 和1 000 ng/L,继续培养 12、24、48 和 72 h,之后滴加 5 g/L的MTT溶液(每孔20 μL),培养4 h,吸去培养液,每孔滴加 DMSO 0.15 mL,振荡10 min,结晶充分溶解后,在Powerware XS全波长酶标仪上测量其在490 nm处的吸光度(A值)。计算细胞存活率:细胞存活率=处理组A值/对照组A值×100%。根据MTT比色结果选择最佳TGF-β2干涉质量浓度、刺激时间。
1.4 细胞分组 制作细胞爬片,待HLECs达80%融合后,血清饥饿培养24 h后分组。实验分为对照组和TGF-β2组。对照组加入无血清培养基,TGF-β2组加入终质量浓度为100 ng/L TGF-β2的培养基,培养48 h后进行后续实验。
1.5 细胞免疫化学染色法检测HLECs E-cadherin、α-SMA及F-actin蛋白的表达 对照组和TGF-β2组的细胞爬片进行免疫细胞化学染色,按试剂说明操作,检测E-cadherin、α-SMA和F-actin的表达。胞质光镜下出现棕黄色颗粒为阳性细胞。每组各取5张爬片,每张爬片选取5个完整而不重叠的高倍镜视野(×400),将免疫细胞化学染色阳性信号投射Imagepro plus显微图像分析系统,经灰度调节后测定阳性细胞的A值进行半定量分析。每组重复6次。
1.6 RT-PCR 检测 HLECs E-cadherin及 α-SMA mRNA的表达 收集对照组和TGF-β2组HLECs,Trizol法提取细胞的总RNA,按PCR扩增试剂盒说明步骤,反转录为cDNA后进行PCR反应。引物序列:α-SMA(174 bp),上游 5’-ACTGGGACGACATG GAAAAG-3’, 下 游 5’-CATCTCCAGAGTCCAG CACG-3’;E-cadherin(346 bp),上游 5’-TCCCAT CAGCTGCCCAGAAA-3’,下游 5’-GGTGAAGGTCG GAGTCAACG-3’;β-actin(231 bp),上游 5’-ACT CTTCCAGCCTTCCTTCC-3’, 下 游 5’-GTACTT GCGCTCAGGAGGA-3’。扩增产物行琼脂糖凝胶电泳检测,Eagle EyeⅡ型凝胶图像分析软件系统分析结果。每组重复6次。
1.7 统计学处理 采用SPSS 13.0进行分析,2组间α-SMA蛋白表达水平的比较应用秩和检验,其余各指标蛋白及mRNA表达水平的比较应用两独立样本t检验,检验水准α=0.05。
2 结果
2.1 MTT法检测TGF-β2对HLECs增殖的影响选取10~1 000 ng/L中5个质量浓度的 TGF-β2分别作用于 HLECs,作用时间为 12、24、48和 72 h。结果显示,HLECs增殖随着 TGF-β2终质量浓度和作用时间的增长而逐渐下降,当终质量浓度为100 ng/L时达到了最强抑制作用(图1A)。取TGF-β2终质量浓度100 ng/L分别作用于HLECs 12、24、48 和 72 h,HLECs增殖随 TGF-β2 作用时间增加而逐渐抑制(图1B),培养48 h达到了最强抑制作用。
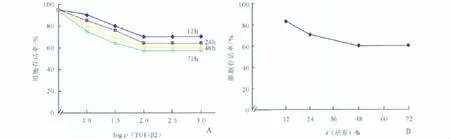
图1 TGF-β2对HLECs增殖的影响
2.2 细胞免疫化学法检测TGF-β2对HLECs转分化的影响 对照组HLECs大量表达E-cadherin,TGF-β2组E-cadherin表达少。对照组HLECs不表达 α-SMA,少量表达 F-actin,TGF-β2 组 α-SMA、F-actin的表达增加(图2,表1)。

图2 2组HLECs免疫细胞染色结果(SP,×400)

表1 对照组和TGF-β2组HLECs中E-cadherin、α-SMA及F-actin蛋白的表达
2.3 RT-PCR 检测 HLECs E-cadherin及 α-SMA mRNA的表达 图像分析结果显示,TGF-β2抑制E-cadherin mRNA的表达,促进α-SMA mRNA的表达(图3,表 2)。

图3 2组HLECs中E-cadherin和α-SMA mRNA的表达

表2 对照组和TGF-β2组HLECs中E-cadherin及α-SMA mRNA的表达
3 讨论
PCO引起的后发性白内障是现代白内障术后的主要并发症,也是影响术后视力提高的主要原因[1]。目前仍有不少患者需要行Nd-YAG激光后囊切开。因此,明确PCO的发病机制和采用有效的防治措施是眼科急待解决的课题之一。EMT是指原本排列紧密的上皮细胞在某些因素的作用下转变成具有类似于成纤维细胞、具有一定游走能力的间质细胞的过程[8-9]。具体到眼晶状体,HLECs的EMT是指HLECs从上皮样细胞向肌成纤维细胞样细胞转变的异常分化过程,是PCO的主要病理改变。
E-cadherin是上皮细胞表型的标志性蛋白,也是上皮细胞间重要的黏附分子,在维持上皮细胞极性和功能方面起重要的作用[10]。肌成纤维细胞(MFB)是间充质的主要组成细胞之一,α-SMA是MFB表型的标志性蛋白[11]。因此通过检测E-cadherin、α-SMA的表达,可以分析上皮细胞的EMT程度。在病理状态下HLECs可发生表型转变,而高水平α-SMA的表达增强了细胞迁移、侵袭和游走的能力。
目前认为,术后残留的HLECs增殖、移行、EMT是引起PCO的主要原因[2]。α-SMA正常表达于平滑肌与心肌,晶状体中出现α-SMA为PCO的标志,因此,α-SMA可作为研究HLECs EMT的指标。在EMT的发生过程中,多种细胞因子参与了其发生过程[12],TGF-β2可以诱导 EMT 的发生,从而参与了胚胎发育、创伤修复和肿瘤发生等多种生物过程[3]。目前,在 PCO研究中,尚未完全明确刺激HLECs增殖、移行和EMT产生的信号因子,但在离体后发障模型的实验[13]中,己证明某些细胞因子在后发障形成过程中起作用。TGF-β2是重要的调节因子[13-16],与囊膜下型白内障以及PCO的发生有密切关系。研究[13-16]发现,TGF-β2能够诱导 HLECs发生异常的生长和分化,并发生凋亡,导致体外培养的大鼠晶状体发生前囊膜下浑浊。
作者发现,TGF-β2可抑制HLECs的增殖和E-cadherin的表达,促进HLECs α-SMA及F-actin的表达。上皮细胞表型标志物E-cadherin的表达下降,肌纤维母细胞的标志蛋白α-SMA表达增强,表明TGF-β2能够诱导HLECs向肌纤维母样细胞转化,促进了PCO的形成。因此在PCO的研究中,TGF-β2可以作为适宜的 EMT诱导因子。目前有关TGF-β2对PCO的作用及相关信号通道的研究较少,因此,利用 TGF-β2作为刺激因子,可以制作HLECs EMT细胞模型,在细胞及分子水平上研究PCO的发生机制,为下一步的信号通道研究打下基础,同时也为PCO的防治指明了方向。
[1]Kohnen T.Preventing posterior capsule opacification:what have we learned?[J].J Cataract Refract Surg,2011,37(4):623
[2]Yao K,Ye PP,Tan J,et al.Involvement of PI3K/Akt pathway in TGF-beta2-mediated epithelial mesenchymal transition in human lens epithelial cells[J].Ophthalmic Res,2008,40(2):69
[3]Lois N,Taylor J,McKinnon AD,et al.Effect of TGF-beta2 and anti-TGF-beta2 antibody in a new in vivo rodent model of posterior capsule opacification[J].Invest Ophthalmol Vis Sci,2005,46(11):4260
[4]晁炜静,李康华,戴荣平,等.人脂肪间充质干细胞体外分化为视网膜细胞观察[J].郑州大学学报:医学版,2010,45(3):407
[5]徐春玲,苏冠方,张文杰,等.骨髓间充质干细胞向视网膜神经节样细胞分化过程中的电生理特性[J].吉林大学学报:医学版,2011,37(5):773
[6]陶津华,安小玲,孔郡,等.EGF体外对人晶状体上皮细胞迁移的影响[J].国际眼科杂志,2006,6(1):68
[7]朱艳,朱玉广,张立华,等.整合素 β1介导的 ERK/MAPK通道在晶状体上皮细胞转分化中的作用[J].眼科新进展,2012,34(4):318
[8]卢思广,刘健胜,于艳辉.肾小管间质纤维化发病机制的研究进展[J].实用儿科临床杂志,2011,26(17):1311
[9]周宝尚,张璟,陶光利.shRNA干扰 β-catenin对 TGF-β1诱导的肾小管上皮细胞转分化的作用[J].第三军医大学学报,2011,33(20):2166
[10]Kim NG,Koh E,Chen X,et al.E-cadherin mediates contact inhibition of proliferation through Hippo signaling-pathway components[J].Proc Natl Acad Sci USA,2011,108(29):11930
[11]Kim CD,Sohn KC,Lee SS,et al.Plasminogen activator inhibitor-2(PAI-2)secreted from activated mast cells induces α-smooth muscle actin(α-SMA)expression in dermal fibroblasts[J].J Dermatol Sci,2011,62(3):204
[12]Fragiadaki M,Mason RM.Epithelial-mesenchymal transition in renal fibrosis-evidence for and against[J].Int J Exp Pathol,2011,92(3):143
[13]Srinivasan Y,Lovicu FJ,Overbeek PA.Lens-specic expression of transforming growth factor β1 in transgenic mice causes anterior subeapsular cataracts[J].J Clin Investig,1998,101(3):625
[14]Maruno KA,Lovicu FJ,Chamberlain CG,et al.Apoptosis is a feature of TGF beta-induced cataract[J].Clin Exp Optom,2002,85(2):76
[15]Hales AM,Chamberlain CG,McAvoy JW.Cataract induction in lenses cultured with transforming growth factor-β[J].Invest Ophthalmol Vis Sci,1995,36(8):1709
[16]Gordon-Thomson C,de Iongh RU,Hales AM,et al.Differential cataractgenic potency of TGF-beta 1,beta 2,and beta 3 and their expression in the postnatal rat eye[J].Invest Ohthalmol Vis Sci,1998,39(8):1399
