狂犬病病毒HEP-Flury株N基因的修饰及原核表达
2012-06-19黄永亮官培英王怡飞徐晓娟吴晓薇郭霄峰
张 良,黄永亮,官培英,王怡飞,徐晓娟,吴晓薇,郭霄峰
(华南农业大学 兽医学院,广东 广州510642)
狂犬病病毒(Rabies virus,RV)是一种能引起人和动物高度致死的嗜神经病毒,属弹状病毒科狂犬病毒属,基因组从3'端至5'端依次排列核蛋白(N蛋白)、磷酸化蛋白(P蛋白)、基质蛋白(M蛋白 )、糖蛋白(G蛋白)和转录酶蛋白(L蛋白)5种结构蛋白[1].其中N蛋白为狂犬病病毒最保守的结构蛋白,共450个氨基酸,占病毒总蛋白的36%;是狂犬病病毒粒子的一种主要内部蛋白,在狂犬病病毒复制过程中与基因组RNA紧密结合形成核糖核蛋白(RNP),保护病毒基因组RNA免受宿主细胞核酸酶的破坏[2].RNP还与 P蛋白、L蛋白相互作用,形成转录与复制必需的螺旋对称结构[3].同时,狂犬病病毒N蛋白不仅具有所有狂犬病病毒共有的群特异性抗原决定簇,而且具有狂犬病病毒和狂犬病相关病毒共有的属抗原决定簇[4],N蛋白还是主要保护性抗原之一,能刺激机体产生细胞免疫[5].单独用N蛋白免疫小鼠和狗,能诱导这些动物产生保护性免疫应答,并能抵抗狂犬病病毒致死剂量的攻击[6].用N蛋白基因构建的重组病毒也能抵抗狂犬病病毒致死剂量的攻击[7-8].本研究以狂犬病病毒HEP-Flury株N基因序列为材料,通过生物信息学分析、序列合成与定向克隆方法构建重组表达质粒pET-32-NP并优化表达条件,在体外利用大肠埃希菌表达出带有6×His标签的重组狂犬病病毒N蛋白并经纯化,为狂犬病诊断方法的建立奠定基础.
1 材料与方法
1.1 毒株、载体及主要试剂
狂犬病毒HEP-Flury株、原核表达载体pET-32a(+)、犬抗RV多克隆抗体、基因工程菌为华南农业大学兽医学院微生物学教研室保存.凝胶回收试剂盒、鼠抗His单克隆抗体、HRP标记羊抗犬IgG、HRP标记羊抗鼠IgG、DL2000及DL15000 DNA Marker为天根生化科技(北京)有限公司产品,KpnⅠ、HindⅢPrestained Protein Ladder为Fermentas公司产品,His-Trap FF crude为GE公司产品.
1.2 引物
根据GenBank所收录的HEP-Flury基因序列,分析设计了1对引物,上、下游分别引入KpnⅠ与HindⅢ酶切位点,命名为:

1.3 pET-32-NP重组质粒的构建
以HEP-Flury株N基因序列为参考,通过生物信息学分析,选取抗原决定簇富集区并根据大肠埃希菌密码子偏嗜性作密码子修改,然后引入酶切位点并送上海捷瑞生物技术有限公司合成及定向克隆至原核表达载体pET-32a(+),构建重组表达质粒pET-32-NP.用 RV-N1、RV-N2引物对 pET-32-NP进行PCR检测及KpnⅠ与HindⅢ双酶切鉴定.
1.4 重组核蛋白的诱导表达与鉴定
将重组质粒 pET-32-NP转化至 E.coli BL21(DE3)pLysS,挑取单个菌落扩增后采用不同的IPTG浓度、诱导时间、诱导温度、诱导前D600nm值、培养基抗生素浓度进行诱导表达.优化诱导条件并检测不同表达条件下的表达量,确定最佳诱导条件,同时设立含pET-32a(+)空载体及未诱导的重组质粒转化菌作为对照.重组蛋白按试剂使用说明采用鼠抗His单克隆抗体、犬抗RV多克隆抗体和HRP标记羊抗鼠IgG或HRP标记羊抗犬IgG进行Western-blotting鉴定;SDS-PAGE后切胶,送暨南大学再生医学实验室作蛋白质谱鉴定.
1.5 重组核蛋白的分离与纯化
取菌液以1∶100的体积比进行大量表达,收获菌体后用含8 mol/L尿素的磷酸盐缓冲液悬浮菌体沉淀并超声破碎,4℃下12 000 r/min离心15 min,取上清液过HisTrap FF crude柱.蛋白与柱内Ni2+充分结合后,用含20 mmol/L咪唑的磷酸盐缓冲液洗涤杂蛋白,用含100 mmol/L咪唑的磷酸盐缓冲液洗脱目的蛋白,收集的蛋白作SDS-PAGE鉴定,并用紫外分光光度计测定纯化蛋白的浓度.
2 结果
2.1 pET-32-NP重组质粒的构建
用RV-N1、RV-N2引物对pET-32-NP进行PCR检测.结果显示,在250~500 bp间有一明亮条带.经计算,目的条带与预期片段大小相符,为330 bp.阴性对照无条带出现.对PCR阳性的克隆质粒进行双酶切,亦在250~500 bp间得到大小相符的条带.结果见图1.
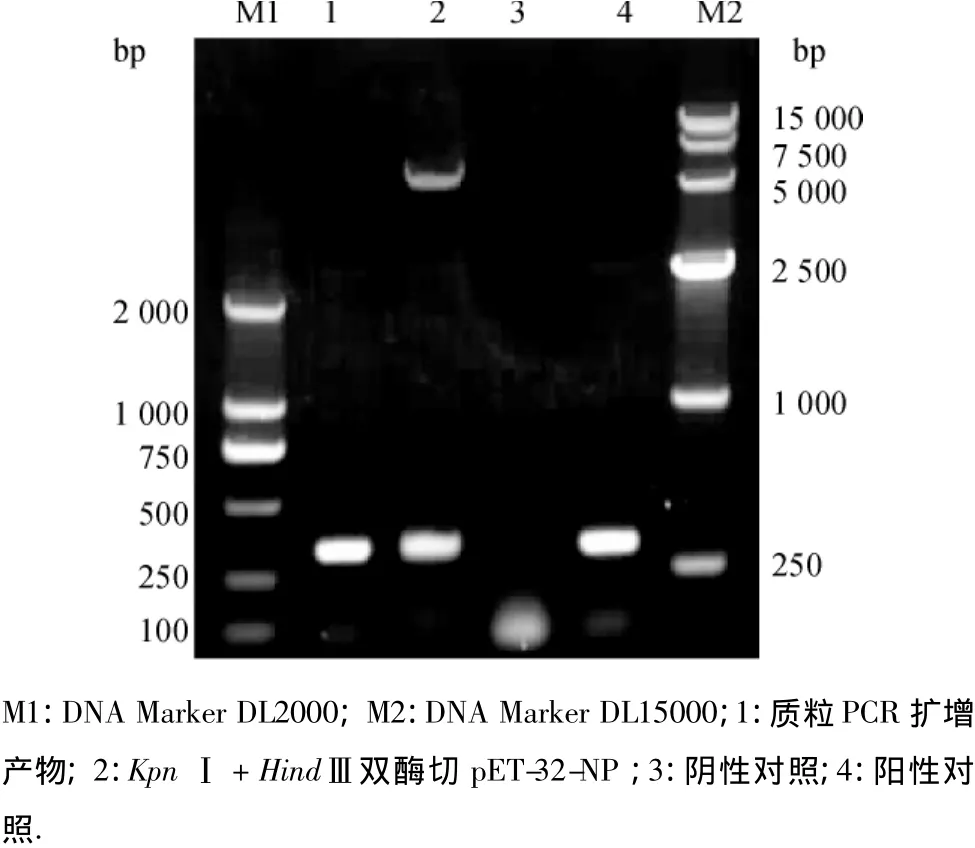
图1 PCR扩增鉴定及双酶切鉴定结果Fig.1 Result of PCR and enzymatic digestion
2.2 重组核蛋白的诱导表达与鉴定
对诱导表达产物进行SDS-PAGE电泳、染色、脱色后发现在相对分子质量约34 000处出现1条新的蛋白带,其大小与带有6×His标签的重组融合RVN蛋白一致.而阴性对照中相应位置没有类似粗细的条带.经多次优化诱导条件发现,不同的IPTG浓度、诱导时间、诱导前D600nm值等条件下表达量未能出现明显的变化,而不同的诱导温度下表达量则有较大的不同.结果显示,28℃诱导表达量较高,且没有出现明显的降解现象,结果见图2.采用MS/MS法对纯化后蛋白进行质谱鉴定,经肽指纹图谱鉴定及部分强信号肽段测序(图3),显示纯化后的蛋白即为狂犬病病毒N蛋白.

图2 核蛋白的诱导表达产物SDS-PAGE分析Fig.2 SDS-PAGE analysis of expressing N protein

图3 肽段测序结果与N蛋白氨基酸序列的比较Fig.3 Comparison of peptide sequencing and N protein amino acid sequence
Western-blotting结果显示,重组狂犬病N蛋白能够被鼠抗His单克隆抗体及犬抗RV多克隆抗体特异性识别(图4).
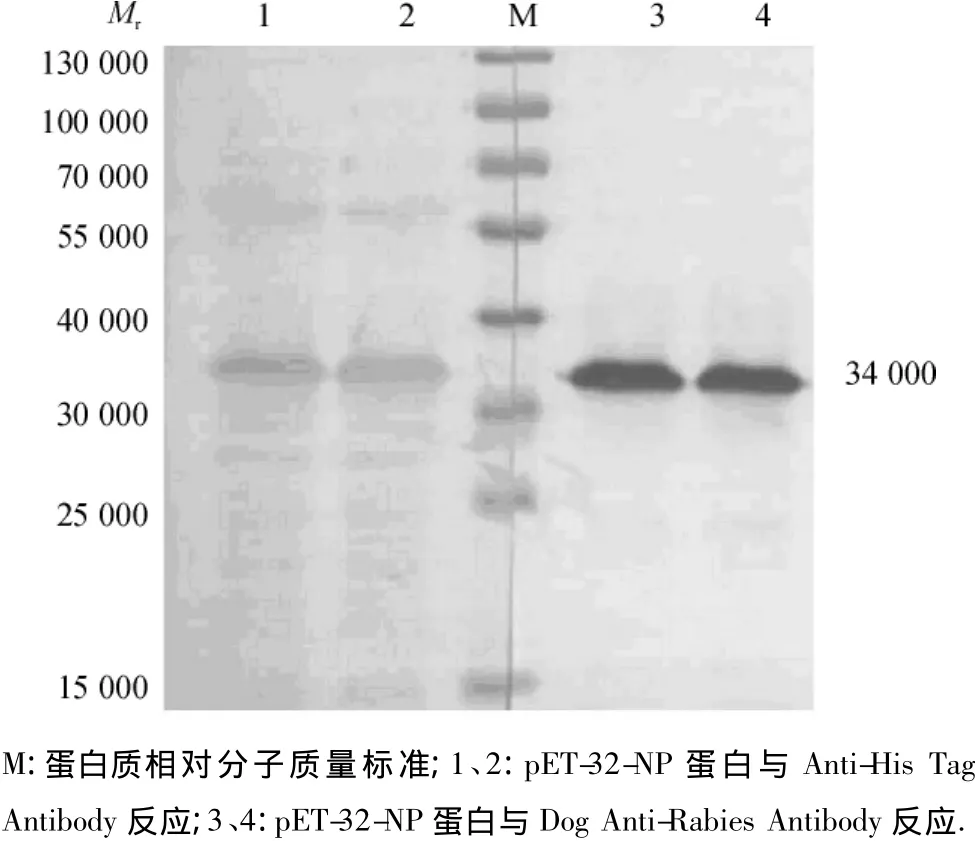
图4 Western-blotting分析Fig.4 Western-blotting analysis
2.3 重组核蛋白的分离与纯化
将分离纯化得到的蛋白进行SDS-PAGE电泳后发现,所得条带清晰明亮,无杂带,经紫外分光光度计测定,质量浓度为1.0 mg/mL.
3 讨论
狂犬病病毒N蛋白的作用不仅仅在于它和基因组RNA紧密结合,保护基因组RNA免受宿主细胞核酸酶的切割,而且它在病毒RNA从转录向复制切换方面起重要作用.N蛋白虽然调控基因组的转录和复制,但其具体机制和过程仍不完全清楚.本研究利用分子生物学方法成功构建了基于原核表达载体pET-32的重组质粒pET-32-NP,优化表达条件后得到了带有6×His标签的融合核蛋白,为进一步探索N蛋白对病毒复制的调控机制奠定了基础.
原核表达常使用的优化条件中,诱导温度对表达量有着极其重要的影响.虽然大肠埃希菌在10~43℃范围内都能够生长并合成蛋白,但研究发现,在37℃条件下细菌生长活跃,合成的蛋白量高,同时由于蛋白酶活性太高,容易造成蛋白质的降解,因此该温度并不利于外源蛋白的大量表达[8].本次研究的结果同样证实了这一现象,重组的核蛋白在37、16℃均不能很好地表达,而在28℃下表达量显著提升,且没有出现明显降解.
真核生物的结构蛋白要进行原核表达,需要考虑其基因中存在较多原核生物难于识别的密码子,如真核生物中编码精氨酸(Arg)的常见密码子agg、aga,编码亮氨酸(Leu)的常见密码子cta等在大肠埃希菌中就缺乏相应的tRNA.有研究显示,这些稀有密码子大量或连续性的出现会严重影响蛋白的表达[9].江飙等[10]和郑佳琳等[11]分别对狂犬病病毒的M和G基因进行了偏嗜性修饰并在大肠埃希菌中获得高效表达.我们之前也曾对未经修饰的狂犬病病毒N基因进行原核表达,但表达量不高[12].为了提高狂犬病病毒N基因的表达水平,我们对狂犬病病毒HEP-Flury N基因进行了生物信息学分析.结果发现,狂犬病病毒N蛋白中仅编码精氨酸的稀有密码子就有24组,亮氨酸的稀有密码子有34组,并且在编码第270与271、357与358、422与423位氨基酸处出现3组精氨酸稀有密码子连续成簇的现象,在编码第143、144、145位氨基酸处出现1组亮氨酸稀有密码子连续成簇的现象.因此,本研究选取N蛋白抗原富集区并根据大肠埃希菌对密码子的偏嗜性进行修改,大大提高了表达量.
[1]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:777-955.
[2]LARSON J K,WUNNER W H,OTVOS L,Jr,et al.Identification of an immunodomin at epitopewithin the phosphoprotein of rabies virus that is recognized by both class I-and class-restricted T cells[J].J Virol,1991,65(11):5673-5679.
[3]RAUX H,ISENI F,LAFAY F,et al.Mapping of monoclonal antibody epitopes of the rabies virus P protein[J].J Gen Virol,1997,78(1):119-124.
[4]RAUX H,FLAMAND A,BLONDEL D.Interaction of the rabies virus P protein with the LC8 dynein light chain[J].J Virol,2000,74(21):10212-10216.
[5]MEBATSION T,WEILAND F,CONZELMANN K K.Matrix protein of rabies virus is responsible for the assembly and budding of bullet-shaped particles and interacts with the transmembrane spike glycoprotein G[J].J Virol,1999,73(1):242-250.
[6]HIRAMATSU K,MIFUNE K,MANNEN K,et al.Mapping of the antigenic determinants recognized by monoclonal antibodies against the M2 protein of rabies virus[J].Virol,1992,187(2):472-479.
[7]CHONG L D,ROSE J K.Interactions of normal and mutant vesicular stomatitis virus matrix proteins with the plasma membrane and nucleocapsids[J].J Virol,1994,68(1):441-447.
[8]于志凤,张守峰,刘晔,等.狂犬病病毒核蛋白基因在大肠杆菌中稳定表达条件的优化及纯化[J].吉林农业大学学报,2008,5(28):581-585.
[9]李宏,哈斯,张鹤龄,等.改造人干扰素α2b基因在大肠杆菌中获得高效表达的理论方法[J].内蒙古大学学报,1998,1(29):63-69.
[10]江飙,郑佳琳,邝贞结,等.狂犬病毒HEP—FIury株基质蛋白的原核表达及纯化[J].中国预防兽医学报,2010,32(5):408-410.
[11]郑佳琳,江飙,郭霄峰.优化密码子以提高狂犬病病毒糖蛋白基因在原核细胞的表达[J].中国人兽共患病学报,2010,26(5):403-407.
[12]官培英.狂犬病毒N基因的原核表达及荧光抗体的制备[D].广州:华南农业大学,2008.
