菌物多糖对巨噬细胞和树突状细胞的免疫刺激作用及信号通路
2012-06-01李宗军
彭 颖,李宗军
菌物多糖对巨噬细胞和树突状细胞的免疫刺激作用及信号通路
彭 颖1,李宗军2,*
(1.湖南农业大学食品科技学院,湖南 长沙 410128;2.国家植物功能成分利用工程技术研究中心功能食品分中心,湖南 长沙 410128)
菌物多糖能激活巨噬细胞和树突状细胞的成熟,提高表面CD80、CD86和组织相容性抗原(MHC)分子的表达,降低树突状细胞的内吞作用,提高巨噬细胞的吞噬能力;促进各种细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-12(IL-12)和效应分子一氧化氮(NO)、活性氧中间体(ROI)的分泌。菌物多糖发挥作用的信号通路可能是菌物多糖通过与两种细胞表面的Toll样受体(TLR)作用,引发巨噬细胞和树突状细胞胞内丝分裂原活化蛋白激酶(MAPKs)的磷酸化,转录因子活化因子蛋白(AP-1)的磷酸化和核转位,以及促进IκB的降解,使转录因子NF-κB向核转移,来调控核基因的转录和表达,从而对巨噬细胞和树突状细胞发挥免疫刺激作用。
菌物多糖;巨噬细胞;树突状细胞;免疫刺激;信号通路
菌物(fungi)是一种低等的真核生物,在最新版《菌物学字典》的解释中,菌物系统包括了黏菌、丝状真菌、色菌、地衣、霉菌、酵母等几大类别[1]。在数千年以前,中国人就知道将菌物茯苓、冬虫夏草、灵芝等作为药物之用,并倡导药食同源的理念,为菌物及其活性成分的开发提供了思路;自1958年,Brander等[2]报道了酵母细胞壁多糖(zymosan)具有抗肿瘤作用以来,人们对菌物多糖的免疫刺激作用产生了浓厚的兴趣。1969年,Ikekawa等[3]首次报道了从某种多孔菌科的蘑菇中提取出了具有抗肿瘤活性的多糖;而后市场出现了从香菇子实体中提取的香菇多糖(lentinan)、从裂褶菌液体培养液中提取的裂褶菌多糖(schizophyllan)、从栓菌培养的菌丝体中提取的云芝多糖(krestin),开发而成的药物[4]。随着越来越高的癌症发病率和死亡率及细菌病毒的感染率,寻找对机体无副作用的抗肿瘤药物及抗微生物的功能食品或药品,成为了科学界研究的热点。
菌物多糖作为一种免疫原,通过提高机体的免疫功能来发挥抗肿瘤和抗微生物的活性功能,且避免了使用抗生素带来的抗生素耐药性问题和减轻了单一使用化学放射疗法治疗癌症所带来的副作用。菌物多糖对机体的免疫刺激活性是多方面、多层次的,从先天免疫到适应性免疫,从免疫器官、免疫细胞到免疫分子都具有显著的免疫刺激效应;它能活化巨噬细胞、单核细胞、中性粒细胞、自然杀伤力细胞、树突状细胞、B细胞、T细胞,激发信号分子如细胞因子,细胞毒性分子如NO分子、活性氧分子的产生,促进免疫细胞因子和细胞因子受体的基因表达[5-10]。菌物多糖的单糖种类、分子质量、侧链的长度、主链上侧链的数目,1,4、1,6和1,3糖苷键的比例,溶解度都影响着菌物多糖的免疫刺激活性[11-12];现已研究较多的菌物多糖有从真菌和酵母中分离的β-1,3-葡聚糖,从白色念珠菌提取的甘露聚糖[13]。树突状细胞和巨噬细胞均属于先天免疫系统,但它们在先天免疫与适应性免疫反应中起着重要的桥梁作用。本文主要探讨菌物多糖对巨噬细胞和树突状细胞的免疫刺激作用及菌物多糖刺激这两种免疫细胞可能的免疫信号通路,为阐明菌物多糖的免疫刺激作用及机理提供理论依据。
1 巨噬细胞和树突状细胞在免疫系统中的关键作用
免疫系统对于机体自身的监测,抗原的摄取是首要步骤;而这个过程极大地依赖于抗原呈递细胞。巨噬细胞和树突状细胞均属于主要的抗原呈递细胞(APC),它们能区分自己和非己成分,根据遇到的不同抗原,激活不同的响应机制来引发相应的免疫应答。
巨噬细胞也是一种吞噬细胞,由于其强大的组织渗透能力,能吞噬病原物质,介导抗体依赖的细胞毒性作用(ADCC),分泌细胞因子;直接或间接地提高机体免疫力。它分泌出来的细胞因子和趋化因子,在激发适应性免疫和协调各种免疫反应方面起着核心的作用[14];细胞因子是一种低分子质量的蛋白质,能调整免疫反应的强度和持续时间;趋化因子是一种小分子多肽,它负责让免疫细胞到达感染部位发挥作用。
单核细胞来源的树突状细胞(DCs)产生的白细胞介素-12(IL-12)是让机体从先天性免疫应答过渡到适应性免疫应答的关键细胞因子。它能启动辅助T细胞1(Th1)的反应[15];而Th1能产生干扰素- γ(IFN- γ)和白细胞介素-2(IL-2)来进一步刺激下游的细胞介导的免疫[16]。另一方面,巨噬细胞和树突状细胞分泌白细胞介素-8(IL-8)、干扰素诱导蛋白-10 (IP-10)、巨噬细胞炎症蛋白-1α(MIP-1 α)、巨噬细胞炎症蛋白-1β(MIP-1β) ;它们与抗原受体结合后,IL-8招募嗜中性粒细胞,IP-10引导激活的T细胞到达被感染的组织[17],而MIP诱导自然杀伤力细胞的浸润。
由此可见,巨噬细胞和树突状细胞在免疫系统中的重要作用,以这两种免疫细胞来评价菌物多糖对机体免疫刺激作用备受关注。
2 菌物多糖对巨噬细胞的免疫刺激作用
巨噬细胞来源于骨髓干细胞,是单核吞噬细胞系统中高度分化、成熟的细胞类型,由血液中单核细胞迁入组织后分化而成。它是先天免疫中典型的效应细胞,主要有两个方面的作用:一个是通过吞噬作用或者细胞毒性作用清除异物,二是抗原递呈作用,即把蛋白质抗原在细胞内降解为能与MHC分子结合的肽,将其展示于细胞表面供T淋巴细胞识别。巨噬细胞在免疫系统中占据着独特的优势地位,因为它不仅启动先天免疫应答,而且还是这些免疫应答的效应细胞[18]。
TNF-α是巨噬细胞介导的肿瘤细胞溶解的效应分子,通过诱发多种细胞内途径,产生活性氧中间产物(ROI),增加线粒体质膜的通透性[19];通过绑定诱导性一氧化氮合酶(iNOS)基因上游启动子反应元件,引发iNOS基因的转录,而诱导NO的产生[20]。Yu Mengyao等[21]从毛木耳中提取的毛木耳多糖,在很低的剂量下能刺激巨噬细胞株RAW 264.7产生TNF-α增强mRNA的转录。NO被认为是激活的巨噬细胞产生的主要导致肿瘤细胞凋亡的效应分子,能引导肿瘤细胞的凋亡,其途径有P53的积累,抑制线粒体呼吸,改变Bcl-2家族成员的表达,激活蛋白信号和DNA的损伤[22]。毛木耳多糖能诱导巨噬细胞产生NO,并呈剂量效应关系,这是由iNOS基因的翻译和转录水平的提高而引起的[20]。白细胞介素-1(IL-1)在体外具有直接的细胞中毒和细胞毒杀作用[23],白细胞介素-6(IL-6)是主要免疫和炎症因子,毛木耳多糖能刺激巨噬细胞分泌IL-1和IL-6两种细胞因子。Masuda等[24]从灰树花的子实体中提取了一种β-葡聚糖,命名为MD-Fraction,它在体外能直接激活巨噬细胞;在老鼠体内,它能提高巨噬细胞表面MHCⅡ分子和CD86的表达,能更高效的将抗原呈递给辅助T细胞,从而提高其抗原呈递作用;能提高巨噬细胞分泌IL-12和TNF-α的产量,TNF-α对恶性肿瘤细胞具有细胞毒作用;IL-12不仅能激活自然杀伤力细胞(NK)、T细胞;而且能通过对巨噬细胞的激活作用,提高Th1细胞介导的细胞免疫效应从而发挥抗肿瘤的功效(图1)。Kim等[25]从桑黄中提取了一种酸性多糖,能增强腹腔巨噬细胞的吞噬能力;通过促使巨噬细胞分泌更多的NO和TNF-α,这种多糖对Yac-1细胞具有细胞毒性作用;能提高巨噬细胞表面共刺激分子、CD80、CD86和MHCⅡ分子的表达,在体内这些表面分子表达的升高,能激发T细胞介导的免疫对恶性细胞的作用(图1)。据报道[26-27],从地衣中提取的多糖能提高鼠腹腔巨噬细胞分泌TNF-α、NO、活性氧 (ROS)的水平;从猴头菇中提取的多糖能刺激巨噬细胞产生IL-1β、TNF-α、NO[10];从蛹虫草中提取的多糖亦能刺激巨噬细胞产生IL-1β、TNF-α、NO[28],这些菌物多糖都具有免疫刺激作用(图1)。而用TLR2、TLR4、CR3、dectin-1的抗体处理桦褐孔菌多糖介导的巨噬细胞分泌TNF-α过程,发现只有TLR2的抗体显著抑制了TNF-α的分泌(45%),表明TLR2参与桦褐孔菌多糖介导的巨噬细胞分泌TNF-α的过程[29]。
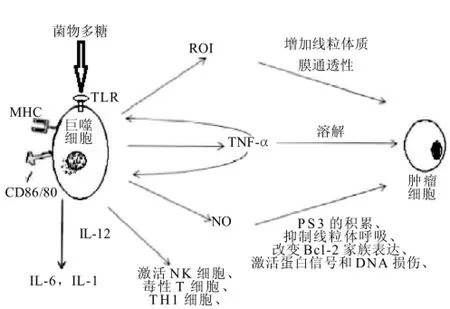
图1 菌物多糖对巨噬细胞的免疫刺激作用Fig.1 Immunostimulating effect of fungal polysaccharides on macrophages
3 菌物多糖对树突状细胞的免疫刺激作用
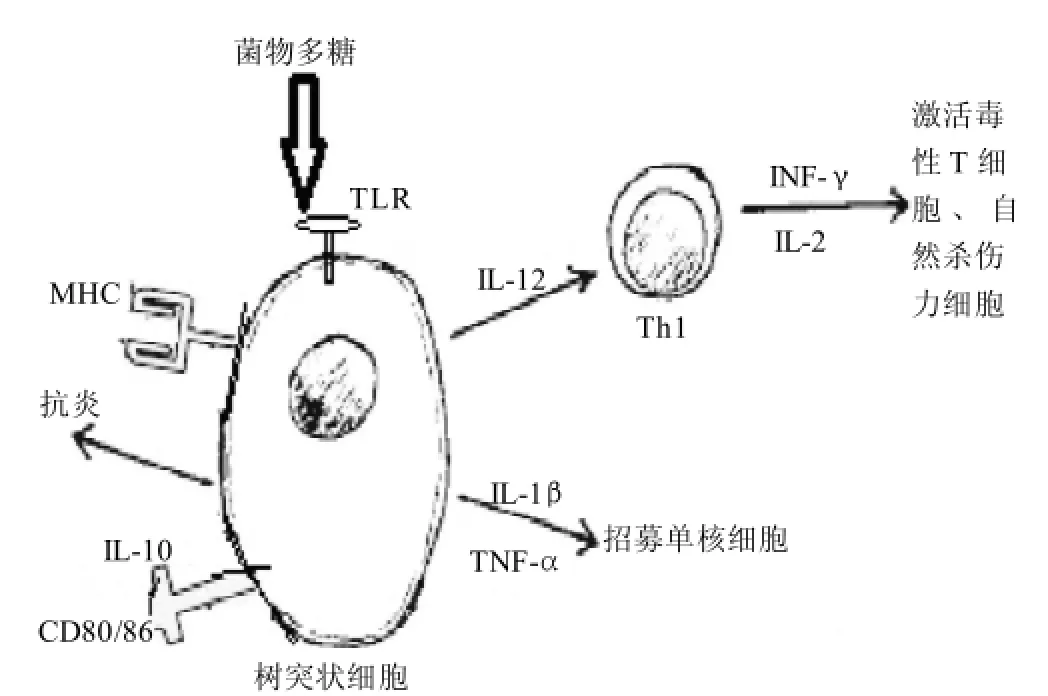
图2 菌物多糖对树突状细胞的免疫刺激作用Fig.2 Immunostimulating effect of fungal polysaccharides on dendritic cells
树突状细胞是专职的抗原呈递细胞,激活的DCs能呈递抗原给辅助T细胞、毒性T淋巴细胞和激活自然杀伤力细胞,在先天免疫和适应性免疫中都起着重要的作用。未成熟的DCs表达低水平的主要组织相容性复合物抗原Ⅱ(MHCⅡ),在外周组织中像一个哨兵一样专门捕捉和处理外源性抗原。炎症因子如TNF-α、IL-1能诱导巨噬细胞的成熟;病原相关分子模式(PAMP)通过Toll样受体(TLR)及其他受体分子,也能诱导巨噬细胞的成熟[30-31]。成熟的DCs开始向淋巴组织转移,同时表达高水平的 MHCⅡ和共刺激分子,高效刺激T细胞,同时也伴随着抗原呈递作用的下降[32],DCs亚群表现出功能异质性,根据成熟阶段,表现出免疫原性和免疫耐受性。在炎症细胞因子和病原相关分子模式存在的条件下,DCs能有效刺激免疫系统,没有这些信号分子存在时,它们维持不成熟的表现型,导致免疫耐受。因此,DCs的成熟是增强免疫力的关键[33-34]。
近几年,很多研究都集中于菌物多糖诱导DCs的成熟,如桑黄多糖[35]、蛹虫草多糖[36]、云芝多糖[37]、姬松茸多糖[38]、灰树花多糖[39]、绣球菌多糖[40]。这些菌物多糖对DCs有四方面的刺激作用:增强MHC-Ⅰ/Ⅱ和共刺激分子CD40和CD80/86的表达;降低树突状细胞的内吐作用;增加细胞因子的产生;增强激活T细胞的作用,使T细胞增殖并产生细胞因子。绣球菌多糖[40]能刺激树突状细胞分泌更多的细胞因子,IL-12能激活Th1,激活的Th1能分泌IFN-γ和IL-2,而这两种细胞因子能激活毒性T细胞,NK细胞发挥抗肿瘤抗微生物作用;其他炎症细胞因子如IL-1β、TNF-α能招募单核细胞(图2)。实验用了C3H/HeN和C3H/HeJ两种老鼠来源的树突状细胞,C3H/HeJ的TLR4的基因已突变,结果显示,绣球菌多糖能增强C3H/HeN来源的树突状细胞的表面MHCⅡ、CD80和CD86的表达,降低C3H/HeN来源的树突状细胞的内吞作用;但对C3H/HeJ来源的树突状细胞却没有影响;表明绣球菌多糖增强树突状细胞的成熟和功能是通过与树突状细胞膜表面的受体TLR4作用实现的。灰树花多糖[39]能刺激骨髓来源的树突状细胞表面CD80、CD86、CD83和MHCⅡ的表达,显著的刺激树突状细胞分泌IL-12和TNF-α,呈剂量依赖关系;用灰树花多糖处理过的DCs能显著刺激同种异系和抗原特异性的同源T细胞的应答;这表明灰树花多糖诱导DC表型的成熟和刺激T细胞的增殖。用灰树花多糖处理的树突状细胞能提高同源的CD4+T细胞分泌抗原特异性的IFN-γ的产量,当使用抗IL-12的抗体,这种影响被抑制了;相反地,却不影响CD4+T细胞IL-4的产量,表明由灰树花多糖处理过的DCs产生的IL-12是提高CD4+T细胞产生IFN-γ必要的条件。如图2所示,IL-10是抗炎症反应中主要参与的细胞因子, Smith等[7]用11种层析法纯化的地衣多糖对单核细胞来源的树突状细胞的免疫刺激作用作了研究,4种多糖能提高树突状细胞分泌IL-10的量,有5种多糖能提高树突状细胞IL-12 P40的分泌量,只有1种多糖能降低树突状细胞IL-12 P40的分泌量。用IL-12 P40和IL-10的比例来研究这两种细胞因子之间的关系,表明地衣多糖(l i c h e n a n)、石耳素(pustulan)、Ths-2、Heteroglycan thamnolan这4种多糖所刺激的树突状细胞与对照组相比,比例都显著下降,这主要是由于多糖刺激树突状细胞分泌了更多的IL-10;而用这4种多糖所刺激的树突状细胞,与原始T细胞共培养,虽有两种多糖刺激的树突状细胞,与未用多糖刺激的成熟树突状细胞相比,使原始T细胞分泌的IL-4有所提高,但未达到显著水平。
4 TLRs/MAPK/NF-κB信号通路介导的菌物多糖对巨噬细胞和树突状细胞的免疫调节作用
目前的研究表明,多糖通过和受体相互作用向巨噬细胞和树突状细胞传递信号,从而激活巨噬细胞和树突状细胞,其信号途径主要涉及:丝裂原- 活化蛋白激酶(MAPK)、蛋白激酶C(PKC)、Toll 样受体(TLRs)、异常环氧酶-2(COX-2)、活化因子蛋白-1(AP-1)、核因子κB(NF-κB)等。细胞信号的级联放大作用及不同信号途径之间的交谈和相互作用构成了一个非常复杂的调控网络。而菌物多糖对巨噬细胞和树突状细胞的免疫调节作用与TLR/NF-κB/MAPK信号通路密切相关。
TLRs家族是识别入侵病原体的主要先天免疫受体分子。菌物多糖作为一种免疫原被TLRs识别,一旦与其特异性配体结合,可激活信号转导级联,导致NF-κB和MAPK的激活及免疫反应基因的表达。TLRs信号能通过诱导促炎细胞因子的产生,并上调共刺激分子的表达迅速激活先天免疫,激活的先天免疫随后导致有效的获得性免疫的激活,因此它不仅激活先天免疫, 而且最终激活适应性免疫。
MAPKs是存在于真核细胞的一组高度保守的丝氨酸/苏氨酸蛋白激酶,包括细胞外信号控制激酶(ERK)、c-Jun N端激酶(JNK)和P38;当受到脂多糖(LPS)、促炎细胞因子、多糖等各种胞外刺激后,通过将两个丝氨酸残基磷酸化来激活MAPK,激活的MAPK转位到细胞核,通过磷酸化蛋白质控制染色体结构;以及通过磷酸化若干转录因子,如AP-1,用于基因的转录[41]。NF-κB是真核细胞中普遍存在的一种转录因子,在调节免疫应答、炎症反应、细胞增殖、分化及凋亡等方面起关键作用;在正常情况下,NF-κB 与其抑制物抑制性κB(IκB) 结合,存在于细胞质中,IκB遮蔽着NF-κB 的基因定位序列,NF-κB 的生物学活性不表现出来。当细胞受炎症介质、病毒感染、氧化应激等一系列刺激因子刺激时,通过IκB激酶(IKK)复合物激活,IκB 将发生磷酸化并迅速降解,NF-κB 从受IκB 结合所处的抑制状态解除,游离的NF-κB 转移到胞核,与一系列靶基因,如细胞因子、生长因子、细胞黏附分子等的增强子位点结合,增强靶基因的转录,包括TNF-α、IL-1、IL-6、IL-8、IL-12等[42]。
Won等[43]研究了桦褐孔菌多糖激活RAW264.7巨噬细胞的分子机制,在激活的巨噬细胞中MAPKs均磷酸化,用MPAKs的特异性抑制剂处理巨噬细胞,由桦褐孔菌多糖和LPS诱导的巨噬细胞吞噬作用被抑制;而由桦褐孔菌多糖和LPS处理的巨噬细胞,胞质NF-κB 的表达水平降低,而细胞核的NF-κB 的表达水平升高,进一步用NF-κB 核转位抑制剂处理巨噬细胞,不但有效地抑制了NF-κB 的激活,IκB的磷酸化,最终抑制了由LPS和桦褐孔菌多糖诱导的巨噬细胞吞噬作用;桦褐孔菌多糖能诱导巨噬细胞分泌TNF-α,用TLR2抗体处理巨噬细胞,抑制了其分泌TNF-α,表明桦褐孔菌通过受体TLR2传达信号给巨噬细胞,导致了巨噬细胞TNF-α的分泌。Lin Yuli等[44]从灵芝中提取的灵芝多糖(PSG)处理人类单核细胞来源的树突状细胞,能提高其CD80、CD86、CD83、CD40、CD54、HLA-DR(属MHC-Ⅱ类分子)表面分子的表达,IL-12 p70、p40和IL-10细胞因子的产生,增强了树突状细胞激活T细胞的能力。用TLR4的抗体处理PS-G的树突状细胞,其激活作用被抑制,表明TLR4是PS-G激活树突状细胞的受体;用PS-G诱导的树突状细胞、I κ B激酶、NF-κB被激活,MAPK磷酸化增加;用NF-κ B和p38 MAPK的抑制剂处理PS-G树突状细胞,表面分子CD80、CD86、CD83、CD40、CD54、HLA-DR的表达被抑制,细胞因子IL-12 p70、p40和IL-10的产生受到抑制,这些结果表明,TLRs/P38 MAPK/NF-κB信号通路在灵芝多糖(PS-G)激活树突状细胞中所起的重要作用。绣球菌水溶性葡聚糖(Sc-SG)能刺激巨噬细胞产生NO且提高了iNOS的表达水平,NO的产量强烈地被MAPK的抑制剂所抑制,表明Sc-SG诱导巨噬细胞产生NO是由MAPK介导的,它诱导了ERK、JNK、P38的磷酸化,引发了转录因子AP-1的磷酸和转位[45]。绣球菌多糖通过TLR4能提高树突状细胞胞内ERK、p38和JNK的磷酸化,提高树突状细胞NF-κB p50/p65的核转位,表明绣球菌多糖激活树突状细胞分泌IL-12、IL-1β、TNF-α和IFN-α/β,提高IL-2的产量、促进原始T细胞的分化、降低内吞作用,可能也是通过TLRs/MAPK/NF-κB 信号通路完成的[40]。
5 结 语
不同的菌物多糖具有不同的化学结构,在免疫刺激活性上也表现出了差异性,如不同的菌物多糖绑定不同的受体分子,诱导不同细胞因子的产生,但哪种菌物多糖在抗病毒细菌感染、抗肿瘤方面最有效,而又是什么原因导致这种菌物多糖具有了抗微生物与肿瘤的高效性,只有解决了这些问题才能更有针对性地开发相应的功能食品或药品;对 TLRs/MAPK/NF-κ B信号通路的发现及其作用机制的部分阐明,为菌物多糖对巨噬细胞和树突状细胞的免疫调节机理研究提供了新的策略和方向,目前关于菌物多糖与 TLRs/MAPK/NF-κB信号通路关系的研究尚不成熟,可能还存在与其他信号通路的相互交谈和作用,虽能刺激巨噬细胞和树突状细胞的成熟,启动适应性免疫,增强宿主免疫而发挥抗肿瘤作用,但是是否会导致过度的免疫应答而产生免疫疾病,且在正常人和癌症病人体内,菌物多糖与TLRs/MAPK/NF-κ B作用是否一样,产生的效果是否是相应机体所需,有待进一步地研究。
[1]KIRK P M, CANNON P F, DAVID J C, et al. Ainsworth & Brisby,s dictionary of the fungi[M]. 10th ed. Wallingford: CAB International, 2008.
[2]BRANDER W T, CLARKE D A, STOCK C C. Stimulation of host defence against experimental cancer Ⅰ. zymosan and sarcoma 180 in mice[J]. Cancer Res, 1958, 18: 347-351.
[3]IKEKAWA T, UEHARA N, MAEDA Y, et al. Antitumor activity of aqueous extracts of edible mushrooms[J]. Cancer Res, 1969, 29: 734-735.
[4]IKEKAWA T, SAITOH H, FENG W, et al. Antitumor activity of extracts and polysaccharides[J]. Chem Pharm Bull (Tokyo), 1992, 40: 1954-1957.
[5]CHIHARA G, HAMUIA J, MAEDA Y Y, et al. Fractionation and purification of the polysaccharides with marked antitumour activity especially lentinan from Lentinus edodes[J]. Cancer Res, 1970, 30: 2776-2781.
[6]WASSER S P. Medicinal mushroom science: history, current status, future trends, and unsolved problems[J]. Int J Med Mushrooms, 2010, 12(1): 1-16.
[7]SMITH J E, SULLIVAN R, ROWAN N J. The role of polysaccharides derived from medicinal mushrooms in cancer treatment programs: current perspectives (review)[J]. Int J Med Mushrooms, 2003, 5: 217-234.
[8]OMARSDOTTIR S, OLAFSDOTTIR E S, FREYSDOTTIR J. Immunomodulating effects of lichen-derived polysaccharides on monocyte-derived dendritic cells[J]. International Immunopharmacology, 2006, 6: 1642-1650.
[9]KIM Y O, PARK H W, KIM J H, et al. Anti-cancer effect and structural characterization of endo-polysaccharide from cultivated mycelia of Inonotus obliquus[J]. Life Sci, 2006, 79: 72-80.
[10]LEE J S, CHO J Y, HONG E K. Study on macrophage activation and structural characteristics of purified polysaccharides from the liquid culture broth of Hericium erinaceus[J]. Carbohydr Polym, 2009, 78: 162-168.
[11]WASSER S P. Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J]. Appl Microbiol Biotechnol, 2002, 60: 258-274.
[12]ISHIBASHI K I, DOGASAKI C, IRIKI T, et al. Anti-β-glucan antibody in bovine sera[J]. Int J Med Mushrooms, 2005, 7: 513-524.
[13]ZHANG M, CUI S W, CHEUNG P C K, et al. Antitumor polysaccharides from mushrooms: a review on their isolation, structural characteristics and antitumor activity[J]. Trends Food Sci Technol, 2007, 18: 4-19.
[14]JAKOBISIAK M, LASEK W, GOLAB M. J Natural mechanisms protecting against cancer[J]. Immunology Letters, 2003, 90: 103-122.
[15]CELLAR M, SCHEIDEGGER D, PALMER L, et al. Ligation of CD40 on dendritic cells triggers production of high levels of interleukin-12 and enhances T cell stimulatory capacity: T-T help via APC activation[J]. Journal of Experimental Medicine, 1996, 184: 747-752.
[16]QIN Z, BLANKENSTEIN T. CD4+T cell-mediated tumor rejection involves inhibition of angiogenesis that is dependent on IFN gamma receptor expression by nonhematopoietic cells[J]. Immunity, 2004, 12: 677-686.
[17]KHAN I, MACLEAN J A, LEE F, et al. The IP-10 chemokine is critical for effector T cell trafficking and host survival in Toxoplasma gondii infection[J]. Immunity, 2000, 12: 483-494.
[18]NOVAK M, VETVICKA V. Beta-glucans, history, and the present: immunomodulatory aspects and mechanisms of action[J]. J Immunotoxicol, 2008, 5: 47-57.
[19]GOOSSENS V, GROOTEN J, de VOS K, et al. Direct evidence for tumor necrosis factor-induced mitochondrial reactive oxygen intermediates and their involvement in cytotoxicity[J]. Proc Natl Acad Sci USA, 1995, 92: 8115-8119.
[20]LOWENSTEIN C J, ALLEY E W, RAVAL P, et al. Macrophage nitric oxide synthase gene: two upstream regions mediate induction by interferon gamma and lipopolysaccharide[J]. Proc Natl Acad Sci USA, 1993, 90: 9730-9734.
[21]YU Mengyao, XU Xiaoyan, QING Yuan, et al. Isolation of an antitumor polysaccharide from Auricularia polytricha (jew,s ear) and its effects on macrophage activation[J]. Eur Food Res Technol, 2009, 228: 477-485.
[22]UMANSKY V, SCHIRRMACHER V. Nitric oxide-induced apoptosis in tumor cells[J]. Adv Cancer Res, 2001, 82: 107-131.
[23]LAVNIKOVA N, BURDELYA L, LAKHOTIA A, et al. Macrophage and interleukin-1 induced nitric oxide production and cytostasis in hamster tumor cells varying in malignant potential[J]. J Leukoc Biol, 1997, 61: 452-458.
[24]MASUDA Y, KODAMA N, NANBA H. Macrophage J774.1 cell is activated by MZ-Fraction (Klasma-MZ) polysaccharide in Grifola frondosa[J]. Mycoscience, 2006, 47: 360-366.
[25]KIM G Y, CHOI G S, LEE S H, et al. Acidic polysaccharide isolated from Phellinus linteus enhances through the up-regulation of nitric oxide and tumor necrosis factor- from peritoneal macrophages[J]. Journal of Ethnopharmacology, 2004, 95: 69-76.
[26]CHOI H S, YIM J H, LEE H K, et al. Immunomodulatory effects of polar lichens on the function of macrophages in vitro[J]. Mar Biotechnol, 2009, 11: 90-98.
[27]OMARSDOTTIRA S, FREYSDOTTIRB J, OLAFSDOTTIR E S. Immunomodulating polysaccharides from the lichen Thamnolia vermicularis var. subuliformis[J]. Phytomedicine, 2007, 14: 179-184.
[28]LEE J S, KWON J S, WON D P, et al. Study on macrophage activation and structural characteristics polysaccharide from the liquid culture broth of Cordyceps militaris[J] .Carbohydrate Polymers, 2010, 82: 982-988.
[29]LEE J S, HONG E K. Immunostimulating activity of the polysaccharides isolated from Cordyceps militaris[J]. Int Immunopharmacol, 2011, 10: 1226-1233.
[30]WARGER T, OSTERLOH P, RECHTSTEINER G. Synergistic activation of dendritic cells by combined Toll-like receptor ligationinduces superior CTL responses in vivo[J]. Blood, 2006, 108: 544-550.
[31]SUGIYAMA T, HOSHINO K, SAITO M, et al. Immunoadjuvant effects of polyadenylic: polyuridylic acids through TLR3 and TLR7[J]. Int Immunol, 2008, 20: 1-9.
[32]SOUSA C R E. Dendritic cells in a mature age[J]. Nat Rev Immunol, 2006, 6: 476-483.
[33]CURTSINGER J M, LINS D C, MESCHER M F. Signal 3 determines tolerance versus full activation of naive CD8 T cells: dissociating proliferation and development of effector function[J]. J Exp Med, 2003, 197: 1141-1151.
[34]BALLESTRERO A, BOY D, MORAN E, et al. Immunotherapy with dendritic cells for cancer[J]. Adv Drug Deliv Rev, 2008, 60: 173-183.
[35]KIM G Y, HAN M G, SONG Y S, et al. Proteoglycan isolated from Phellinus linteus induces toll-like receptors 2- and 4-mediated maturation of murine dendritic cells via activation of ERK, p38, and NF-κ B[J]. Biol Pharm Bull, 2004, 27: 1656-1662.
[36]KIM G Y, KO W S, LEE J Y, et al. Water extract of Cordyceps militaris enhances maturation of murine bone marrow-derived dendritic cells in vitro[J]. Biol Pharm Bull, 2006, 29: 354-360.
[37]KANAZAWA M, MORI Y, YOSHIHARA K, et al. Effect of PSK on the maturation of dendritic cells derived from human peripheral blood monocytes[J]. Immunol Lett, 2004, 91: 229-238.
[38]KIM G Y, LEE M Y, LEE H J, et al. Effect of water-soluble proteoglycan isolated from Agaricus blazei on the maturation of murine bone marrowderived dendritic cells[J]. Int Immunopharmacol, 2005, 5: 1523-1532.
[39]MASUDA Y, ITO O, KONISHI M, et al. A polysaccharide extracted from Grifola frondosa enhances the anti-tumor activity of bone marrow-derived dendritic cell-based immunotherapy against murine colon cancer[J]. Cancer Immunol Immunother, 2010, 59: 1531-1541.
[40]KIM H S, KIM J Y, RYU H S, et al. Induction of dendritic cell maturation by β-glucan isolated from Sparassis crispa[J]. International Immunopharmacology, 2010, 10: 1284-1294.
[41]SCHOREY J S, COOPER A M. Macrophage signaling upon mycobacterial infection: the MAP kinases lead the way[J]. Cell Microbiol, 2003, 5: 133-142.
[42]KUMAR A, TAKADA Y, BORIEK A M, et al. Nuclear factor-kappa B: its role in health and disease[J]. J Mol Med, 2004, 82: 434-448.
[43]WON D P, LEE J S, KWON D S, et al. Immunostimulating activity by polysaccharides isolated from fruiting body of Inonotus obliquus[J]. Mol Cells, 2011, 31: 165-173.
[44]LIN Yuli, LIANG Y C, LEE S S, et al. Polysaccharide purified from Ganoderma lucidum induced activation and maturation of human monocytederived dendritic cells by the NF-κB and p38 mitogen-activated protein kinase pathways[J]. Journal of Leukocyte Biology, 2005, 78: 533-543.
[45]LEE S Y, LEE Y G, BYEON S E, et al. Mitogen activated protein kinases are prime signalling enzymes in nitric oxide production induced by soluble β-glucan from Sparassis crispa[J]. Arch Pharm Res, 2010, 33(11): 1753-1760.
Immunostimulating Effect and Signal Pathway of Fungal Polysaccharides on Macrophages and Dendritic Cells
PENG Ying1,LI Zong-jun2,*
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China;2. National Research Center of Engineering and Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China)
Fungal polysaccharides can activate the maturation of macrophages and dendritic cells, stimulate the expression of CD80, CD86 and major histocompatibility complex (MHC) on the surface of macrophages and dendritic cells, decrease the endocytosis of dendritic cells, enhance the phagocytic activity of macrophages, and increase the production of cytokines such as tumor necrosis factor-α (TNF-α) and interleukin 12 (IL-12), and effector molecules such as nitric oxide (NO) and reactive oxygen intermediates (ROI). The signal pathway of fungal polysaccharides for affecting macrophages and dendritic cells may be due to the interaction between fungal polysaccharides and Toll-like receptors (TLR), thus stimulating the phosphorylation of mitogen-activated protein kinases (MAPKs), triggering the phosphorylation and transcription of transcription factor AP-1, accelerating the degradation of IκB and nuclear translocation of NF-κB, and regulating the transcription and expression of nuclear genes to modulate the immune response.
fungal polysaccharides;macrophages;dendritic cells;immunostimulation;signal pathway
Q74;R392.12
A
1002-6630(2012)15-0318-06
2011-06-21
湖南省科技厅重大科技专项(2008FJ1005)
彭颖(1987—),女,硕士研究生,研究方向为营养与食品卫生。E-mail:pengying215@126.com
*通信作者:李宗军(1968—),男,教授,博士,研究方向为食品生物技术。E-mail:lizongjun@yahoo.com.cn
