银合欢种子多糖微结构的原子力显微镜观察
2012-06-01杨永利郭守军叶文斌潘显辉林月娟林海雄
杨永利,郭守军,叶文斌,潘显辉,林月娟,林海雄
银合欢种子多糖微结构的原子力显微镜观察
杨永利1,郭守军1,叶文斌2,潘显辉2,林月娟3,林海雄1
(1.韩山师范学院生物系,广东 潮州 521021;2.西北师范大学生命科学学院,甘肃 兰州 730070;3.汕头大学分析测试中心,广东 汕头 515063)
目的:通过对银合欢种子多糖的形貌观察,研究其微结构。方法:采用热水浸提法提取银合欢种子多糖,通过改变溶液的质量浓度、云母基底表面的化学修饰等不同制样方式,用原子力显微镜(AFM)可视化不同样品制备条件形成的聚集体和非聚集体银合欢半乳甘露聚糖结构形貌。结果:样品在不同制备条件下得到膜状、颗粒状的聚集体结构和非聚集体单糖分子结构。结论:银合欢种子多糖的单个糖分子呈线形螺旋状,并具有短的分枝结构,分子链间互相缠绕,而形成网格状。
原子力显微镜; 银合欢多糖; 微结构
银合欢(Leucaena glaucal (L. ) Benth)为豆科含羞草亚科银合欢属多年生灌木或乔木,原产美洲,现广泛分布于世界热带亚热带地区,我省资源丰富。银合欢种子胚乳富含多糖,主要成分是半乳甘露聚糖,其结构是由β- D- 甘露糖通过α-1,4糖苷键连接形成主链,在某些甘露糖残基上半乳糖通过 α-1,6糖苷键形成侧链而构成的多分枝聚糖。半乳甘露聚糖胶具有较好的水溶性和交联性,在低浓度下能形成高黏度的稳定性水溶液[1],所以被作为增稠剂、稳定剂、凝胶剂、黏合剂而广泛应用食品、医药、石油、纺织和造纸等领域。
我国对多糖的研究多限一级结构的解析,有关立体结构方面的研究刚刚起步。目前,对多糖二级结构的研究存在许多困难[2]。由于多糖相对分子质量较大,结构复杂,难以得到良好的晶形,而且在水溶液的分散状态下难以形成刚性的结构,因此给多糖二级结构乃至高级结构的研究造成了很大的困难[3-5]。原子力显微镜(atomic force microscope,AFM)是在扫描隧道电子显微镜(scanning tunneling microscope,STM)基础上发展起来的一种新颖的物质结构分析方法。AFM的出现,使得对多糖这样的生物大分子表面形貌的观察成为可能[6-8]。AFM相对于电子显微镜(electronmicroscope,EM)和STM在生物大分子结构研究中具有明显优势,生物大分子样品无需用重金属包裹或制作金属复制物,可以在空气或各种溶剂体系中直接观测,使得生物大分子样品能在接近生理环境的条件下直接进行研究,这是其他化学、物理分析方法所无法替代的。通过控制成像操作力的大小,采用合适的成像模式不引起样品分子的漂移和损坏,图像的可重复性大大提高;现场操作性好,能够研究监测整个生化反应的动力学过程;载体的选择更加简单,范围也更大,包括云母片、玻璃片、石墨、二氧化硅和某些生物膜等,但在生物大分子结构研究中最常用的是新鲜解离的云母片,主要因为云母片非常平整且容易处理[4]。近年来对小核菌多糖[9]和植物多糖[3,10-11]等大分子链构象的研究中,都用AFM观察到了多糖的微观结构。
本实验通过不同的制样方法,将多糖样品分散在云母片上,采用轻敲模式,用AFM扫描多糖样品,获得了较清晰的银合欢多糖的单分子链结构影像及分子的聚集态,为进一步半乳甘露聚糖的结构,揭示多糖的构效关系,提供了重要依据。
1 材料与方法
1.1 材料与试剂
银合欢种子由云南省种苗总站提供。
无水乙醇、乙醚、丙酮 天津红岩试剂厂;吐温-80 广州市裕祥化工有限公司;以上试剂均为国产分析纯。
1.2 仪器与设备
MultiMode NanoscopⅢa原子力显微镜(配有Si3N4探针,微悬臂224μm,弹性系数20~70N/m) 美国Digital Instrument公司;LC-6A 高压液相色谱仪(配有RI-10A示差折光检测器、7725i手动进样器、 CTO-10AS柱温箱、CBM-20A在线控制器和LC-solution 分析软件) 日本岛津公司;TSK-Gel SW3000和TSK-Gel SW4000色谱柱 日本Tosoh公司;UV-2800紫外-可见光分光光度计 尤尼卡上海仪器有限公司;HJ-6A六联恒温磁力搅拌器 江苏金坛宏华仪器厂;ESJ120-4型号电子天平沈阳龙腾电子有限公司;LGJ-18型冷冻干燥机 北京四环科学仪器厂;9101型高速样品粉粹机 北京检测仪器有限公司;DL-5低速冷冻大容量离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 银合欢种子多糖的提取
银合欢种子热水浸泡12h,研磨,手工剥离胚乳,丙酮脱水(2h),真空干燥后粉粹。胚乳粉按料液比1:30 (m/V)分散于70℃热水中(4h),5000r/min离心10min,取上清液用Sevag法除蛋白。将提取液与 Sevag试剂(氯仿:正丁醇体积比4:1)按体积比5:1 混合,振荡,离心弃去变性蛋白,重复4次。合并水层,用95%的乙醇沉淀(体积比3:1),5000r/min离心10min,沉淀物溶于热水中,搅拌状态下慢慢加入斐林试剂,析出铜络合物,静置1h,倾出上清液,用水洗涤3 次,离心分离得络合物,向络合物中加4℃ 蒸馏水,再滴加0.5mol/L 的HCl 使之全部溶解,用95%的乙醇沉淀(体积比3:1),离心,所得絮状物分别用乙醇、丙酮、乙醚洗涤,冷冻干燥得洁白银合欢种子多糖粉。并计算提取过程中银合欢种子中胚乳含量、胚乳中多糖含量和种子多糖得率[12]。
1.3.2 银合欢种子多糖的纯度鉴定
1.3.2.1 紫外光谱的测定
将银合欢种子多糖用纯水分散后配制成质量浓度为500μg/mL的溶液,用紫外-可见光分光光度计扫描,观察波长260nm和280nm的吸收.
1.3.2.2 HPLC-GPC分析
精确称取银合欢种子多糖10mg于25mL烧杯中,纯净水溶解,0.45μm水性微孔滤膜过滤后定容至10mL,进行HPLC-GPC分析。色谱条件:色谱柱TSK-Gel SW3000与SW 4000串联,RI-10A 示差折光检测器,流动相:H2O;流速:0.6mL/min;柱温:25℃;进样体积:2 5μL。
1.3.3 AFM 样品制备及观察
称取一定少量银合欢种子多糖样品用蒸馏水溶解于烧杯中,在70℃条件下恒温搅拌2h,配制质量浓度为0.1μg/mL与1μg/mL的稀释液,冷却,备用。
制备方法一:在新鲜解离的云母片表面上滴2mmol/L NiCl210μL,保持1~2min 后水洗,干燥,使云母表面带正电;在处理过的云母表面,分别滴加5μg/mL和1μg/mL多糖溶液10μL,保持10min后用大量水冲水洗,干燥,备用。
制备方法二: 在1μg/mL与0.1μg/mL的稀释液中加入一滴吐温-80,搅拌30min,使其分散,冷却,按“方法一”制样。
AFM 观察:轻敲模式(Tapping Mode) 下对样品进行AFM扫描观察。
2 结果与分析
2.1 银合欢种子多糖得率
经实验测定,种子中胚乳含量为9%,胚乳中多糖含量为55.7%,种子中多糖得率为5%。
2.2 银合欢种子多糖的纯度
银合欢种子多糖溶液的紫外光谱在260nm和280nm波长处未见蛋白质和核酸的特征吸收。银合欢种子多糖的HPLC-GPC色谱图见图1,只出现一个峰,保留时间为4.867min,所检测到的峰没有裂峰的出现,说明分离和纯化的银合欢种子多糖是由一种多糖组成的,面积归一化计算纯度为99.5%。

图1 银合欢种子多糖的HPLC-GPC色谱图Fig. 1 HPLC profile of polysaccharides extracted from Leucaena glaucal seeds
2.3 银合欢种子多糖的聚集态形貌及单分子形貌
2.3.1 云母表面形成的凝胶膜和颗粒状形貌

图2 质量浓度为5μg/mL(a)和1μg/mL(b)银合欢种子多糖的扫描图象Fig.2 Scanned images of Leucaena glaucal seed polysaccharides at 5 μg/mL (a) and 1μg/mL (b)
第一种方式采用5μg/mL和1μg/mL溶液制备样品,在空气中进行 AFM成像。由图2可知,随着溶液质量浓度的降低,云母片表面银合欢多糖形貌由膜状变成颗粒状,颗粒的直径从20~200nm,表明溶液有较大的黏性,并且室温条件下分子呈聚集状态。
2.3.2 单分子形貌
2.3.1 节实验结果表明,获得单分子图像的溶液浓度仍旧较大,且分子分散较难。糖链的密度依赖于多糖初始质量浓度以及其沉积在云母片上的量;为此用第二种制样方式并改用质量浓度为1μg/mL与0.1μg/mL的多糖溶液制样。由图3a、b可知,加入表面活性剂吐温-80,分子的聚集明显降低,在低质量浓度时(0.1μg/mL)溶液呈现网状结构,并得到了单个分子的形貌图[13]。

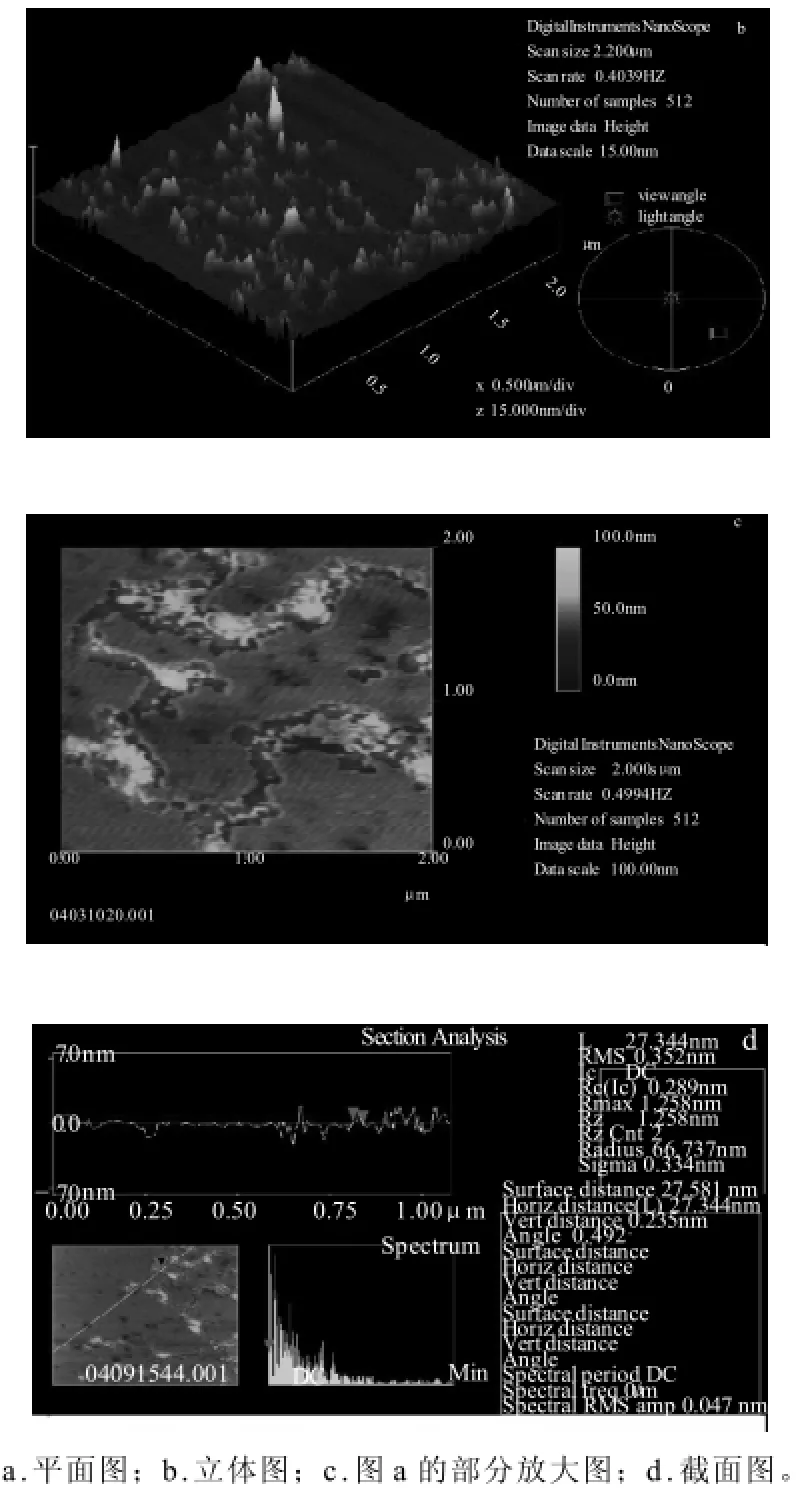
图3 质量浓度为0.1μg/mL银合欢种子多糖的扫描图象Fig.3 Scanned images of Leucaena glaucal seed polysaccharides at 0.1 μg/mL
图3 a~c可知,质量浓度较低时,可观察到银合欢种子多糖分子的单分子形貌。单糖分子为链状,但链状分子并非直线形,而是发生螺旋、折叠、卷绕、分支。单个的多糖分子链中存在侧枝,多个分子链间互相缠绕,链间通过糖单元间不同的连接方式而形成网格状或长链状,其中有大大小小的网格,大小尺寸在10~100nm 范围内,这可能与多糖大分子具有高度分支的化学结构和单分子链的末端受到云母片的摩擦力以及多糖链内三维结构的相互作用力有关。 图3b为三维结构图,表明银合欢种子多糖在溶液中由于聚集而高度不同,在8~15nm之间,银合欢种子多糖表面形貌为凹凸不平,由许多高底不等、似山峰形状的突起结构组成,排列成不规则的突起结构。直接证实了多糖大分子具有高度分枝的化学结构。
图3d是图3a的一个截面线性分析图,由图象和数据表明,银合欢种子多糖分子单链的厚度为0.235nm(一般多糖单分子的高度范围约为 0.1~1nm)[14-15],因分子的高度不受“增宽效应”的影响,高度测量值为分子直径大小的真实值[12]。宽度为27.581nm,长度从几十纳米到几个微米不等。分子的高度和宽度因测量位置的不同稍有差异。宽度测量值与针尖曲率半径有很大关系,实验中所用探针针尖的曲率半径大约为15nm,非常接近单分子多糖链的宽度(约为10nm),当探针针尖扫描多糖分子时,其针尖的不同区域与多糖分子的相互作用力导致了图象的加宽,使分子的宽度(27.581nm) 远大于其真实值[16-17]。“加宽效应”可以通过使用超级“尖锐”探针针尖得以减小[18]。
3 讨 论
利用原子力显微镜可视化了因制备条件不同的银合欢半乳甘露聚糖表现不同的流变学特性在云母表面形成的不同形貌。不同质量浓度下及添加表面活性剂可得到多糖溶液的聚集态和单分子形貌;银合欢多糖分子呈线性螺旋状具有短的分枝,分子直径为28nm左右。
Kirky等[15]研究表面多糖分子间存在螺旋(有序)螺圈(无序)间的逆热转换,且螺旋结构在低温和高离子强度下稳定。多糖链多股分支紧密排列,相互交联,这种现象可能是由于多糖中分子间范德瓦尔斯力相互作用以及糖链间氢键缔合所致[17],也有可能是分子内的相互作用开始缔合成多股分子的胶束,其临近胶束多糖分子链上羟基间的紧密接触有利于分子间形成氢键,相互作用下形成分子胶态网状结构。多糖颗粒状聚集体结构有可能是多糖分子相互借助氢键和范德瓦尔斯力连接在一起,形成以聚集体为单位的颗粒状布局。在半乳甘露聚糖分子结构中半乳糖和甘露糖的相对比值对溶液的流变学性质有很大的影响,相同条件下半乳糖成分高的溶液黏度相对较大,也是银合欢多糖稀溶液仍有较大黏度的主要原因。
[1]蒋建新, 张卫明, 朱莉伟, 等. 半乳甘露聚糖植物胶的研究进展[J].中国野生植物资源, 2001, 20(4): 1-5.
[2]王秀艳, 董丽松. 原子力显微镜在多糖结构研究中的进展[J]. 高分子通报, 2004(1): 50-56.
[3]杨世平, 孙润广, 陈国梁, 等. 红枣多糖微结构的原子力显微镜观测[J]. 陕西师范大学学报: 自然科学版, 2005, 33(3): 59-61.
[4]聂明, 伟琼, 彭王君, 等. 钝顶螺旋藻表面微观形貌的原子力显微镜研究[J]. 生物技术, 2005, 15(6): 69-62.
[5]李斌. 原子力显微镜在多糖研究中的应用进展[J]. 食品科学, 2005, 26(4): 264-269.
[6]蔡林涛, 李萍, 陆祖宏. 原子力显微镜观察虫草多糖分子的结构形貌[J]. 电子显微学报, 1999, 18(1): 103-105.
[7]莫其逢, 黄创高, 田建民, 等. 原子力显微镜与表面形貌观察[J]. 广西物理, 2007, 28(2): 46-49.
[8]孙润广, 张静. 甘草多糖螺旋结构的原子力显微镜研究[J]. 化学学报, 2006, 64(24): 2467-2472.
[9]MCINTIRE T M, PENNER R M, BRANT D A. Observation of a circular, triple 2 helical polysaccharide using noncontact atomic force microscopy [J]. Macromolecules, 1995, 28: 6375-6377.
[10]徐平平, 孙润广, 张静, 等. 女贞子多糖结构的原子力显微镜研究[J].电子显微学报, 2009, 28(12): 157-161.
[11]秦利鸿, 曹建波, 易伟松, 等. 绿茶多糖的扫描电镜制样新方法及原子力显微镜观察[J]. 电子显微学报, 2009, 28(12): 162-167.
[12]郭守军, 杨永利, 黄云珠, 等. 银合欢种子胶的主要性能指标及流变性研究[J]. 食品科技, 2009, 34(5): 254-259.
[13]李国有, 杨永利, 陈勇, 等. 不同方式制备长角豆半乳甘露聚糖样品的原子力显微镜观察[J]. 高分子材料科学与工程, 2006, 22(1): 199-202.
[14]FENG Tao, GU Zhengbiao, JIN Zhengyu, et al. Isolation and characterization of an acidic polysaccharide from Mesona blumes gum[J]. Carbohydrate Polymers, 2008, 71:159-169.
[15]KIRKY A R, GUNNING A P, MORRIS V J, et al. Observation of the helical structure of the bacterial polysaccharide acetan by atomic force microscopy[J]. Biophys J, 1995, 68(1): 360-363.
[16]ABU-LAI N I. An atomic force microscopy look at the molecular world of living bacteria[M]//CAMESANO T, MELLOW C. Microbial surfaces: structure, interactions, and reactivity. Washington, DC: American Chemical Society Publications, 2007.
[17]柳红, 张静. 南瓜AP1 多糖结构的分析和原子力显微镜研究[J]. 食品科学, 2009, 30(5): 55-59.
[18]HANSMA H G, VESENKA J, SIEGERIST C, et al. Reproducible imaging and dissection of plasmid DNA under liquid with the atomic force microscopy[J]. Science, 1992, 256: 1180-1184.
Microstructural Observation of Leucaena glaucal Seed Polysaccharides under Atomic Force Microscope
YANG Yong-li1, GUO Shou-jun1, YE Wen-bin2,PAN Xian-hui2,LIN Yue-juan3,LIN Hai-xiong1
(1. Department of Biology, Hanshan Normal University, Chaozhou 521021, China;2. College of Life Science, Northwest Normal University, Lanzhou 730070, China;3. Analysis and Testing Center, Shantou University, Shantou 515063, China)
Objective: The microstructure of Leucaena glaucal seed polysaccharides was studied based on morphological observation under atomic force microscope (AFM). Methods: Polysaccharides from were extracted by hot water extraction. The structure and morphology of aggregates and non-aggregates from Leucaena glaucal seed polysaccharides formed through varying polysaccharide concentration or chemically modifying the surface of mica substrates were visualized under AFM. Results: Membranous, granular aggregates structure and non-aggregate structure of a single polysaccharide molecule could be observed in the samples prepared at various conditions. Conclusion: A single Leucaena glaucal seeds polysaccharide molecule was linear spiral, and had short branch structure and entangled molecular chains to form a reticulation structure.
atomic force microscope; Leucaena glaucal seed polysaccharide; microstructure
TS207.3
A
1002-6630(2012)15-0099-04
2011-06-23
广东省自然科学基金资助项目(06028879);韩山师范学院教授基金资助项目(510076)
杨永利(1965—),女,教授,硕士,研究方向为植物资源学及功能食品研究及开发。
E-mail: rose_kally@yahoo.com.cn
