大豆分离蛋白-麦芽糊精聚合物的结构特征
2012-06-01程建军
孙 鹏,程建军
大豆分离蛋白-麦芽糊精聚合物的结构特征
孙 鹏,程建军*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
以大豆分离蛋白(SPI)和麦芽糊精(MD)为原料制备不同接枝度的SPI-MD聚合物,通过巯基含量测定、SDSPAGE凝胶电泳、差式量热扫描、傅里叶红外光谱、电子扫描显微镜和圆二色谱分析SPI和不同接枝度(10%、20%、30%、40%)SPI-MD聚合物结构特征的变化。结果表明:随着接枝度的提高,SPI-MD聚合物的巯基含量逐渐降低、变性温度先提高后降低、α-螺旋和β-转角的结构含量减少以及β-折叠和无规则卷曲结构含量增多;并且证明了SPI和MD是以共价键的结合方式聚合及SPI中7S与MD反应活性较高;SPI-MD聚合物的微观结构松散,呈多孔状。
大豆分离蛋白;麦芽糊精;聚合物;结构特征
大豆具有蛋白质含量高、氨基酸组成理想以及大豆蛋白的功能性有助于食品体系形成等特点而成为人类重要的食物资源[1-3];但是随着人们生活水平的不断提高,大豆蛋白在食品工业中应用范围的不断扩大,其在实际应用上也表现出了许多缺陷。所以,对大豆蛋白的改性也逐渐成为现在人们研究的热点问题。大豆蛋白-糖接枝聚合改性,为化学改性范畴,是目前大豆蛋白改性中较为理想的方法,它主要是基于蛋白质分子中氨基酸侧链的自由氨基和糖分子还原末端的羧基之间的羰氨反应,又属于美拉德反应[4]。
蛋白质的肽链由氨基酸单体随机组成,结构非常复杂;蛋白质的肽链是长链分子,在处于伸展状态时,具有较高的能态,只有降低分子的内能,才会使分子处于相对稳定的状态;因而,蛋白质的肽链会自发地通过许多和α-碳原子或肽平面键间的单键旋转,同时伴随着分子内大量的原子和基团间的相互作用来降低内能,折叠成为一个空间内较为稳定的立体结构。蛋白质的结构层次可划分为一、二、三、四级结构[5-7]。当大豆蛋白分子上引入麦芽糊精后,大豆蛋白分子的结构发生变化,其功能性也会改变[8-9]。大豆分离蛋白-麦芽糊精(SPI-MD)聚合物是较为复杂的高分子化合物,目前关于其结构的研究报道极少。本实验主要探讨SPI-MD接枝聚合反应后,不同接枝度的SPI-MD聚合物在结构特征方面的变化。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(粗蛋白含量90.3%,水分含量5.3%) 黑龙江哈尔滨高新科技;麦芽糊精(DE=15~20,水分≤6%)长春帝豪食品科学发展有限公司。
5,5,-二巯基二硝基苯甲酸(DTNB) 美国Amresco公司;硫酸钾、硫酸铜、氢氧化钠 天津市光复精细化工研究所;溴化钾、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、尿素 美国Sigma公司;除溴化钾为色谱纯外,其余试剂均为分析纯。
1.2 仪器与设备
TU-1800紫外-可见分光光度计 北京普析通用仪器有限责任公司;THZ-80水浴恒温振荡器 江苏金坛亿通电子有限公司;FD-5型冷冻干燥机 德国Dold Sim公司;PE Pyris-6差示扫描量热仪 美国PE公司;BGPower-600i迷你型电泳仪 北京百晶公司;S-3400N电子扫描显微镜 日本Hitachi公司; J-810圆二色谱仪 日本Jasco公司;VERTEX-70傅里叶红外色谱仪 德国Bruker公司。
1.3 方法
1.3.1 SPI的制备
参考Xin Gu[10]、Guan Junjun[11]等的方法。称取一定量的SPI,溶于超纯水中,在30℃条件下磁力搅拌2h,2000×g离心30min后所得上清液经滤纸过滤后于4℃冰箱保存备用,GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法测定SPI的质量浓度。
1.3.2 SPI-MD接枝聚合物的制备
按文献[8]的方法,制备接枝度为10%、20%、30%、40%的 SPI-MD接枝聚合物,具体反应条件见表1。

表1 不同接枝度的反应条件Table 1 Reaction conditions for different grafting degrees
1.3.3 巯基(—SH)含量的测定
参考Xin Gu[10]、Tang Chuanhe[12]等的方法。自由巯基的测定,以超纯水溶解样品,质量浓度5mg/mL。600μL样品溶液与4mL的缓冲液T(0.086mol/L Tris-0.09mol/L甘氨酸-4mmol/L Na2EDTA,pH8.0)和400μL 20mmol/L DTNB混合。样品与4mL缓冲液T混合不加DTNB做空白。总巯基的测定,建议改为:缓冲液T以缓冲液U (T-6mol/L尿素-0.5% SDS)替代,其他同上。样品与4mL缓冲液U混合不加DTNB做空白。溶液经漩涡后在室温条件下静置15min,用紫外-可见分光光度计于波长412nm处测其吸光度(A412nm),巯基含量计算如下式所示。

式中:ρ为样品蛋白质质量浓度/(g/100mL)。
1.3.4 差示扫描量热(DSC)分析
依据Tang Chuanhe等[13]的方法。利用PE Pyris 6-DSC热力分析仪测定蛋白质样品的热力学特性。称取2mg的样品放入铝盒中,再向其中加入0.01mol/L的磷酸缓冲溶液10μL (pH7.0),压盖密封,室温(25℃)条件下平衡6h;将平衡好的样品铝盒放入到DPS操作台左侧,空白铝盒放置在右侧;测试温度以10℃/min从30℃到180℃,在180℃保持1min,随后以30℃/min从180℃降温至30℃。记录此过程中蛋白质的变性峰值温度(t)和热焓变(ΔH)。
1.3.5 傅里叶红外光谱(FTIR)分析
参考管军军[14]、王斌[15]等的方法。样品采用卤化物压片法进行测定,将2mg样品与200mg的溴化钾粉在红外灯下的玛瑙研钵中充分混合磨细,使平均粒径约2μm,将样品移至模具内,放在压片机上加压,形成一透明小圆片,即可进行测试。红外光谱仪操作条件为:分辨率4cm-1,全波段扫描范围4000~500cm-1。
1.3.6 SDS-PAGE凝胶电泳分析
参考Laemmli[16]的方法。具体方法如下,选取12%分离胶和5%浓缩胶进行电泳。电泳前样品沸水浴处理5min,吸取样品10μL上样,选取Marker范围为14.4~97.4kD。起始电压70V,待样品进入分离胶,调整电压为120V。染色剂为2.5g/L考马斯亮蓝R-250的V甲醇:V水:V冰乙酸=23:23:4的混合溶液,脱色剂为V甲醇:V水: V冰乙酸=9:9:2混合溶液。
1.3.7 电子扫描显微镜(SEM)分析
样品进行粘台处理,放入离子溅射镀射仪中经15min的减压过程后,对样品离子溅射镀膜约10min,然后将样品移至扫描电镜中观察并拍照。
1.3.8 圆二色谱(CD)分析
参考Gorinstein等[17]的方法。称取一定量已纯化的样品及SPI,用重蒸水溶解,使蛋白质质量浓度为0.2mg/mL,在圆二色谱仪上测定。测定条件:光径0.1cm,温度26℃,灵敏度20mdeg,扫描速率100nm/min,扫描范围190~250nm。
1.4 数据统计方法
对于SPI与MD在某一条件上进行研究时,反应的其他条件均相同。所有实验均进行平行实验,而且重复3次;样品的测定均重复3次,结果取平均值。
实验数据采用Origin8.0绘图软件、SPSS V13.0分析软件、Microsoft Excel分析、OMNIC红外分析软件、CD Pro分析软件等进行试验方案设计、数据分析处理和图表制作。
2 结果与分析
2.1 SPI-MD聚合物的—SH含量分析

图1 SPI-MD聚合物的巯基含量Fig. 1 Sulphydryl group content of SPI and SPI-MD polymers
由图1可知,当总巯基恒定时,热变性导致蛋白质结构伸展,使得游离巯基的含量有一定数量的增加。另一方面,糖和蛋白质经过热处理后,如果有二硫键的形成,游离巯基和总巯基的含量都将会降低[10,18-19]。结果表明,随着接枝度的增加,总巯基含量维持不变,游离巯基含量逐渐下降;总巯基含量的不变说明在大豆分离蛋白和麦芽糊精反应期间并没有二硫键的生成,因此游离巯基与总巯基的含量百分比呈现出了蛋白质的三级结构的伸展程度[10,20]。随着接枝度的提高,巯基含量比却逐渐下降(78.23%~62.24%),这可能是麦芽糊精的存在阻碍了蛋白质结构的伸展。
2.2 SPI-MD聚合物热力学性质(DSC)的分析

图2 SPI-MD聚合物热力学变化图谱Fig. 2 Thermodynamic pattern of SPI-MD polymers
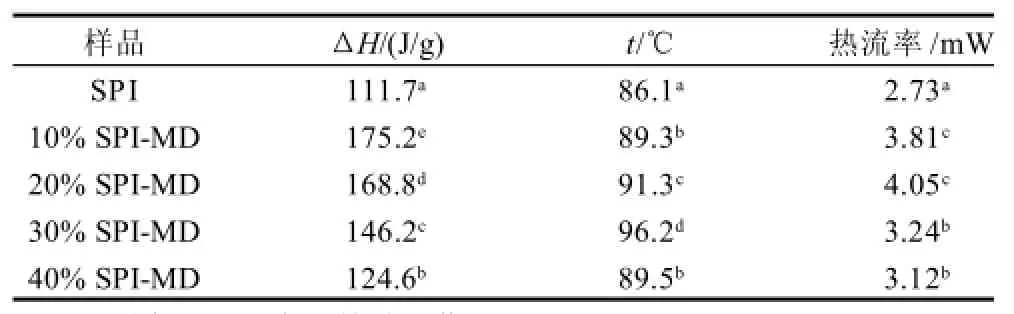
表2 SPI-MD聚合物热力学综合分析Table 2 Comprehensive thermodynamics analysis of SPI-MD polymers
蛋白质的热力学分析就是通过测量蛋白质在连续升温中破坏其高级结构所需的变性温度和能量的变化情况。SPI样品及不同接枝度的聚合物变性温度的测定结果如图2和表2所示,SPI 样品及接枝度为10%、20%、30%、40%的 SPI-MD的变性峰值温度分别为 86.1、89.3、91.3、96.2、89.5℃,它们的变性温度相差较大,这说明它们在结构与组成上有一定差异。一般情况下,蛋白质的变性温度会因自身交联或由于分子内暴露在外面的活性基团形成了少量聚集体而提高[21]。30%接枝度的SPI-MD的DSC图谱峰型很宽,峰值很高,推测可能是蛋白质中的氢键严重被破坏,所得蛋白质中含有很少的稳定结构,α-螺旋也较低,和圆二色谱分析结果相符。Ma等[22]认为蛋白质变性的热焓值与其二级结构的有序性存在着一定的相关性;Nagano等[23]认为宽峰反映了蛋白质改性后内部结构差异,蛋白分子的氢键被严重破坏,使蛋白分子的构象变为解旋的状态,直接导致蛋白分子内α-螺旋含量的减少。
2.3 SPI-MD聚合物傅里叶红外光谱(FTIR)的分析

图3 SPI-MD聚合物的红外光谱Fig.3 FTIR pattern of SPI-MD polymers
蛋白质与糖共价结合以后,一个典型的特征之一是蛋白质分子中羟基数目增加。在FTIR图谱上的具体体现是在1260~1000cm-1范围内出现吸收峰及在3700~3200cm-1范围内出现一宽峰[24]。由图3可知,不同接枝度聚合物在1260~1000cm-1处有很强的吸收峰,且30%接枝度在此处有最强的吸收;在3700~3200cm-1处吸收变化不明显,但均略高于SPI;由此可推测,SPI以共价键的结合形式引入了MD分子;使SPI的FTIR图谱上1700~1500cm-1处很强的吸收峰在不同接枝度聚合物上却明显减弱[25-26];此外,1900~1600cm-1是双键伸缩振动频率区,C=C双键一般会出现在1680~1610cm-1范围内,因此MD分子的介入及反应条件的影响可能使SPI分子内的C=C双键数量发生了变化[15,24]。
2.4 SPI-MD聚合物微观结构(SEM)的分析

图4 SPI-MD聚合物SEM微观结构图谱Fig.4 SEM pattern of SPI-MD polymers
由图4可知,SPI的颗粒表面特征与SPI-MD聚合物明显不同,前者表面光滑、结构紧实,后者结构松散,质地疏松,部分呈多孔状,尤其是接枝度为30%的SPI-MD聚合物,其表面结构和其他样品有较大区别;这可能是糖的共价引入,使聚合物分子向外扩散,一定程度上抑制了分子的聚集所引起的[14,27]。
2.5 SPI-MD聚合物SDS-PAGE凝胶电泳的分析
由图5可知,与SPI样品的电泳谱带相比,随着接枝度的增加,聚合物样品中7S亚基和11S亚基组分的谱带颜色变浅,而且谱带位置略有迁移;这表明SPI中7S亚基和11S亚基均与MD发生了接枝反应,使其含量降低。但却未在其他位置出现新的电泳谱带,这是因为考马斯亮蓝通常在酸性条件下与蛋白质分子上的游离氨基、巯基等活性基团通过静电等非共价作用结合,呈现出颜色反应;当SPI-MD进行接枝反应时,SPI的游离氨基被麦芽糊精占用而减少,考马斯亮蓝与蛋白质分子的结合机率降低,从而使高接枝度聚合物的电泳凝胶图谱经考马斯亮蓝染色时不显色;这也侧面证明了SPI与MD的反应是以共价键结合[14,27-28]。
此外还发现,随着接枝度的增加,与11S亚基各组分的电泳谱带相比,7S亚基的电泳谱带颜色变化更明显,到接枝度为40%时几乎消失(第6泳道)。这表明SPI中7S亚基和麦芽糊精的接枝聚合反应活性比11S酸性亚基和11S碱性亚基要高[29-30]。

图5 SPI-MD聚合物SDS-PAGE电泳图谱Fig. 5 SDS-PAGE electrophoresis pattern of SPI-MD polymers
2.6 SPI-MD聚合物圆二色谱(CD)的分析

表3 SPI和SPI-MD的二级结构含量Table 3 Secondary structure contents of SPI and SPI-MD polymers %
圆二色谱是一种特殊的在波长250nm以下的远紫外吸收光谱,由蛋白质的光活性基团肽键的电子跃迁所引起,主要生色团是肽链[31];蛋白质的圆二色性是当平面圆偏振光通过这些光活性的生色基团时,光活性中心对平面圆偏振光中的左、右圆偏振光的吸收不相同,产生吸收差值,由于这种吸收差的存在,造成了偏振光矢量的振幅差,圆偏振光变成了椭圆偏振光[32]。不同的蛋白质所产生圆二色谱谱带上的摩尔椭圆度(θ)不同,因此,通过测定蛋白质的远紫外圆二色谱,能反映出蛋白质二级结构的信息[33]。
蛋白质的二级结构主要有β-折叠、无规则卷曲、α-螺旋及β-转角4种。由表3可知,与SPI样品相比,SPI-MD聚合物的α-螺旋和β-转角的结构含量减少,分别为23.9%、22.2%、21.1%%、21.6和3.2%、3.7%、3.9%、4.5%;β-折叠和无规则卷曲结构含量增多,分别为45.4%、49.7%、50.5%、51.3%和27.5%、24.4%、24.5%、22.6%;这可能是由于麦芽糊精分子的引入,SPI分子充分伸展,其空间结构发生了变化,由有序变为相对无序[14];另一个可促使大豆分离蛋白发生构象转变的因素是热处理,王文高等[34]热诱导蛋白质,观察构象变化过程,结果发现在65℃时SPI中的β-伴球蛋白开始变性,至75℃变性基本完全,生成的β-折叠结构含量不再增加。
3 结 论
通过对不同接枝度的SPI-MD聚合物结构特征的研究,结果如下:随着接枝度的提高,SPI-MD聚合物巯基含量逐渐下降;SDS-PAGE凝胶电泳表明麦芽糊精和7S亚基的反应活性较高;差示量热扫描发现随着接枝度的增加,SPI-MD聚合物的变性温度先提高后降低;傅里叶红外光谱证明了SPI和MD是以共价键的结合方式接枝聚合;电子扫描显微镜的观察看出SPI-MD聚合物呈多孔状,结构松散;圆二色谱分析得出,与SPI样品相比,SPI-MD聚合物的α-螺旋和β-转角的结构含量减少,β-折叠和无规则卷曲结构含量增多,分子结构变的相对无序。
[1]SATHE S K. Dry bean protein functionality[J]. Critical Reviews in Biotechnology, 2002, 22: 175-223.
[2]YUAN Y J, VELEV O D, CHEN K, et al. Effect of pH and Ca2+-induced associations of soybean proteins[J]. J Agric Food Chem, 2002, 50: 4953-4958.
[3]夏其昌, 曾嵘. 蛋白质化学与蛋白质组学[M]. 北京: 科学出版社, 2004. [4]夏彦斌. 食品化学[M]. 北京: 中国农业出版社, 2004.
[5]谢笔钧. 食品化学[M]. 北京: 科学出版社, 2006.
[6]赵威祺. 大豆蛋白质的构造和功能特性(中)[J]. 粮食与食品工业, 2004 (2): 3-6.
[7]王镜岩. 生物化学[M]. 北京: 高等教育出版社, 2002.
[8]孙鹏, 程建军, 刘钊. 大豆分离蛋白-麦芽糊精接枝聚合度的工艺优化[J]. 食品发酵与工业, 2011, 37(11): 99-104.
[9]孙鹏, 程建军, 郑洊溪, 等. 干燥方式对不同接枝度的大豆分离蛋白-麦芽糊精聚合物性质影响[J]. 食品工业科技, 2012, 33(11): 157-160.
[10]XIN Gu, LYDIA J, CAMPBEL L, et al. Influence of sugars on the characteristics of glucono-δ-lactone-induced soy protein isolate gels [J]. Food Hydrocolloids, 2009, 23: 314-326.
[11]GUAN Junjun, QIU Aiyong, LIU Xiaoya, et al. Microwave improvement of soy protein isolate-saccharide graft reactions[J]. Food Chemistry, 2006, 97: 577-585.
[12]TANG Chuanhe. Thermal denaturation and gelation of vicilin-rich protein isolates from three phaseolus legumes: a comparative study[J]. LWT-Food Science and Technology, 2008, 41: 1380-1388.
[13]TANG Chuanhe, CHOI S M, MA C Y. Study of thermal properties and heat-induced denaturation and aggregation of soy proteins by modulated differential scanning calorimetry[J]. International Journal of Biological Macromolecules, 2007, 40: 96-104.
[14]管军军. 微波合成大豆蛋白-糖接枝物机理、结构及功能性[D]. 无锡: 江南大学, 2005.
[15]王斌, 王靖, 余江, 等. FT-Raman光谱对蛋白质二级结构的定量分析[J]. 光谱学与光谱分析, 1999(5): 674-676.
[16]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[17]GORINSTEIN S, DELGADO-LICON E, PAWELZIK E, et al. Characterization of soluble amaranth and soybean proteins based on fluorescence, hydrophobicity, electrophoresis, amino acid analysis, circular dichroism, and differential scanning calorimetry measurements[J]. J Agric Food Chem, 2001, 49: 5595-5601.
[18]GAN C Y, CHENG L H, EASA A M. Physicochemical properties and microstructures of soy protein isolate gels produced using combined cross-linking treatments of microbial transglutaminase and Maillard crosslinking[J]. Food Research International, 2008, 41: 600-605.
[19]CHOVEA B E, GRANDISON A S, LEWIS M J. Some functional properties of fractionated soy protein isolates obtained by microfiltration [J]. Food Hydrocolloids, 2007, 21: 1379-1388.
[20]PETRUCCELLI S, ANON M C. Relationship between the method of obtention and the structural and functional properties of soy protein isolates[J]. Food Chem, 1994, 42(10): 2170-2176.
[21]GERMAN B, DAMODARAN S, KINSELLA J E. Thermal dissociation and association behaviour of soy proteins[J]. Journal of Food Science, 1982, 30: 807-811.
[22]MA C Y, HARWALLKAR V R. Thermal analysis of food proteins[J]. Adv Food Nutr Res, 1991, 35: 317-366.
[23]NAGANO T, MORI H, NISHINARI K. Effect of heating and cooling on the gelation kinetics of 7S globulin from soybeans[J]. J Agric Food Chem, 1994, 42: 1415-1419.
[24]赵瑶兴, 孙祥玉. 有机分子结构光谱鉴定[M]. 北京: 科学出版社, 2003. [25]谢孟峡, 刘媛. 红外光谱酰胺带用于蛋白质二级结构的测定研究[J].高等学校化学学报, 2003(2): 226-231.
[26]吴黎明, 周群, 周骁, 等. 蜂王浆不同贮存条件下蛋白质二级结构的Fourier变换红外光谱研究[J]. 光谱学与光谱分析, 2009(1): 82-87.
[27]胡坤, 曾丽, 余思敏. 大豆分离蛋白与麦芽糊精的Maillard反应性及产物乳化性质研究[J]. 食品与发酵工业, 2007, 33(7): 22-28.
[28]UTSUMI S, MATSAMURA Y, MORI T. Structure-function relationships of soy proteins[M]//DAMODARAN S, PARAT A. Food proteins and their applications. New York: Marcel Dekker, 1997: 257-291.
[29]YAMAGISHI T, MIYAKAWA A, NODA N, et. al. Isolation and electrophoretic analysis of heat-induced products of mixes soybean 7S and 11S globulins[J]. Agricultural Biology Chemistry, 1983, 47: 1229-1237.
[30]YOWELL K, FLURKEY W H. Effect of freezing and microwave heating on proteins from codfish fillets: Analysis by SDS polyacrylamide gel electrophoresis[J]. Journal of Food Science, 1986, 51(2): 508-509.
[31]吴明和. 圆二色光谱在蛋白质结构研究中的应用[J]. 氨基酸和生物资源, 2010(4): 77-80.
[32]于海英, 程秀民, 王晓坤. 圆二色光谱及其在药物研究方面的应用[J]. 光谱实验室, 2007(5): 877-884.
[33]沈星灿, 梁宏, 何锡文, 等. 圆二色分析蛋白质构象的方法及研究进展[J]. 分析化学评述与进展, 2004(3): 388-394.
[34]王文高, 陈正行, 姚惠源. 大米蛋白及其水解物功能性质与疏水性关系的研究[J]. 粮食与饲料工业, 2002(7): 49-50.
Structural Characterization of Soybean Protein Isolate-Maltodextrin Polymers
SUN Peng,CHENG Jian-jun*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
The sulphydryl group contents of soy protein isolate (SPI) and its polymer complexes with maltodextrin (MD) at different degrees of grafting (10%, 20%, 30% and 40%) were determined. At the same time, SPI and four polymer complexes were analyzed by sodium dodecylsulfate polyacrylamide gel electrophoresis (SDS-PAGE), differential scanning calorimeter, Fourier transform infrared spectroscopy, scanning electron microscope and circular dichroism. The results showed that SPI-MD polymers revealed a gradual decrease in sulphydryl group content, an initial increase and then a decrease in denaturation temperature, a reduction in α-helical and β-turn and an increase in β-sheet and random coil structure with increasing grafting level. SPI molecules could be grafted with MD molecules by covalent bonds between 7S in SPI molecules and MD. The structure of SPI-MD was porous and loose.
soyprotein isolate;maltodextrin;polymer;structural characterization
TS214.2
A
1002-6630(2012)15-0166-05
2012-04-11
孙鹏(1986—),男,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:geye815@126.com
*通信作者:程建军(1969—),男,副教授,博士,研究方向为农产品加工。E-mail:cheng577@163.com
