无机盐对木瓜蛋白酶凝固大豆分离蛋白凝胶的影响
2012-06-01笪久香李莹莹栾广忠崔亚丽胡亚云李志成
笪久香,李莹莹,栾广忠,2,*,崔亚丽,胡亚云,李志成,2
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西省农产品加工工程技术研究中心,陕西 杨凌 712100)
无机盐对木瓜蛋白酶凝固大豆分离蛋白凝胶的影响
笪久香1,李莹莹1,栾广忠1,2,*,崔亚丽1,胡亚云1,李志成1,2
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西省农产品加工工程技术研究中心,陕西 杨凌 712100)
为研究食品中常见无机盐对木瓜蛋白酶凝固大豆分离蛋白凝胶的影响,以大豆分离蛋白(SPI)为原料,测定添加NaCl、KCl、CaCl2、MgCl2和MgSO4等常见无机盐后木瓜蛋白酶凝固SPI的时间、凝胶质构、凝固过程中pH值及蛋白质降解程度的变化。结果表明:添加一定浓度的无机盐可以缩短凝固时间并提高凝胶强度。相同离子强度下,Ca2+和Mg2+对凝固时间及凝胶强度影响均大于Na+和K+。添加无机盐可使SPI的pH值降低,加酶后pH值再次持续下降,但一定时间后趋于稳定。无机盐的种类和浓度对木瓜蛋白酶凝固SPI过程中蛋白质降解程度影响不明显。SPI中CaCl2的离子强度为15(CaCl2浓度为5mmol/L)时,将酶添加量从0.15%减少到0.1%,可使凝胶强度提高60%。因此,添加适量的一价及二价无机盐可显著缩短酶凝固时间并提高凝胶强度。添加Ca2+和Mg2+等二价阳离子盐类是提高木瓜蛋白酶凝固大豆蛋白凝胶强度的有效途径。
无机盐;木瓜蛋白酶;大豆分离蛋白;凝胶
大豆分离蛋白(soybean protein isolate,SPI)是将豆粉除去油脂和水溶性非蛋白成分后,得到的一种蛋白质含量(N×6.25)不低于90%的混合物[1]。SPI的蛋白质消化率修正氨基酸评分(PDCAAS)达到0.99[2],是完全蛋白质,具有很高的营养价值。SPI具有溶解性、乳化性、起泡性和胶凝性等特性[3],其中胶凝性是大豆蛋白重要的功能特性之一。目前制备大豆蛋白凝胶的方法主要有:加热处理[4]、无机盐和葡萄糖酸内酯(GDL)处理[5]、高压处理[6]、酶凝固法[7-8]等。酶法凝固大豆蛋白条件温和、凝固物细腻,不但保持了其营养价值,还可以改善其功能特性[9]。但与酸类凝固剂和盐类凝固剂相比,酶凝固法凝胶强度低,限制了其进一步应用[10]。目前发现能够凝固大豆蛋白的酶均为蛋白酶,如微生物蛋白酶、植物蛋白酶等[11]。其中,木瓜蛋白酶来源于植物,凝固活性较高[11],在食品和医药中应用也很广泛[12]。
无机盐对球蛋白的胶凝性具有很大的影响,如Ca2+、Mg2+通过静电屏蔽及盐桥作用可增强大豆蛋白的凝胶强度[5,13]。本实验以SPI为原料,以木瓜蛋白酶为凝固剂,研究常见无机盐NaCl、KCl、CaCl2、MgCl2和MgSO4对木瓜蛋白酶凝固SPI的凝固时间、质构、pH值和蛋白质降解等特性的影响,进而寻找可能提高酶法凝固大豆蛋白凝胶强度的有效方法,为其进一步应用打下基础。
1 材料与方法
1.1 材料与试剂
SPI(素宝-760 IP,蛋白质含量90%(干基)) 上海舒莱公司。
木瓜蛋白酶(木瓜乳冻干而得,EC3.4.22.2,酶活力3500U/mg) 美国Sigma公司;氯化钠、氯化钾、氯化钙、氯化镁、硫酸镁(均为分析纯) 上海国药集团化学试剂有限公司。
1.2 仪器与设备
HH-S6型水浴锅 北京科伟有限公司;TA.XT2质构仪 英国Stable Micro System公司;PHSJ-4A pH计 上海精科有限公司;Mini PROTEIN 3 Cell垂直板电泳设备美国Bio-Rad公司;Universal Hood Ⅱ全自动凝胶成像体系 意大利Bio-Rad公司。
1.3 方法
1.3.1 SPI分散液的制备
将SPI粉末分散于去离子水中,质量浓度为4g/100mL,搅拌5min,经沸水浴热处理15min后,立即在冰水混合物中冷却至4℃,备用。
1.3.2 木瓜蛋白酶凝固SPI凝固时间的测定
参照Arima等[14]的方法,取5mL预处理的SPI溶液于25mL试管中,加入一定量的无机盐溶液,在40℃水浴保温30min,加入体积分数0.15%的5g/100mL酶液并开始计时(精确到秒),迅速涡旋混匀后继续保温,观察SPI的状态,管壁开始出现凝固颗粒时,即判断SPI凝固,所用的时间为凝固时间。以未添加无机盐的SPI溶液为对照。
1.3.3 离子强度的计算
按照下式[15]计算离子强度(ionic strength,IS)。

式中:c为溶液中各离子的浓度/(mmol/L);k为该离子的价数。
实验中,SPI中NaCl、KCl离子强度与物质的量浓度数值相同;CaCl2、MgCl2离子强度分别为6、15、30、40所对应的分别为2、5、10、40/3mmol/L;MgSO4离子强度分别为6、15、30、40所对应的物质的分别为1.5、3.75、7.5、10mmol/L。无机盐配制成2.0mol/L的溶液,计算添加至SPI溶液中所需的无机盐的体积。
1.3.4 凝胶质构的测定
取50mL预处理的SPI溶液置于100mL烧杯中,之后操作按1.3.2节,凝固后30min取出置于冰水浴中冷却至4℃,并于该温度下保存过夜。
测定前30min取出SPI凝胶恢复至室温,参照质构仪自带的反向挤压(back extrusion)程序进行测定。所得质构曲线中,χ轴上方曲线的最大峰所对应的力表示硬度F/g ,代表凝胶的强度;χ轴下方的曲线最大峰所对应的力与χ轴形成的面积表示凝胶的黏性指数(index of viscosity,IV)/(g·s),代表凝胶的黏附性。
测定参数为:探头:A/BE(直径35mm);测试深度:20mm;触发应力:0.5g;测试前速率:1mm/s;测试速率:1mm/s;测试后速率:10mm/s。
1.3.5 木瓜蛋白酶凝固SPI过程中pH值变化的测定
取50mL预处理后的SPI溶液,40℃水浴保温30min,添加不同离子强度的无机盐后,继续保温30min,测定SPI在添加不同离子强度无机盐前后的pH值变化。再加入体积分数0.15%的5g/100mL木瓜蛋白酶液,每隔一定时间测定pH值。
1.3.6 SDS-PAGE
参照Laemmli[16]的方法,于不同离子强度的酶凝胶中分别在凝固之前、凝固中、凝固后取样,迅速的将样品置于沸水浴中20min,使酶失活。采用不连续SDSPAGE:4.5%浓缩胶、10%分离胶,加样量10μL,考马斯亮蓝R-250染色。
1.4 统计分析
2 结果与分析
2.1 无机盐对木瓜蛋白酶凝固SPI凝固时间的影响
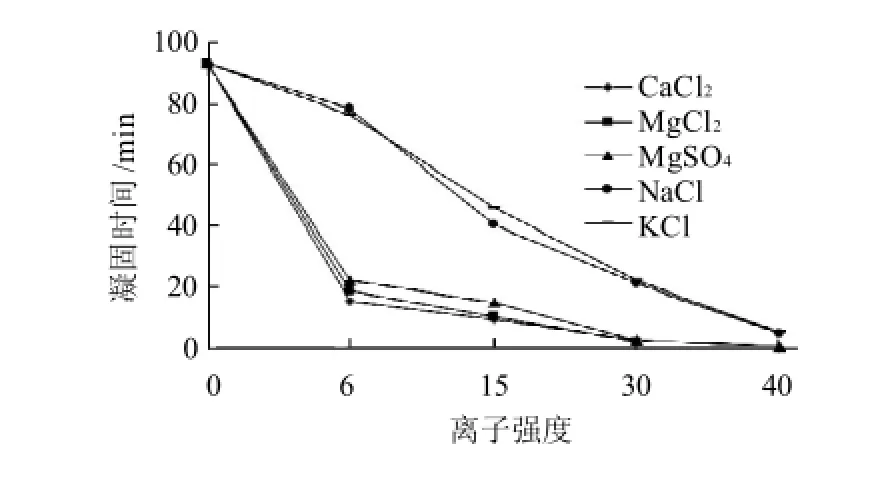
图1 不同离子强度的无机盐对木瓜蛋白酶凝固大豆蛋白凝固时间的影响Fig.1 Effect of salt ion strength on coagulation time of SPI gel
由图1可知,随着离子强度的增加,一价及二价盐离子均使凝固时间缩短。其中CaCl2影响最大,当离子强度为30时凝固时间为2.5min,而对照SPI(即离子强度为0时)为93min。MgCl2、MgSO4对凝固时间的影响与CaCl2相似,相同离子强度下三者对凝固时间的影响无显著差异(P>0.05)。NaCl离子强度为40时,凝固时间缩短为5min。KCl对凝固时间的影响与NaCl相似,二者差异也不显著(P>0.05)。在相同离子强度下,Na+和K+对凝固时间的影响极显著小于Ca2+和Mg2+(P<0.01),其原因可能是一价盐离子有静电屏蔽作用[5],二价盐离子除此作用外,还会与大豆蛋白质间形成“盐桥”[17]。
2.2 无机盐对木瓜蛋白酶凝固SPI凝胶质构的影响
由表1可知,对于一价盐离子,NaCl离子强度在0~15范围内,凝胶的F变化不大,IV先降低后增加;当离子强度增加至30时,凝胶的F和IV均显著增加(P<0.05);当离子强度进一步增加至40时,凝胶的F有所降低,IV有所增加,但差异均不显著(P>0.05)。KCl对凝胶的F和IV的影响与NaCl相似。对于二价盐离子,CaCl2、MgCl2离子强度分别在0~30、0~15范围内,凝胶的F和IV随离子强度的增加而增加,相对于对照SPI均差异显著(P<0.05);MgCl2的离子强度增加至30时,凝胶的F和IV均显著下降(P<0.05);二者的离子强度继续增加至40时,SPI形成颗粒状沉淀,乳清大量析出。MgSO4离子强度从0增加至30,凝胶的F和IV均显著增加(P<0.05);当离子强度进一步增加至40时,凝胶的F和IV反而显著降低(P<0.05)。相比于对照,Ca2+对凝胶F和IV最大,其次是Mg2+、Na+和K+影响较小。
一价离子本身不能凝固大豆蛋白,离子强度增加时,可能通过静电屏蔽作用使蛋白质之间的斥力减弱[5],从而提高了凝胶的F和IV。当离子强度进一步增加时,无机盐的电荷使蛋白质的电荷完全屏蔽后,凝胶的F和IV均趋于稳定,表现为差异不显著。
一定离子强度范围内,二价离子除了静电屏蔽作用外,还会与蛋白质的极性基团作用形成钙桥[17],从而提高了凝胶的F和IV;当离子强度过大时,过多的二价阳离子会占据凝胶的阴离子位点,从而阻止了相邻多肽链间的共价交联,削弱了凝胶结构[18-19],因此凝胶F和IV均降低。

表1 不同离子强度的无机盐对凝胶硬度和黏性指数的影响Table 1 Effect of salt ion strength on firmness and viscosity index of SPI gel
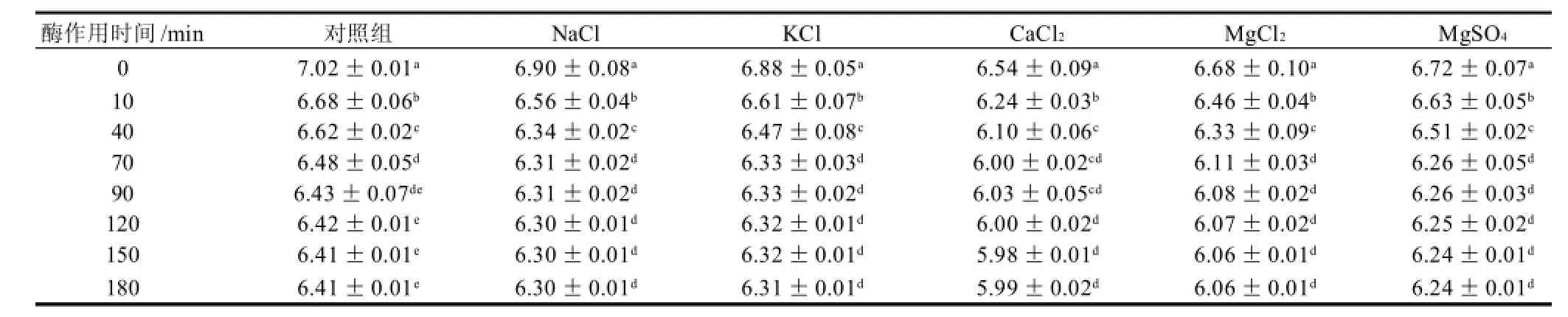
表2 不同无机盐对酶凝固SPI过程中pH值变化的影响Table 2 Effect of salt ion strength on pH of SPI gel
2.3 无机盐对木瓜蛋白酶凝固SPI过程中pH值变化的影响
由表2可知,添加一定量的无机盐均使SPI溶液的pH值有不同程度的降低。对照组的pH值为7.02,加入NaCl或KCl后pH值降到6.90左右,加入CaCl2后pH值降到6.54,而加入MgCl2或MgSO4后pH值降到6.70左右。其原因可能是无机盐离子与肽链氨基酸末端羟基竞争,使SPI溶液释放了更多的H+,二价阳离子与肽链末端羧基的结合较一价阳离子更加紧密[20],释放的H+多,因此其降低pH值的程度比一价无机盐大,这也可能是二价盐离子缩短凝固时间比一价盐离子程度大的原因。
蛋白质酶解过程会造成pH值下降,降解程度与pH值降低程度正相关[21-22]。加酶凝固后,凝胶的pH值在一定时间后(如加酶150~180min后)趋于稳定,说明蛋白质的降解程度趋于稳定。其他离子强度的无机盐变化趋势与其相似,数据未列出。
综上所述,凝固过程中pH值的降低是无机盐及肽链水解的综合作用结果,这对凝固时间的缩短及凝胶强度的提高都是有利的。
2.4 无机盐对木瓜蛋白酶凝固SPI过程中蛋白质降解的影响
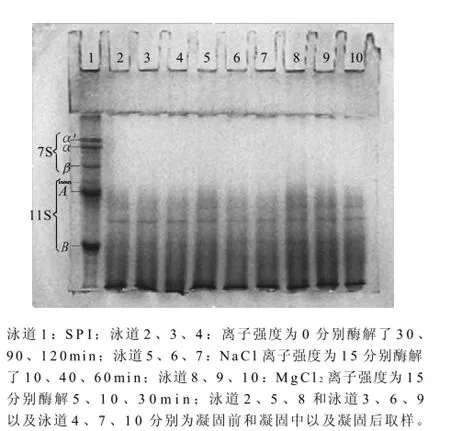
图2 无机盐对木瓜蛋白酶凝固SPI过程中蛋白质降解情况的影响Fig.2 Effect of salt ion strength on protein degradation of SPI gel
由图2可知,从电泳的条带可以看出,无论是否添加无机盐,加入木瓜蛋白酶后,SPI均迅速降解,而且降解程度非常相近。说明在实验条件下,添加无机盐对SPI的降解没有明显影响。其他离子强度的无机盐对木瓜蛋白酶凝固SPI过程中蛋白质的降解情况相似,数据未列于实验中。
2.5 木瓜蛋白酶的添加量对凝胶质构的影响
如2.2节所述,CaCl2对凝胶的F和IV影响最大,以CaCl2离子强度等于15为例,不同加酶量对凝固时间、F和IV的影响见表3。其他离子强度的无机盐,不同加酶量对凝胶影响与其相似,数据未列出。

表3 木瓜蛋白酶的添加量对酶凝胶硬度和黏性指数的影响Table 3 Effect of papain amount on firmness and viscosity index of SPI gel
由表3可知,木瓜蛋白酶的添加量为0.025%时,由于酶用量过低,不能使SPI凝固形成凝胶。木瓜蛋白酶添加量为0.05%和0.1%时,凝固时间分别为57min和15.5min,凝胶强度较高;当加酶量为0.15%和0.2%时凝固时间很短,为7.8min和5.1min,F相对于低添加量时显著降低(P<0.05),同时对IV没有显著差异(P>0.05)。因此通过添加CaCl2和调整木瓜蛋白酶的添加量可以提高凝胶强度,与对照组SPI凝胶23.3g(表1)相比,提高了约60%。
原因可能是:1)加酶量影响凝固时间,凝固速率影响凝胶的强度,凝固速率越快,凝胶的结构越粗糙,凝胶强度越低[5,23];2)加酶量影响蛋白的降解情况,加酶量越多,大豆蛋白的肽链被降解成小分子的速率越快,显然,这对凝胶强度的提高是不利的。
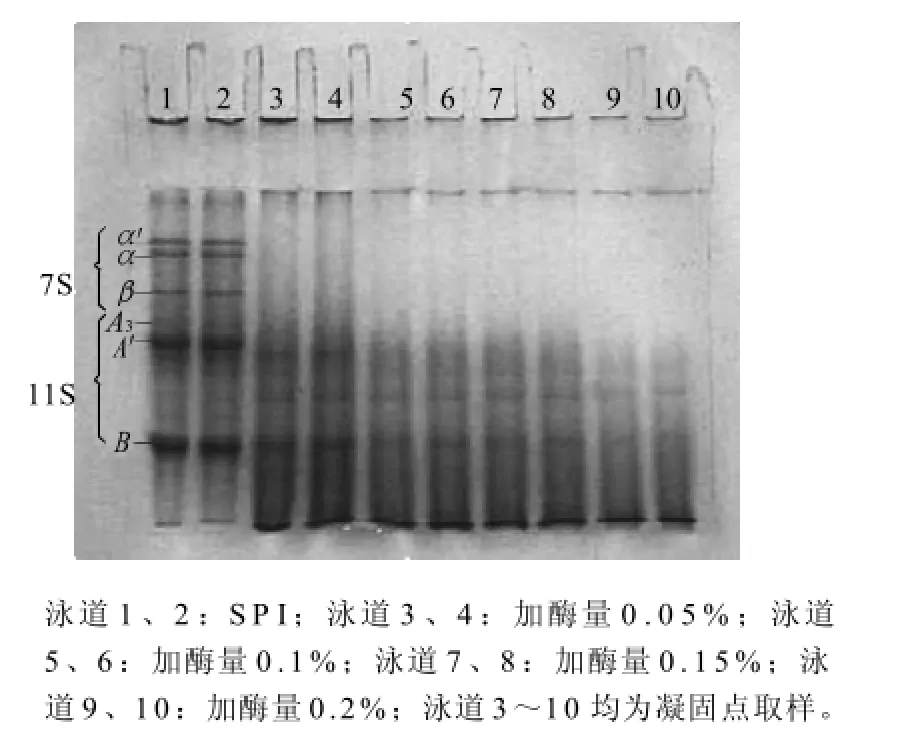
图3 木瓜蛋白酶添加量对SPI凝固过程中蛋白质降解情况的影响Fig.3 Effect of papain amount on protein degradation of SPI gel
由图3可知,低酶活性(添加量为0.05%,泳道3和4)时,木瓜蛋白酶对11S球蛋白的降解速度较慢,溶液中存在浓度较高的11S。有研究[24-25]表明,11S比例高的SPI凝胶的强度明显高于11S比例低的凝胶。这也可能是低酶活性下凝胶强度较高的原因之一。
3 结 论
添加适量的无机盐可以缩短木瓜蛋白酶凝固SPI的时间,提高凝胶强度。同一离子强度下,相对于一价盐离子而言,二价盐离子能更有效地缩短木瓜蛋白酶凝固SPI的时间,提高凝胶强度。通过添加无机盐和调整木瓜蛋白酶的用量可以显著提高木瓜蛋白酶凝固SPI的凝胶强度。
[1]KINSELLA J E. Functional properties of soy proteins[J]. Journal of the American Oil Chemistry Society, 1979, 56(3): 242-258.
[2]刘志皋. 食品营养学[M]. 2版. 北京: 中国轻工业出版社, 2005: 42.
[3]KINSELLA J E. Functional properties of proteins in foods: a survey[J]. Critical Review in Food Science and Nutrition, 1976, 7(3): 219-280.
[4]SAIO K, WATANABE T, KAJI M. Food use of soybean 7S and 11S proteins extraction and functional properties of their fraction[J]. Food Science Technology, 1973, 38(7): 1139-1144.
[5]刘志胜. 豆腐凝胶的研究[D]. 北京: 中国农业大学, 2001.
[6]SPERONI F, BEAUMAL V, LAMBALLERIE M, et al. Gelation of soybean proteins induced by sequential high-pressure and thermal treatments[J]. Food Hydrocolloids, 2009, 23(5): 1433-1442.
[7]栾广忠. 碱性蛋白酶Alcalase凝固豆浆机理的研究[D]. 北京: 中国农业大学, 2005.
[8]钟芳, 王璋, 许时婴. 凝固剂种类对大豆蛋白质组分7S和11S胶凝能力的影响[J]. 食品与生物技术学报, 2003, 22(3): 12-17.
[9]LAMSAL B P, JUNG S, JOHNSON L A. Rheological properties of soy protein hydrolysates obtained from limited enzymatic hydrolysis[J]. Food Science and Technology, 2007, 40(7): 1215-1223.
[10]栾广忠, 程永强, 鲁战会, 等. 豆乳凝固酶的研究进展[J]. 农产品加工: 学刊, 2006, 79(10): 41-43.
[11]钟芳, 王璋, 许时婴. 大豆蛋白质的酶促速凝[J]. 无锡轻工大学学报, 2002, 21(6): 559-563; 573.
[12]熊华. 木瓜蛋白酶的应用研究进展[J]. 四川食品与发酵, 2005, 41(4): 9-11.
[13]NAGANO T, TOKITA M. Viscoelastic properties and microstructures of 11S globulin and soybean protein isolate gels: magnesium chlorideinduced gels[J]. Food Hydrocolloids, 2011, 25(7): 1647-1654.
[14]ARIMA K, YU Y, IWASAKI S. Milk-clotting enzyme from microorganisms[J]. Agricultural and Biological Chemistry, 1967, 31 (5): 540-542.
[15]徐春霞. 无机及分析化学[M]. 北京: 科学出版社, 2010: 267.
[16]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[17]PUPPO M C, AN~ON M C. Structural properties of heat-induced soy protein gels as affected by ionic strength and pH[J]. Journal of Agricultural and Food Chemistry, 1998, 46(9): 3583-3589.
[18]TANG Juming, LELIEVR J, TUNG M A, et al. Polymer and ion concentration effects on gellan gel strength and strain[J]. Journal of Food Science, 1994, 59(1): 216-220.
[19]LAU M H, TANG J, PAULSON A T. Texture profile and turbidity of gellan/gelation mixed gels[J]. Food Research International, 2000, 33(8): 665-671.
[20]CHANDRASEKARAN R, MILLANE, R P, ARNOTT S, et al. The crystal structure of gellan[J]. Carbohydrate Research, 1988, 175(1): 1-15.
[21]NISSEN J A. Enzymatic hydrolysis of food protein[M]. London: Elsevier Applied Science Publishers Ltd., 1986: 38-42.
[22]ZHONG Fang, WANG Zhang, XU Shiying, et al. The evaluation of proteases as coagulants for soy protein dispersions[J]. Food Chemistry, 2007, 100(4): 1371-1376.
[23]陈莉, 钟芳, 王璋. 凝固剂及凝固条件对大豆蛋白胶凝性质的影响[J]. 中国乳品工业, 2004, 32(9): 23-27.
[24]TANG Chuanhe, WU Hui, CHEN Zhong, et al. Formation and properties of glycinin-rich and β-conglycinin-rich soy protein isolate gels induced by microbial transglutaminase[J]. Food Research International, 2006, 39(1): 87-97.
[25]RENKMA J M S, KNABBEN J H M, van VLIET T. Gel formation by β-conglycinin and glycinin and their mixtures[J]. Food Hydrocolloids, 2001, 15(4): 1407-1414.
Effect of Inorganic Salts on Papain-Induced Coagulation of Soybean Protein Isolate
DA Jiu-xiang1,LI Ying-ying1,LUAN Guang-zhong1,2,*,CUI Ya-li1,HU Ya-yun1,LI Zhi-cheng1,2
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China;2. Shaanxi Engineering Center of Agro-product Processing, Yangling 712100, China)
In order to explore the effect of inorganic salts on papain-induced coagulation of soybean protein, the changes of clotting time, texture properties, pH and protein degradation were determined during or after the coagulation of soybean protein isolate (SPI) in the presence of one of five salts including NaCl, KCl, CaCl2, MgCl2and MgSO4. The results showed that the clotting time was shortened and gel strength was increased; the pH of SPI was reduced after the addition of salts. After papain was added, the pH revealed a continuous decrease to a steady level upon a certain time of incubation. Ca2+and Mg2+revealed more effective than Na+and K+on both clotting time and gel strength under the same ionic strength. The gel strength revealed an increase by 60% when the amount of papain was reduced to 0.1% from 0.15% (m/m). Therefore, the presence of salts could shorten clotting time and gel strength, and the addition of calcium or magnesium salts is an effective way to enhance the strength of papain-induced SPI gel.
salts;papain;soybean protein isolate;gel
TS201.7
A
1002-6630(2012)11-0030-05
2011-05-24
联合国大学-麒麟继续研究基金项目
笪久香(1986—),女,硕士研究生,研究方向为大豆蛋白深加工。E-mail:djx08930@163.com
*通信作者:栾广忠(1968—),男,副教授,博士,研究方向为植物蛋白深加工。E-mail:qlgz@nwsuaf.edu.cn
