基于1H-NMR共振技术对涪麦冬与绵麦冬化学成分的比较研究
2012-05-21钱进肖草茂南昌大学第四附属医院南昌330003江西省药物研究所南昌33009
钱进,肖草茂(1.南昌大学第四附属医院,南昌 330003;.江西省药物研究所,南昌 33009)
麦冬为百合科植物,以块根入药,具有养阴清热、润肺止咳的功效[1,2]。现代医学研究表明,麦冬具有强心、利尿、抗菌的作用,临床用于治疗肺燥干咳、津伤口渴、心烦失眠等证。国内、外研究表明,麦冬主要化学成分为甾体皂苷、高异黄酮类、多糖、氨基酸等[3,4]。迄今为止,从麦冬类植物及其变种中共分离鉴定出的甾体皂苷有近50种,高异黄酮有约30种[5]。
四川为麦冬的主产区之一,川产麦冬俗称川麦冬,而涪麦冬与绵麦冬是川麦冬的2个主要品种。涪麦冬来源于麦冬Ophiopogon japonicus(Thunb.)Ker-Gawler的干燥块茎,主产于四川绵阳,其根茎颗粒细小而产量少;绵麦冬为麦冬栽培变种 O.japonicus(Thunb.)Ker-Gawler Cv.Mianyangensis,其产量较大。由于涪麦冬与绵麦冬在产量上相差很大,其市场价格也有较大的差别,导致麦冬的使用比较混乱,经常将绵麦冬当涪麦冬使用。为了考察这2个品种的产品混用是否合理,笔者采用模式识别中的偏最小二乘法-判别分析(PLS-DA)方法,通过对二者核磁共振氢谱(1H-NMR)的比较研究,分析其化学成分差异,为川麦冬药材及其制剂研究提供科学依据。
1 仪器与试药
BS 224S电子天平(北京赛多利斯仪器系统有限公司);SENCOR-201旋转蒸发器(上海予华科技有限公司);W201D恒温水浴锅(上海申顺生物科技有限公司);AVⅡ-600核磁共振仪(德国Bruker公司)。
DMSO-d6(瑞士ARMAR CHEMICALS公司);甲醇为分析纯;Mestrenova软件(上海精博软件公司);SIMCA-P 11.0软件(北京天演融智软件有限公司)。绵麦冬采自四川绵阳三台,涪麦冬采自四川彭州,均经江西省药物研究所朱良辉研究员鉴定为真品。
2 方法与结果
2.1 方法
称取麦冬碎片样品2 g,加入甲醇20mL,50℃水浴温浸提取3次,每次1 h;合并滤液,减压浓缩至无液体,再真空干燥30min。称取0.05 g提取物,用0.05mL DMSO-d6溶解,制得供1H-NMR测定的样品溶液。样品溶液在恒温296 K(1K=-272.15℃)的环境中,以DMSO-d6为溶剂,扫描128次,采样时间域为64 k,采样时间为2.66 s,脉冲间隔为3.00 s,采用标准的预饱和脉冲序列压制水峰信号,利用CPMG脉冲序列抑制大分子信号[6]。
2.2 结果
2.2.1 涪麦冬和绵麦冬的PLS-DA法分析 按“2.1”项下方法测定出来的涪麦冬和绵麦冬FID自由衰减信号,用Mestrnova软件将其转化成1H-NMR图谱,对1H-NMR图谱以0.04 ppm单位进行分段、积分[5],得到每个样本的各化学位移值段与相对应的峰面积积分值所组成的Excel表。将Excel表导入SIMCA-P 11.0软件中,对涪麦冬和绵麦冬进行PLS-DA法分析,结果见图1。
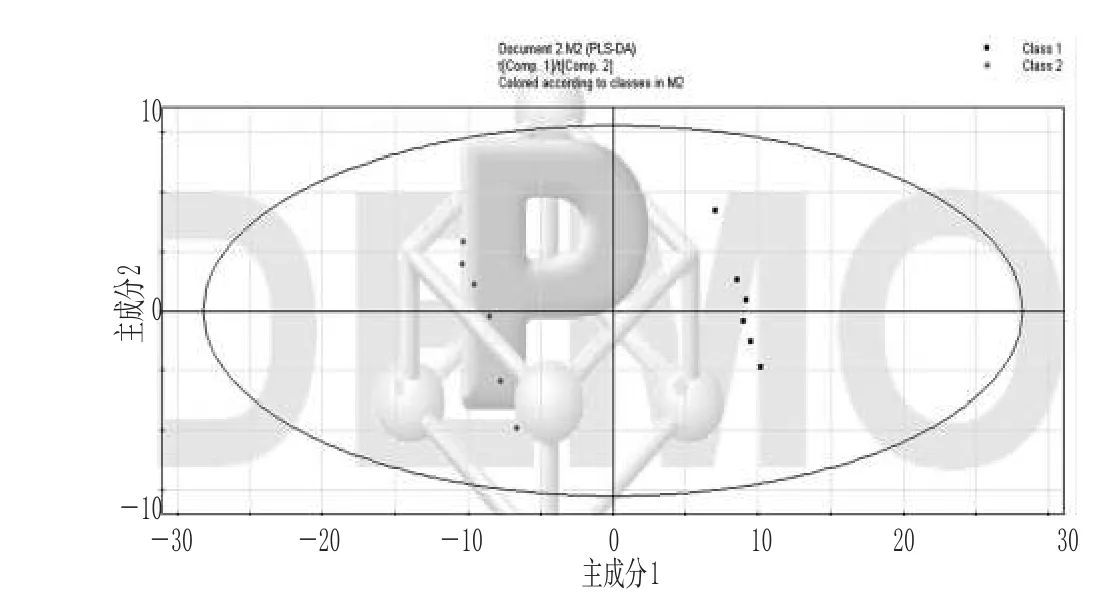
图1 主成分1对主成分2的得分散点图Fig 1 The score scatter diagram of the principal component 1 for the principal component 2
由图1可知,涪麦冬和绵麦冬在化学成分上有显著差异:涪麦冬主要分布在主成分1的正值区域,而绵麦冬主要分布在主成分1的负值区域,说明涪麦冬和绵麦冬化学成分上的差异主要体现在主成分1上。为了进一步弄清涪麦冬和绵麦冬的化学成分在主成分1上的差异,笔者还对其作了主成分1对主成分2的载荷散点图,见图2。

图2 主成分1与主成分2的载荷散点图Fig 2 The loading scatter diagram of the principal component 1 for the principal component 2
载荷散点图是通过载荷图转换后的数据还原在1H-NMR上的图,它反映了化学位移值的变化情况。由图2可知,对正区域的样本(涪麦冬)聚类贡献最大的主要变量在化学位移δ3.80~3.20、δ7.80~7.10、δ9.60~8.80区间内。据文献[7,8]可知,化学位移在δ3.80~3.20区间主要为多糖信号峰以及甾体皂苷糖链部分的信号峰;δ7.80~7.10、δ9.60~8.80区间主要为芳香环上羟基氢或酚羟基信号峰[9,10],故初步推断涪麦冬的主要化学成分是多糖、甾体皂苷和高异黄酮类化合物。影响负区域的样本(绵麦冬)的主要变量在化学位移δ2.80~3.10、δ3.30~3.80、δ6.20~9.20区间内。据文献[11]可知,δ2.80~3.10区间主要为二氢高异黄酮的3、11位的脂肪氢特征信号峰;δ3.30~3.80区间主要为多糖信号峰;δ6.50~9.00区间主要为高异黄酮类化合物的信号峰,其中δ6.20~7.00区间主要为高异黄酮类化合物B-环上的芳香氢特征信号峰。故可初步推断绵麦冬的主要化学成分为高异黄酮类、多糖类及少量甾体皂苷类化合物,其中高异黄酮类化合物中的二氢高异黄酮占很大比例。
由图2可知,正区域样本与负区域样本的载荷点分布差异较大;负区域样本(绵麦冬)在化学位移δ6.20~9.20区间的载荷点相比正区域样本(涪麦冬)更多。根据上述分析,该区域内的信号峰主要为高异黄酮类化合物上的芳香氢或酚羟基信号峰,故可推断出涪麦冬和绵麦冬在化学成分上的主要差异在高异黄酮类化合物上。
2.2.2 涪麦冬和绵麦冬的1H-NMR图谱分析 为了更加清楚地比较涪麦冬和绵麦冬在化学成分上的差异,笔者对涪麦冬和绵麦冬的1H-NMR图谱进行了分析。涪麦冬6个样本的1H-NMR图见图3;绵麦冬6个样本的的1H-NMR见图4。

图3 涪麦冬的1H-NMR图Fig 3 1H-NMR of O.japonicus(Thunb.)Ker-Gawler
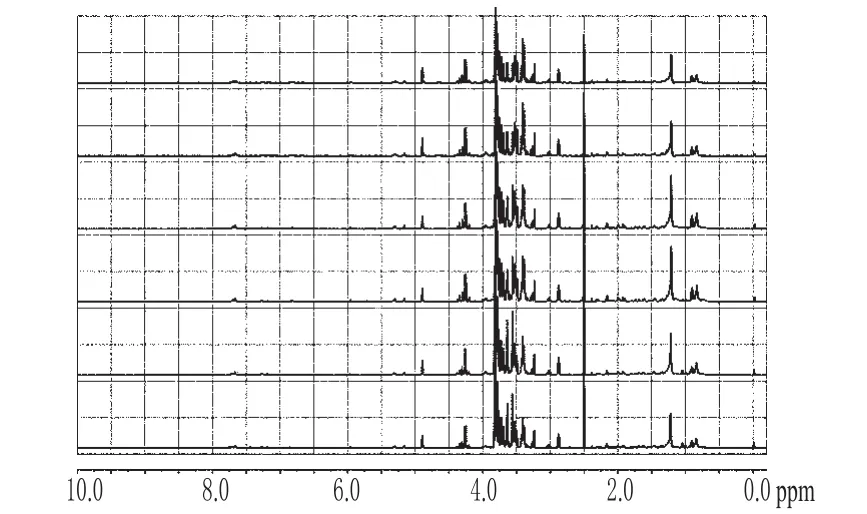
图4 绵麦冬的1H-NMR图Fig 4 1H-NMR of O.japonicus(Thunb.) Ker-Gawler Cv.Mianyangensis
由图3、图4可知,涪麦冬和绵麦冬各自6个样本的1H-NMR图谱基本相同,因此本试验分别选择涪麦冬和绵麦冬其中一个样本的1H-NMR图谱进行比较分析(图5),找出涪麦冬和绵麦冬化学成分上的差异。
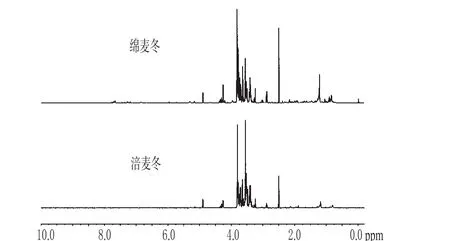
图5 涪麦冬与绵麦冬的1H-NMR图谱比较Fig 5 1H-NMR of O.japonicus(Thunb.)Ker-Gawler and O.japonicus(Thunb.)Ker-Gawler Cv.Mianyangensis
由图5可知,涪麦冬和绵麦冬1H-NMR的信号峰均主要集中在化学位移δ8.30~0.50区间内,二者的1H-NMR从整体上看似相近,表明涪麦冬和绵麦冬的大部分化学成分基本相同。但仔细比较发现,涪麦冬和绵麦冬的1H-NMR也不完全相同,差别主要体现在峰高和化学位移上。涪麦冬和绵麦冬峰高不相同,可能是由于二者化学成分含量的差异所致,也有可能是由于FID信号转换成1H-NMR过程中图谱调整误差所致。
为了找出涪麦冬和绵麦冬峰高差异所造成的原因,笔者在涪麦冬和绵麦冬的1H-NMR图谱上选择一个比较孤立的信号,通过积分比进行分析。对涪麦冬和绵麦冬的1H-NMR图谱反复比较,最终选择化学位移为δ4.89处的信号峰,经计算可知,该峰积分值在涪麦冬1H-NMR中占总积分值的0.8%,而在绵麦冬1H-NMR中占总积分值的1.0%,提示涪麦冬和绵麦冬峰高不相同,主要是由于两者化学成分含量的差异所致。
图5还显示出涪麦冬和绵麦冬的1H-NMR图谱有较多差异之处,主要体现在化学位移δ7.80~6.50、δ6.00~4.20、δ3.85~3.55、δ3.10~2.90等区域内。为了更加直观显示出涪麦冬和绵麦冬1H-NMR图谱上的差异,笔者分别对化学位移δ8.30~7.00、δ7.00~6.00、δ6.00~4.00、δ4.00~2.40和δ2.40~0.50区域进行分段图谱分析,结果分别见图6~图10。

图6 涪麦冬和绵麦冬在δ8.30~7.00区域的谱图Fig 6 1H-NMR of O.japonicus(Thunb.)Ker-Gawler and O.japonicus(Thunb.) Ker-Gawler Cv.Mianyangensis ranged 8.30~7.00
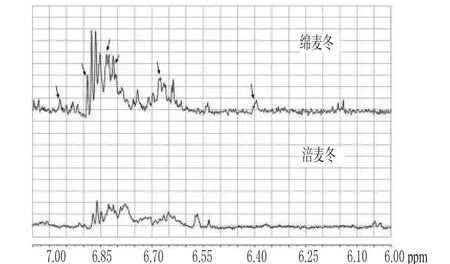
图7 涪麦冬和绵麦冬在δ7.00~6.00区域的图谱Fig 7 1H-NMR of O.japonicus(Thunb.)Ker-Gawler and O.japonicus(Thunb.)Ker-Gawler Cv.Mianyangensi ranged 7.00~6.00
图6显示的是1H-NMR上化学位移δ8.30~7.00区域内的图谱,该区域内主要为高异黄酮类化合物的芳香氢或酚羟基信号峰[9,10]。涪麦冬和绵麦冬的1H-NMR大部分信号峰化学位移值相同,且峰形也基本相近,表明在该区域内涪麦冬和绵麦冬大部分高异黄酮类化合物基本相似。
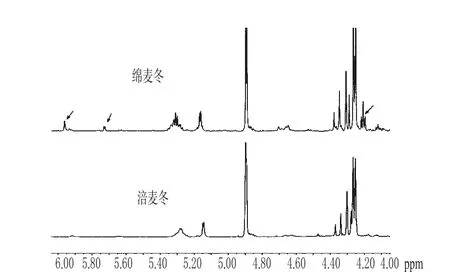
图8 涪麦冬和绵麦冬在δ6.00~4.00区域的图谱Fig 8 1H-NMR of O.japonicus(Thunb.)Ker-Gawler and O.japonicus(Thunb.)Ker-Gawler Cv.Mianyangensis ranged 6.00~4.00

图9 涪麦冬和绵麦冬在δ4.00~2.40区域的图谱Fig 9 1H-NMR of O.japonicus(Thunb.)Ker-Gawler and O.japonicus(Thunb.)Ker-Gawler Cv.Mianyangensis ranged 4.00~2.40

图10 涪麦冬和绵麦冬在δ2.40~0.50区域的图谱Fig 10 1H-NMR of O.japonicus(Thunb.)Ker-Gawler and O.japonicus(Thunb.) Ker-Gawler Cv.Mianyangensis ranged 2.40~0.50
但从图6还可看出,涪麦冬和绵麦冬在化学位移δ8.30~7.00区域内的图谱有明显差异,主要体现为以下两方面:一是涪麦冬和绵麦冬的1H-NMR信号峰峰高不同,二者该区域内所有信号峰积分值分别占全谱的0.23%、0.75%,表明绵麦冬中高异黄酮类化合物的含量比比涪麦冬中的含量比高。二是绵麦冬在化学位移为δ7.46处有个单峰,较涪麦冬相应位置信号峰强,该信号峰为高异黄酮类化合物2位烯氢信号[12];涪麦冬较绵麦冬在化学位移为δ7.83处多一个宽单峰,据文献报道,该信号为一类高异黄酮类化合物2位烯氢信号,该类化合物的B-环结构特点为3′,4′位置的次甲二氧基取代[9,13]。上述结果表明,二者在化学位移δ8.30~7.00区域内的差异主要在于高异黄酮的含量以及某些高异黄酮类化合物的种类上,其中绵麦冬中高异黄酮的含量较涪麦冬高。
图7显示出在化学位移δ7.00~6.00区域内,绵麦冬的信号峰较涪麦冬多,而且峰高较涪麦冬高;绵麦冬在该区域所有信号峰积分值占全谱总积分值的5.4%,而涪麦冬为2.3%。据文献报道,化学位移在δ7.00~6.00区域内的信号峰主要为高异黄酮B-环上的芳香氢信号峰,如4′-OH取代芳香氢特征信号峰在化学位移约为δ6.98、6.68处[12],3′、4′-OH取代芳香氢特征信号峰在化学位移约为δ6.65、6.42、6.57处[9],而3′,4′次甲二氧基取代芳香氢特征信号峰在化学位移约为δ6.76、6.80、6.86处[8]。图7表明,绵麦冬中高异黄酮类化合物种类较涪麦冬多,含量较涪麦冬高。
由图8可知,在化学位移δ6.00~4.00区域内信号峰不多,主要为烯氢、糖端基氢以及少量脂肪氢信号峰;涪麦冬和绵麦冬在化学位移δ4.26~4.40、4.90、5.15等处信号峰基本相同。由文献可知,化学位移为δ4.26~4.40区域为二氢高异黄酮2位脂肪特征氢信号峰[9,11],这表明两者均含有二氢高异黄酮;化学位移在δ4.90与δ5.15处的信号峰主要为糖端基氢信号峰[7]。
由图8还可看出,绵麦冬在化学位移δ6.00~4.00区域内的信号峰比涪麦冬多,尤其是在化学位移为δ5.98、5.72、5.29、4.20处的信号峰比涪麦冬强。由文献可知,化学位移为δ5.98处的信号峰除了可能为阿拉伯糖的端基氢信号峰外,还可能为高异黄酮8位芳香氢信号峰或3′,4′次甲二氧基信号峰。化学位移为δ4.20处的信号峰除了可能为多糖信号峰外,还可能为某些二氢高异黄酮化合物2位脂肪特征氢信号峰[11]。上述结果表明,在化学位移δ6.00~4.00区域涪麦冬和绵麦冬均有二氢高异黄酮成分,该类成分在绵麦冬中有可能比涪麦冬更多。
由图9可知,在化学位移δ4.00~2.40区域内主要为多糖、甾体皂苷糖链以及二氢高异黄酮的特征脂肪氢信号峰[7,11]。涪麦冬和绵麦冬在化学位移δ3.85~3.20区域的信号峰基本相似,该区域主要为多糖信号峰,其中化学位移δ3.80~3.70区域多个单峰为高异黄酮类化合物B-环上的甲氧基信号峰。绵麦冬在这一区域内所有信号峰积分值比涪麦冬低,表明绵麦冬化学成分中多糖含量比涪麦冬低。
由图9还可看出,绵麦冬在化学位移δ2.98~3.08区域存在一个多重峰,该信号较涪麦冬相应位置的信号低。由文献[11]可知,该区域主要为二氢高异黄酮3、11位的特征信号峰,表明涪麦冬和绵麦冬均含有二氢高异黄酮,并进一步表明绵麦冬中的二氢高异黄酮成分比涪麦冬多。
图10显示的是涪麦冬和绵麦冬在化学位移δ2.40~0.50区域的图谱,该区域主要为甾体皂苷信号峰。由图10可知,二者在该区域内信号峰较少、信号较弱,积分值分别为2.2%、2.7%。可推测出涪麦冬和绵麦冬中甾体皂苷含量均相对高异黄酮低。
3 讨论
涪麦冬和绵麦冬为川麦冬的2个主要品种,其1H-NMR图谱大部分相似,表明二者大多数化学成分相近。绵麦冬为麦冬的栽培变种,故其化学成分与涪麦冬会有一定差异,这点可以从PLS-DA散点图(图1)上得到认证。
PLS-DA法是通过采用数学统计的方法来寻找样本间的差异,而1H-NMR分析法则比较直观地找出样本间的差异,2种分析方法可以相互佐证。从PLS-DA载荷图(图2)分析可知,涪麦冬和绵麦冬化学成分上的主要差异在高异黄酮类化合物上,其中绵麦冬的高异黄酮类化合物比涪麦冬多。图6、图7显示出涪麦冬和绵麦冬的1H-NMR图谱有多处差异,这也表明绵麦冬的高异黄酮类化合物种类比涪麦冬多,含量比涪麦冬高。图8则表明绵麦冬中的二氢高异黄酮比涪麦冬更多。PLS-DA法和1H-NMR分析得出的结论基本一致:绵麦冬比涪麦冬在高异黄酮类化合物上,尤其是在二氢高异黄酮上,种类更多,含量更高。可见,绵麦冬不宜代替涪麦冬使用,二者也不宜混用。
[1]国家药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:106.
[2]邓 卅,李卫平,任开环,等.山麦冬总皂苷对局灶性脑缺血损伤的保护及抗凝血作用研究[J].中国药房,2007,18(30):2332.
[3]林 晓,周强峰,徐德生.麦冬药理作用研究进展[J].上海中医药杂志,2004,38(6):59.
[4]余伯阳,殷 霞,张春江.麦冬多糖的免疫活性研究[J].中国药科大学学报,1991,22(5):283.
[5]陈 屏,徐东铭,雷 军.麦冬化学成分及药理作用的研究现状[J].长春中医学院学报,2004,20(1):35.
[6]唐小燕,罗乔奇,马郑红,等.不同产地麦冬1H-NMR模式识别研究[J].中草药,2009,40(5):792.
[7]王建忠,陈小兵,王峰鹏,等.川麦冬皂苷类化学成分的研究[J].有机化学,2008,28(9):1620.
[8]马军守,别继明,金 虹,等.川麦冬及其须根中多糖和黄酮类有效成分定量分析[J].西南科技大学学报,2008,23(1):83.
[9]Akihiro T,Ryoji K,Tamotsu S,et al.Studies on the constituents of Ophiopogonis tuberⅥ.Structures of homoisoflavonoids(2)[J].Chem Pharm Bull,1980,28(7):2039.
[10]程志红,余伯阳.麦冬块根化学成分的研究[J].天然产物研究与开发,2005,17(1):1.
[11]黄晓刚,邹 萍,胡晓斌,等.绵麦冬化学成分的研究[J].华西药学杂志,2006,21(6):529.
[12]朱永新,严克东,凃国士.麦冬中高异黄酮的分离与鉴定[J].药学学报,1987,22(9):679.
[13]Yoshiaki Watanabe,Shuichi Sanada,Yoshiteru Ida,et al.Comparative studies on the constituents of Ophiopogonis tuber and its congeners.Ⅳ.Studies on the homoisoflavonoids of the subterranean part of ophiopogon ohwii okuyama and O.jaburan(Kunth)LODD[J].Chem Pharm Bull,1985,33(5):358.
