加州鲈诺卡菌病病原的分离与鉴定*
2012-05-09蒋依依李言伟周素明李安兴
蒋依依,李言伟,周素明,李安兴
(中山大学水产品安全教育部重点实验室∥生物防治国家重点实验室∥生命科学学院,广东 广州 510275)
加州鲈学名大口黑鲈Micropterussalmoides,隶属鲈形目Perciformes、太阳鱼科Cehtrachidae、黑鲈属Micropterus,是我国引进的重要淡水经济鱼类。目前我国的加州鲈年产量达16万t以上,广东则是加州鲈养殖大省,其中顺德,南海地区的养殖量占全国的75%。近年来顺德,南海等地池塘养殖的加州鲈出现了一种以体表和内脏出现大量白色结节为主要症状的传染性疾病,该病病情持续时间长,死亡率高,严重威胁着加州鲈养殖业的健康发展。本文对患病的加州鲈进行了病原的分离鉴定、16S rDNA分析、动物回归感染试验及药物敏感性等方面的研究,以期为加州鲈诺卡菌病的有效防治提供理论参考,现将结果报告如下。
1 材料和方法
1.1 病鱼症状和组织病理学观察
患病加州鲈采自南海加州鲈养殖场,体长25~35 cm,体质量400~600 g。取濒死病鱼与健康鱼进行体表和内部解剖比较观察,确定该病的典型症状。同时取出现典型症状的肾脏组织用φ=10%中性福尔马林固定,石蜡包埋,切片,HE染色,观察组织病理学变化。
1.2 病原菌分离
以无菌操作从患病鱼的肝、肾、脾、肌肉等病变组织取样,分别划线于血平板和BHI培养基平板上,28 ℃恒温培养5~8 d分离纯化细菌,分离菌株编号为NH090627。
1.3 病原菌形态观察
将分离纯化后的细菌划线转接于BHI培养板上,28 ℃恒温培养5~8 d,观察平板上的菌落形态。同时对分离菌株进行革兰氏染色,油镜下镜检观察。
1.4 生理生化鉴定
按照参考文献[1-2]的相应属、种鉴定的有关内容和方法,用生化鉴定管(购自广州环凯生物科技有限公司)对分离菌株的酶类产生、水解活性、单一碳源生长等生理生化指标进行研究。
1.5 回归感染试验
试验用加州鲈体长15~20 cm,体质量30~45 g。试验前随机取3尾鱼解剖,并取其脑、肝、脾、肾和肌肉等组织涂板确定其有无细菌感染。试验鱼分3组:1个试验组,1个PBS对照组,1个自然组,每组10尾鱼。将分离菌株在BHI液体培养基中培养后稀释成浓度为2.5×107cfu/mL菌悬液,试验组每尾鱼腹腔注射0.2 mL菌液,PBS对照组注射同样剂量的PBS,未处理组不做任何处理。感染后,试验鱼饲养20 d,水温20~25 ℃,随时记录试验鱼的发病症状和死亡情况。
1.6 16S rDNA序列扩增和分析
用Edwards等[3]设计的细菌16S rDNA通用引物(Pf:5’-AGAGTTTGATCC TGGCTCAG-3’ 和Pr:5’-AAGGAGGTGATCCAGCCGCA-3’)扩增分离菌株NH090627的16S rDNA序列,回收PCR产物,TA克隆后挑取阳性克隆测序,测序工作由上海英骏生物技术有限公司完成。
所测得序列在GeneBank数据库中进行BLAST比对,根据返回的结果从GeneBank中调用诺卡菌属其他种的16S rDNA序列,Clustalx软件比对后,用Mega 4.0构建系统进化树。
1.7 药物敏感性试验
取100 μL液体培养的菌液(108cfu/mL)与BHI培养基混匀后倒平板,然后将附有不同抗生素的药敏纸片(购自英国Oxioid公司)均匀贴在平板上。28 ℃培养7 d后测量抑菌圈直径。
2 结 果
2.1 病鱼临床症状和组织病理学观察
患病鱼游动缓慢,反应迟钝,上浮于水面,摄食量减少,每天大量死亡,持续周期长。随病情加重,病鱼体表开始充血发炎,逐渐溃烂,胸腹鳍和尾鳍均有溃烂出血症状,部分病鱼肛门红肿。鳃上粘液增多,部分鱼鳃丝出现小出血点,边缘缺损。解剖观察肌肉和肾脏有明显白色或淡黄色结节(图1),直径1~5 mm,肝脏肿大,部分病鱼肝脏有大量出血点。肾脏组织切片可发现有明显肉芽肿状病变(图2)

图1 患病加州鲈病变组织解剖结构(示肌肉和肾脏白色结节)

图2 患病加州鲈肾脏组织切片(示肾脏肉芽肿状病变,HE×1000)
2.2 病原菌形态观察
病原菌在BHI培养基上生长缓慢,28 ℃需5~10 d才能形成淡黄色沙粒状菌落,粗糙易碎,边缘不整齐,在表面形成皱折。病原菌在血平板上生长稍快,28 ℃需2~5 d,无溶血,菌落形态与BHI平板上的菌落相似(图3)。病原菌革兰氏染色呈阳性,菌体呈紫红色短杆状或分枝状,长2~5 μm(图4)。

图3 病原菌在血平板上的菌落形态

图4 显微镜下的病原菌形态(×1000)
2.3 生理生化特征
如表1所示,病原菌过氧化氢酶阳性,氧化酶阴性,产生脲酶、还原硝酸盐、不水解酪蛋白、黄嘌呤、酪氨酸、淀粉和明胶,水解七叶苷,能以柠檬酸盐为唯一碳源生长,具备了诺卡菌属细菌的基本生理生化特征。
2.4 回归感染试验
加州鲈在腹腔注射诺卡菌5 d时即出现死亡,7 d后体表有发红症状,到第16 d时10尾鱼全部死亡,对照组无任何症状(表2)。
解剖发现病鱼肝脏肿大,变白灰色,未见明显白色结节,但从肝、脾、肾、肌肉组织中均能分离得到纯度一致的细菌,菌落形态、菌体形态及基本生理生化特征与从自然发病鱼体分离的菌株完全一致,说明所分离细菌即为加州鲈传染性结节病的病原菌。
2.5 16S rDNA序列分析
用引物Pf和Pr扩增菌株NH090627的16S rDNA序列,得到1 511 bp序列,利用GeneBank中BLAST与相关序列进行相似性分析。结果表明,该分离株与诺卡菌属的菌株亲缘关系较近,与鰤鱼诺卡菌NocardiaseriolaeJCM3360T的16S rDNA基因序列相似性达99.9%,仅有2个碱基的差异。
诺卡菌系统进化树(图5)显示:菌株NH090627与鰤鱼诺卡菌NocardiaseriolaeJCM3360T聚为一个分支,与其他细菌均相距较远,据此鉴定该菌株为鰤鱼诺卡菌Nocardiaseriolae。
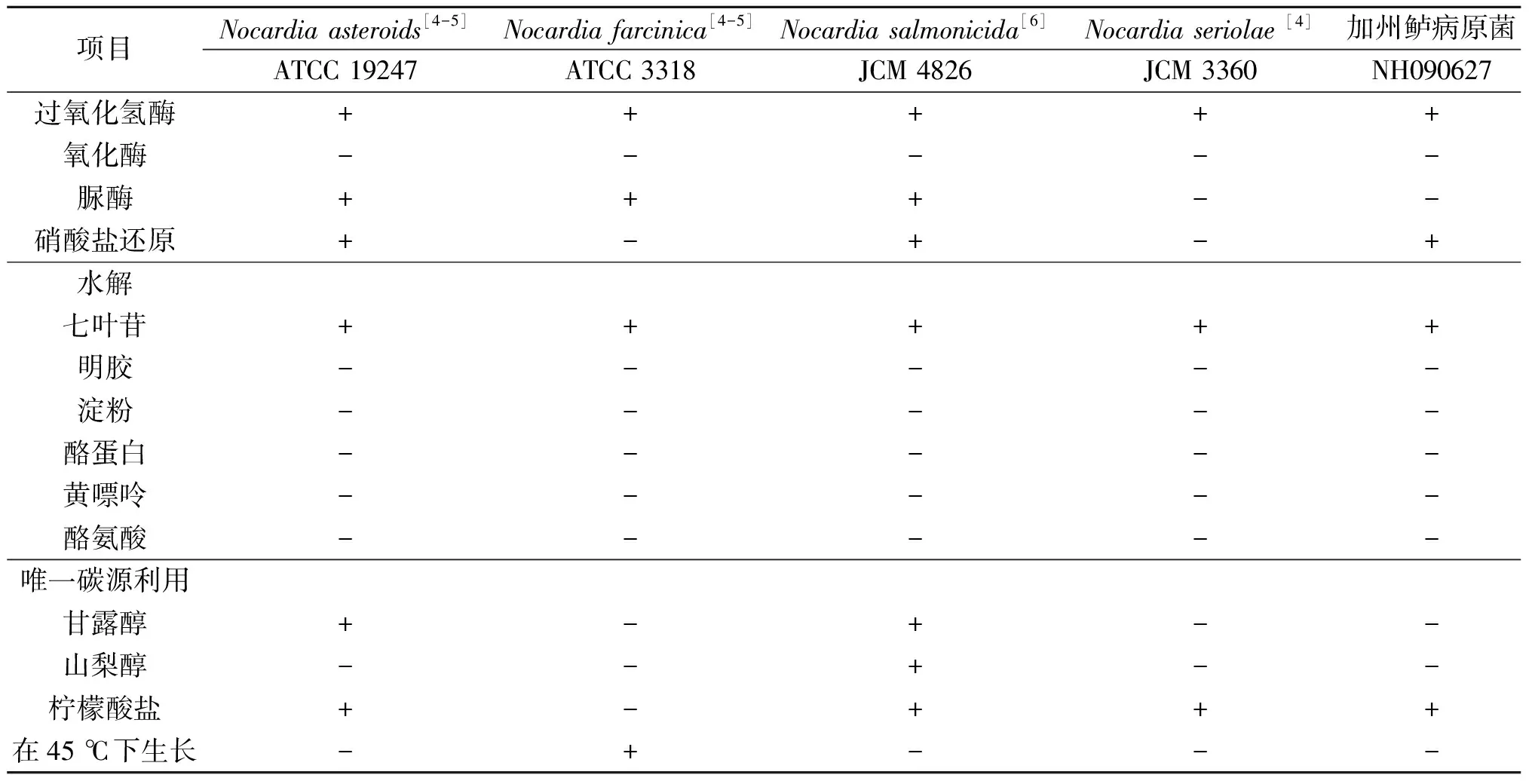
表1 菌株NH090627和参照菌株的生理生化特征
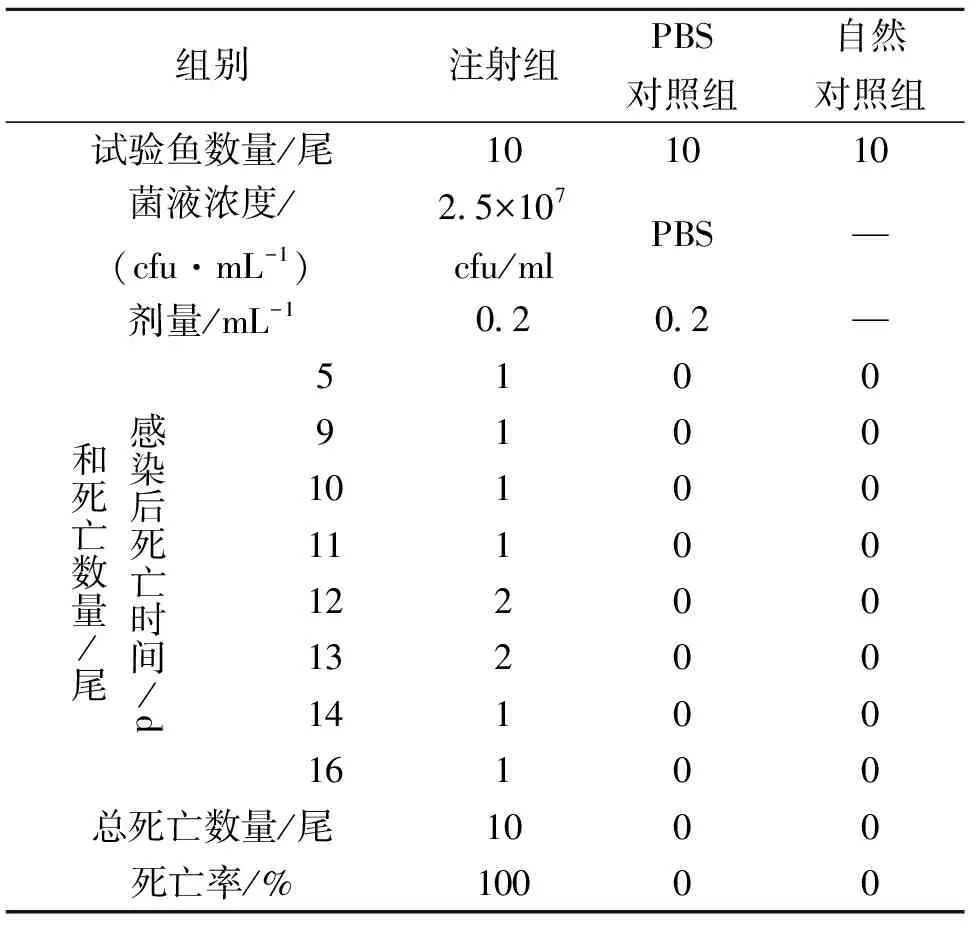
表2 菌株NH090627感染健康加州鲈试验结果

图5 基于16S rRNA基因序列同源性构建的系统发育树
图中所用各菌株16S rDNA序列号分别为:Nocardiaseriolae(DQ659915),Nocardiaotitidis-caviarum(DQ659912),Nocardiacrassostrae(Z37989),Nocardianova.( Z36930),Nocardiavaccinii(Z36927),Nocardiapseudobrasiliensis(X84857),Nocardiabrevicatena(Z36928),Nocardiacarnea(Z36929),Nocardiaflavorozea(Z46754),Nocardiatransvalensis(Z36926),Nocardiabrasiliensis(Z36935),Nocardiafarcinica(Z36936),Nocardiaasteroids(Z36934),Nocardiasalmonicida(Z46750)
2.6 药物敏感试验
试验结果表明该株鰤鱼诺卡菌对氯霉素、链霉素、卡那霉素、四环素等敏感,但对磺胺类和氨苄青霉素有耐药性(表3)。
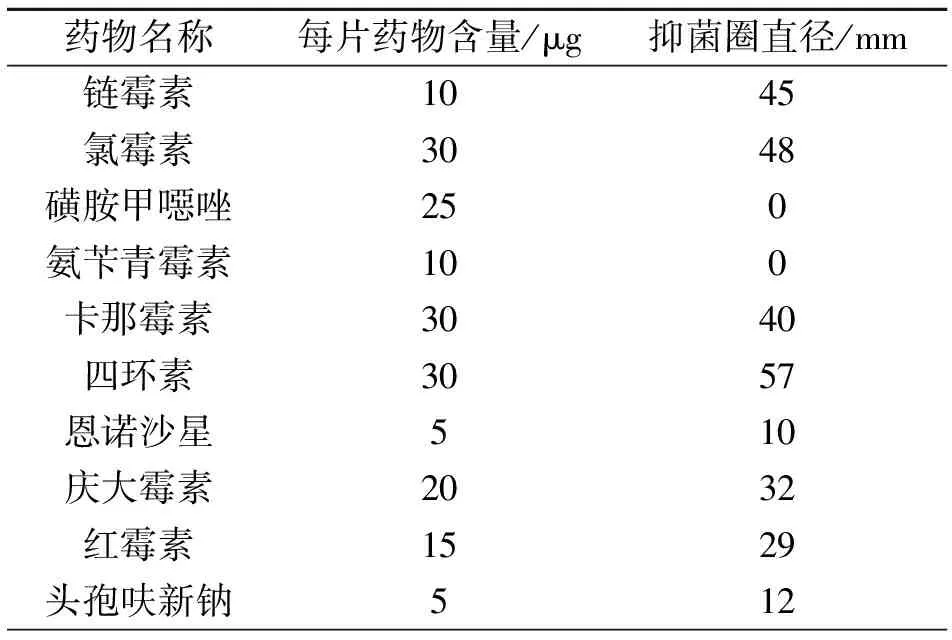
表3 菌株NH090627药敏试验结果
3 讨 论
诺卡菌广泛分布在水、土壤及活性污泥中,是人和动物的机会致病菌。 能引起水产动物疾病的诺卡菌包括鰤鱼诺卡菌Nocardiaseriolae[5,7]、杀鲑诺卡菌Nocardiasalmonicida[6]、星状诺卡菌Nocardiaasteroids[8]、粗形诺卡菌Nocardiacrassostreae[9]。鰤鱼诺卡菌最早于1968年分离自日本养殖五条鰤Seriolaquinqueradiata,它是目前报道最多的一种严重危害养殖鱼类的病原菌。据国外报道,该病原菌能感染多种养殖经济鱼类,如五条蛳Seriolaquinqueradiata、加州鲈Micropterussalmoides、海鲈Lateolabraxjaponicus、红鳍笛鲷Lutjanuserythropterus等[10-11]。尽管如此,国内有关养殖鱼类诺卡菌感染报道的还比较少,而且目前尚未见有关加州鲈诺卡病的系统分析报道。本文首次从患病加州鲈体内分离鉴定了病原菌,确定了引起加州鲈结节病的病原菌为鰤鱼诺卡菌。
通过对佛山、南海加州鲈养殖场的患病鱼解剖观察,我们发现其症状与以往报道的鱼类诺卡菌病十分相似,体表和内脏器官出现明显的结节状肉芽肿,肾脏尤为明显。肾脏组织切片能观察到明显的肉芽肿状结构,中央为坏死的组织残骸,被大量巨噬细胞和上皮细胞包围[5]。分离病原菌的形态、生长特性和生理生化特征与诺卡菌属相符,硝酸盐还原活性与国内报道的鰤鱼诺卡菌分离株一致,均为阳性[12-14],但是与分离自日本五条鰤的标准株Nocardiaseriolae JCM3360T不同[4]。为确定该菌株的分类地位,我们对其进行了16S rDNA序列的系统发育分析。从系统发育树上可以看到,该菌株与Nocardiaseriolae JCM3360T聚为一个分支,由此可以确定该菌株为鰤鱼诺卡菌Nocardiaseriolae。
为了进一步证实所分离的鰤鱼诺卡菌为加州鲈结节病的致病菌,我们进行了动物回归感染试验。结果表明该分离菌株对加州鲈具有很强的致病性,经2.5×107cfu/mL剂量腹腔注射感染的健康加州鲈全部死亡,而对照组未见死亡。同时,我们从感染鱼体内分离到形态和生化特征与从自然发病鱼体分离菌株完全一致的细菌,说明该菌是引起自然发病鱼死亡的病原菌。回归试验中发病鱼的内脏肿胀,并出现白灰色坏死病灶,但无明显的结节出现。究其原因可能是人工腹腔感染较为剧烈,试验鱼体对大量的病原菌反应强烈,因而呈现出肿胀、坏死病灶等急性炎症反应,自然感染条件下感染细菌数量较少,病程较长,因此出现慢性渐进病症。
为了指导养殖中该病的防控,本文还对该病原菌的药物敏感性进行了初步研究,纸片扩散法结果显示其对大多数试验药物均敏感,其中对氯霉素、链霉素、卡那霉素、四环素敏感性最强,而对磺胺类和氨苄青霉素则有耐药性,与暗纹东方鲀和卵形鲳鲹分离株耐药性基本一致[12-13]。本试验的结果能够为加州鲈魳鱼诺卡菌的药物防治提供一定的参考依据,在疾病高发季节,可以合理的使用部分药物进行预防。
鱼类诺卡菌病是一种全身性的慢性传染病,该病病情不剧烈,发病早期症状不明显,但持续时间长,一旦感染累积死亡率较高。2003年我国首次在水产养殖动物中发现诺卡菌病[14],近几年逐渐有蔓延和传染其他鱼类的趋势,该菌在广东地区养殖的乌鳢、卵形鲳鲹、紫红笛鲷上也多次被检出。因此,尽快开展流行病学调查,探究不同菌株之间的血清型和基因型关系,建立快速诊断方法,对于诺卡菌病的早期防治,避免其继续蔓延和传播,是非常必要的。
参考文献:
[1]LECHEVA1IER H A.Nocardioform Actinomycetes[C]//Bergey’s Manual of Systematic Bacteriology.Vol.4.Baltimore:The Williams and Wi1kins Co,1989:2348- 2404.
[2]刘志恒,姜成林.放线菌现代生物学与生物技术[M].北京:科学出版社,2004.
[3]EDWARDS U,ROGALL T,BLÖCKER H,et al.Isolation and direct complete nucleotide determination of entire genes.Characterization of a gene coding for 16S ribosomal RNA[J].Nucleic Acids Res,1989,17(19): 7843-7853.
[4]KUDO T,HATAI K,SEINO A.Nocardiaseriolaesp.nov.causing nocardiosis of cultured fish[J].International Journal of Systematic Bacteriology,1988,38: 173-178.
[5]CHEN S C,LEE J L,LAI C C,et a1.Nocardiosis in sea bass,Lateolabraxjaponicus,in Taiwan [J].Joural of Fish Disseases,2000,23(5): 299-307.
[6]ISIK K,CHUN J,HAH Y C,et a1.Nocardiasalmonicidanom.rev.,a fish pathogen[J].International Journal of Systematic Bacteriology,1998,49: 833-837.
[7]KUSUDA R,TAKI H,TAKEUEHI T.Studies on a nocardial infection of culture yellow tail Ⅱ.Characteristics ofNocardiakampachiisolated from a gil1-tuberculosis of yellow tail[J].Bulletin of the Japanese Society of Scientific Fisheries,1974,10: 369-373.
[8]CHEN S C,TUNG M C.A epizootie in large mouth bass,Micropterussalmoides,Lacepede caused byNocardiaasteroidesin freshwater pond in southern Taiwan[J].Journal of Chinese Society of Veterinary Science,1991,17: 15-22.
[9]FRIEDMAN C S,BEAMAN B L,CHUN J,et a1.Nocardiacrassostreaesp.nov.,the causal agent of nocardiosis in Pacific oysters[J].International Journal of Systematic Bacteriology,1998,48: 237-246.
[10]SHIMAHARA Y,NAKAMURA A,NOMOTO R,et al.Genetic and phenotypic comparison ofNocardiaseriolae,isolated from fish in Japan[J].Journal of Fish Diseases,2008,31: 481-488.
[11]SHIMAHARA Y,HUANG Y F,TSAI M A,et al.Genotypic and phenotypic analysis of fish pathogen,Nocardiaseriolae,isolated in Taiwan[J].Aquaculture,2009,294: 165-171.
[12]彭开松,佘锐萍,祁克宗,等.暗纹东方鲀脂肪肝并发诺卡氏菌病[J].水产科学,2008, 27 (12):629-632.
[13]王瑞旋,刘广锋,王江勇,等.养殖卵形鲳鲹诺卡氏菌病的研究[J].海洋湖沼通报,2010,1:52-58
[14]王国良,袁思平,金珊.网箱养殖大黄鱼诺卡氏菌病的初步研究[J].水产学报,2006,30 (1):103-107.
