腈水解酶重组菌发酵产酶条件的优化及应用
2012-05-07薛亚平郑裕国
吴 乔,薛亚平,郑裕国
(浙江工业大学生物工程研究所,浙江 杭州 310014)
腈水解酶是一类能选择性催化腈化合物生成酸和氨的蛋白酶[1,2],具有来源广泛、反应条件温和、高效专一等特点,常用于工农业生产[3,4]。
R-(-)-扁桃酸是一种重要的手性中间体,具有很好的生物分解性,是目前最受瞩目的酸性光学拆分剂,广泛应用于多种光学活性医药、农药的合成和手性化合物的光学拆分[3]。此外,R-(-)-扁桃酸的新的用途正不断被发掘,市场需求日益增大[5],其制备越来越受到重视。
R-(-)-扁桃酸的生产方法主要有化学法和生物法,其中生物法中的腈水解酶催化法由于底物价廉、反应条件温和、环境污染小、转化率高、产物光学纯度高,具有良好的工业化前景[1,5]。目前已报道的腈水解酶菌株主要有AlcaligenesfaecalisATCC 8750[6,7]、PseudomonasputidaMTCC 5110[8,9]、Alcaligenessp.ECU0401[10,11]等。构建腈水解酶基因工程菌并进行发酵产酶已成为工业化生产R-(-)-扁桃酸的重要手段。Banerjee等[12]对P.putidaMTCC 5110的腈水解酶基因进行克隆,构建了重组菌E.colipET21b(+)-PspNit,但其摇瓶发酵的生物量较低,单位体积产酶不高。张志钧等利用来自Alcaligenessp.ECU0401的腈水解酶基因重组得到E.coliJM109,优化后,摇瓶生物量为3.13 gdcw·L-1,产酶量达到4760 U·L-1,e.e.值大于95%[13,14]。
Xue等[15,16]通过大规模的筛选和育种,获得一株高活性的立体选择性腈水解酶菌株A.faecalisZJUTB10,并利用该腈水解酶进行了生物催化外消旋扁桃腈生产R-(-)-扁桃酸的研究。用PCR方法扩增出A.faecalisZJUTB10腈水解酶基因,并将其插入到表达载体pET28b(+)中,IPTG诱导后,腈水解酶在大肠杆菌胞内进行了活性表达,具有较高的活性[17]。
作者在此优化了含有A.faecalisZJUTB10腈水解酶基因的工程菌E.coliBL21(DE3)/pET28b(+)-NIT的培养基组分以及诱导产酶条件,拟为生物法工业化催化扁桃腈生产R-(-)-扁桃酸提供参考。
1 实验
1.1 材料、试剂与仪器
产腈水解酶基因工程菌E.coliBL21(DE3)/pET28b(+)-NIT,目的基因源于A.faecalisZJUTB10,该基因序列全长1068 bp,编码372个氨基酸,预测其分子量为41 548 Da,该序列已提交到GenBank数据库,数据库登记号为HQ407378,自行构建。
扁桃腈(Acros)、扁桃酸(J&K),其余试剂均为市售分析纯,实验用水为蒸馏水。
高速离心机,美国Beckman Coulter;FA2004型电子分析天平,上海精密仪器仪表有限公司;SPD-20A型高效液相色谱仪,日本岛津公司;Sky-110WX型水浴摇床,上海苏坤有限公司。
1.2 培养基
种子培养基:蛋白胨10 g·L-1,酵母浸出汁5 g·L-1,NaCl 10 g·L-1,卡那霉素50 mg·L-1,121 ℃灭菌20 min。
初始发酵培养基:蛋白胨10 g·L-1,酵母浸出汁5 g·L-1,NaCl 10 g·L-1,pH值7.5,121 ℃灭菌20 min。
1.3 方法
初始培养方法:从甘油管或斜面挑取重组工程菌至装液量为50 mL (250 mL三角瓶)的种子培养基中,37 ℃培养12 h后,取1 mL种子液于装液量为100 mL(500 mL三角瓶)的发酵培养基中,37 ℃培养4 h后加诱导剂乳糖2.0 g·L-1,转入28 ℃诱导培养16 h后离心收集菌体。
转化方法:将菌体用生理盐水(0.85%)洗涤,称取0.05 g菌体悬浮于10 mL(pH值8.5)Tris-HCl缓冲溶液中(测产酶时取1 mL发酵液离心,收集菌体,生理盐水洗涤后悬浮于5 mL缓冲溶液中),加入底物R,S-扁桃腈(终浓度50 mmol·L-1),35 ℃、180 r·min-1下反应20 min,立即取样1 mL,12 000 r·min-1离心6 min终止反应,取上清液,检测产物和底物的浓度。
1.4 分析检测
1.4.1 生物量的测定
取30 mL发酵液离心收集菌体,并用生理盐水(0.85%)洗涤,90 ℃烘干至恒重,即为发酵液的生物量,以gdcw·L-1计。
1.4.2 酶活的测定
产物和底物浓度的检测:色谱柱为Hypersil ODS(250 mm×4.6 mm,填料粒径5 μm),流动相为甲醇∶NH4H2PO4(50 mmol·L-1)=35∶65 (体积比),柱温 35 ℃,流速1 mL·min-1,检测波长228 nm。
酶活力定义为:每分钟催化生成1 μmolR-(-)-扁桃酸所需的酶量为1个酶活力单位(U)。
1.4.3 产物对映体过量值的测定
将转化样品用浓盐酸调pH值至1.5,加入等体积乙酸乙酯萃取,收集有机相,风干,干燥后将白色晶体溶解于流动相正己烷∶异丙醇∶三氟乙酸(90∶10∶0.1),用于色谱分析。色谱柱为CHIRALEL-OD-H手性柱 (250 mm×4.6 mm,5 μm;Daicel Chemical Industries,Japan),柱温40 ℃,流速0.8 mL·min-1,检测波长228 nm。R-(-)-扁桃酸的光学纯度通过计算对映体过量值(e.e.值)来评价。
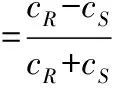
式中:cR和cS分别为R型和S型异构体的浓度。
2 结果与讨论
2.1 碳源对重组菌产酶的影响
以初始发酵培养基为基础,考察不同碳源对菌株生长和产酶的影响,结果见表1。

表1 碳源对菌株生长和产酶的影响
由表1可知,碳源为甘油、葡萄糖、麦芽糖和甘露醇时,在乳糖诱导下,酶活很低或者没有;碳源为玉米浆粉时比酶活和产酶量最高,分别达到约209.19 U·g-1、2275.99 U·g-1,生物量较高,约为2.72 gdcw·L-1。综合考虑,选择最佳碳源为玉米浆粉。
玉米浆粉浓度对菌株生长和产酶的影响见图1。

图1 玉米浆粉浓度对菌株生长和产酶的影响
由图1可知,玉米浆浓度为10 g·L-1时比酶活最高,但生物量不高;玉米浆粉浓度为25 g·L-1时,产酶量最高,达2505.39 U·L-1;考虑到产酶,选择最佳玉米浆粉浓度为25 g·L-1。
2.2 氮源对重组菌产酶的影响
以初始发酵培养基为基础,考察不同氮源对菌株生长和产酶的影响,结果见表2。
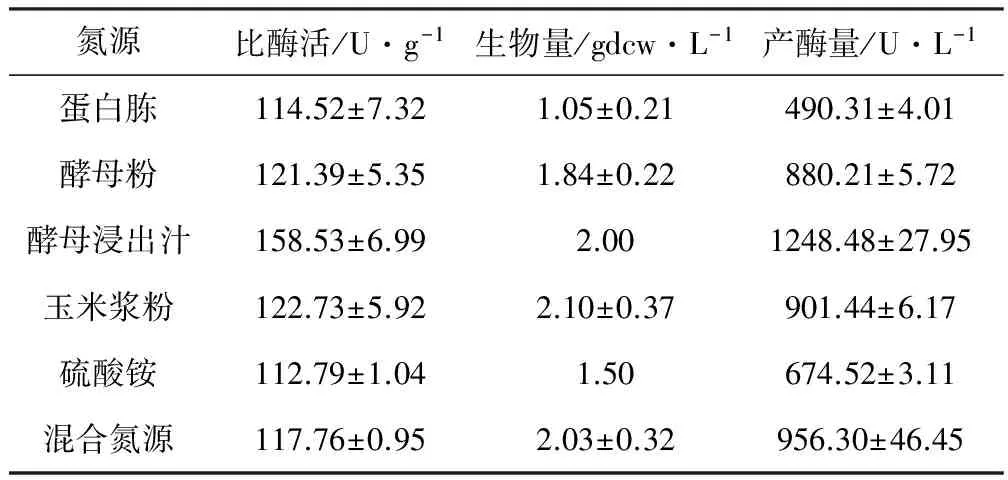
表2 氮源对菌株生长和产酶的影响
由表2可知,氮源为酵母浸出汁时,比酶活有明显优势,产酶量也最高。因此,选择最佳氮源为酵母浸出汁。
酵母浸出汁浓度对菌株生长和产酶的影响见图2。
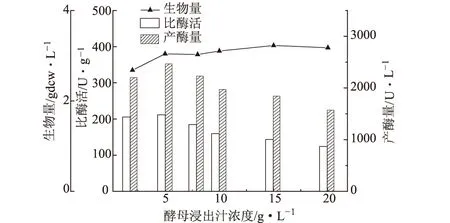
图2 酵母浸出汁浓度对菌株生长和产酶的影响
由图2可知,选择最佳酵母浸出汁浓度为5 g·L-1,比酶活和产酶量均最高,分别为210.29 U·g-1和2458.76 U·L-1。
2.3 磷酸盐对重组菌产酶的影响
以初始发酵培养基为基础,考察不同磷酸盐对菌株生长和产酶的影响,结果见图3。

1.K2HPO4 2.KH2PO4 3.Na2HPO4 4.NaH2PO4 5.(NH4)2HPO4 6.NH4H2PO4 7.Control
由图3可知,KH2PO4、NaH2PO4、NH4H2PO43种磷酸盐对比酶活有促进作用,分别为262.67 U·g-1、245.27 U·g-1、244.60 U·g-1(对照样比酶活为234.15 U·g-1),说明含2个氢离子的磷酸盐利于腈水解酶的表达,但是磷酸盐的加入减少了生物量,抑制了产酶。
至此,我终于明白了。她所谓的“怕”,其实是面对弱者的遭遇无力提供帮助而产生的自责,继而形成的逃避行为。
2.4 金属离子对重组菌产酶的影响(表3)

表3 金属离子对菌株生长和产酶的影响
由表3可知,Cu+、Mg2+(MgCl2·6H2O)、Fe3+、Fe2+、Al3+、Ca2+对相对酶活有促进作用,对生物量影响不一,Fe3+、Fe2+有利于菌株产酶(分别提高3.71%和2.45%),由于Fe2+在空气中容易被氧化成Fe3+,可认为Fe3+促进了菌株产酶。
Fe3+浓度对菌株生长和产酶的影响见图4。

图4 Fe3+浓度对菌株生长和产酶的影响
由图4可知,选择最佳Fe3+浓度为0.5 mmol·L-1,比酶活和产酶量最高,分别为252.49 U·g-1和2502.89 U·L-1。
2.5 诱导剂乳糖浓度对重组菌产酶的影响(图5)

图5 乳糖浓度对菌株生长和产酶的影响
由图5可知,随着乳糖浓度的增大,菌株生物量上升,比酶活和产酶量呈现先升后降的趋势。选择最佳乳糖浓度为0.5 g·L-1,比酶活和产酶量最高,分别为340.91 U·g-1和3262.84 U·L-1。
2.6 诱导温度对重组菌产酶的影响(图6)

图6 诱导温度对菌株生长和产酶的影响
由图6可知,随着诱导温度的升高,比酶活和产酶量呈现先升后降的趋势,在30 ℃时最高,分别为352.06 U·g-1和3791.12 U·L-1;菌株生物量呈现先升后降再升的趋势,在30 ℃时最高,而后下降,超过35 ℃时,又缓慢回升。综合考虑,选择最佳诱导温度为30 ℃。
2.7 乳糖加入时间对产酶的影响(图7)

图7 乳糖加入时间对菌株生长和产酶的影响
由图7可知,随着乳糖加入时间的延后,比酶活和产酶呈现先升后降的趋势,在乳糖加入时间为6 h时最高,分别为368.04 U·g-1和3880.50 U·L-1;菌株生物量呈现先降后升再降的趋势。综合考虑,选择最佳乳糖加入时间为6 h。
2.8 重组菌产酶过程(图8)
自诱导剂加入后开始计时,不同时间取样分析检测诱导过程中pH值、比酶活、生物量以及产酶量的变化,见图8。

图8 加入乳糖后发酵过程中菌株生长和产酶的变化
由图8可知,随着诱导时间的延长,pH值没有明显变化,生物量一直呈上升趋势,比酶活在16 h时达到最高368.92 U·g-1,其后急剧下降。从产酶出发考虑,选择最佳诱导时间为28 h,其生物量、比酶活以及产酶量分别为5.27 gdcw·L-1、297.15 U·g-1和6161.46 U·L-1。
2.9 重组菌腈水解酶不对称催化转化外消旋型扁桃腈生成R-(-)-扁桃酸
以最优培养条件下获得的菌体催化外消旋型扁桃腈生成R-(-)-扁桃酸,结果见图9。

图9 菌体催化扁桃腈生成R-(-)-扁桃酸的过程
由图9可知,初始底物浓度为47.77 mmol·L-1,转化50 min后产物浓度为43.96 mmol·L-1,转化率达92.02%,产物e.e.值达99%以上,表明该酶的立体选择性很严格。
3 结论
对于重组菌E.coliBL21 (DE3)/pET28b(+)-NIT产腈水解酶,最适发酵培养基为:玉米浆粉25 g·L-1,酵母浸出汁5 g·L-1,NaCl 10 g·L-1,Fe3+0.5 mmol·L-1,初始pH值7.5;最适诱导产酶条件为:诱导剂乳糖0.5 g·L-1,诱导剂加入时间为接种6 h后,诱导温度30 ℃,诱导时间28 h。在该条件下,产酶量达到6161.46 U·L-1,所得菌体用于不对称转化R,S-扁桃腈生成R-(-)-扁桃酸,转化率达92.02%,产物e.e.值达99%以上。该菌株十分有潜力作为R-(-)-扁桃酸工业生产的生物催化剂。
参考文献:
[1] 徐赛珍,郑裕国.选择性腈水解酶在生物催化中的应用[J].浙江化工,2009,40(5):13-18.
[2] Singh R,Sharma R,Tewari N,et al.Nitrilase and its application as a ′green′ catalyst[J].Chem Biodivers,2006,3(12):1279-1287.
[3] 郑裕国,薛亚平,沈寅初,等.腈转化酶在精细化学品生产中的应用[J].生物工程学报,2009,25(12):1795-1807.
[4] 徐建妙,郑裕国,沈寅初.腈水解酶的来源、结构、作用机制及其应用[J].微生物学通报,2005,32(5):141-146.
[5] 陈艳,薛亚平,郑裕国.生物催化法合成R-扁桃酸的研究进展[J].精细与专用化学品,2010,18(2):55-60.
[6] Yamamoto K,Fujimatsu I,Komatsu K I.Purification and characterization of the nitrilase fromAlcaligenesfaecalisATCC 8750 responsible for enantioselective hydrolysis of mandelonitrile[J].J Ferment Bioeng,1992,73(6):425-430.
[7] Yamamoto K,Kazuhiko O,Isao F,et al.Production ofR-(-)-mandelic acid from mandelonitrile byAlcaligenesfaecalisATCC 8750[J].Appl Environ Microbiol,1997,57(10):3028-3032.
[8] Kaul P,Banerjee A,Mayilraj S,et al.Screening for enantioselective nitrilases:Kinetic resolution of racemic mandelonitrile to (R)-(-)-mandelic acid by new bacterial isolates[J].Tetrahedron:Asymmetry,2004,15(2):207-211.
[9] Naik S C,Kaul P,Banerjee A,et al.Studies on the production of enantioselective nitrilase in a stirred tank bioreactor byPseudomonasputidaMTCC 5110[J].Bioresource Technology,2008,99(1):26-31.
[10] He Y C,Xu J H,Xu Y,et al.Biocatalytic synthesis of (R)-(-)-mandelic acid from racemic mandelonitrile by a newly isolated nitrilase-producerAlcaligenessp.ECU0401[J].Chinese Chemical Letters,2007,18(6):677-680.
[11] Zhang Z J,Xu J H,He Y C,et al.Cloning and biochemical properties of a highly thermostable and enantioselective nitrilase fromAlcaligenessp. ECU0401 and its potential for (R)-(-)-mandelic acid production[J].Bioprocess and Biosystems Engineering,2011:34(3):315-322.
[12] Banerjee A,Dubey S,Kaul P,et al.Enantioselective nitrilase fr-omPseudomonasputida:Cloning,heterologous expression,and bioreactor studies[J].Mol Biotechnol,2009,41(1):35-41.
[13] Liu J F,Liu Z J,Xu J H,et al.Significantly enhanced production of recombinant nitrilase by optimization of culture conditions and glycerol feeding[J].Appl Microbiol Biotechnol,2010,89(3):665-672.
[14] Zhang Z J,Xu J H,He Y C,et al.Efficient production of (R)-(-)-mandelic acid with highly substrate/product tolerant and enantioselective nitrilase of recombinantAlcaligenessp.process[J].Biochemistry,2010,45(6):887-891.
[15] Xue Y P,Xu S Z,Liu Z Q,et al.Enantioselective biocatalytic hydrolysis of (R,S)-mandelonitrile for production of (R)-(-)-mandelic acid by a newly isolated mutant strain[J].J Ind Microbiol Biotechnol,2011,38(2):337-345.
[16] Xue Y P,Liu Z Q,Xu M,et al.Enhanced biotransformation of (R,S)-mandelonitrile to (R)-(-)-mandelic acid with in situ production removal by addition of resin[J].Biochem Eng J,2011,53(1):143-149.
[17] Liu Z Q,Dong L Z,Cheng F,et al.Gene cloning,expression,and characterization of a nitrilase fromAlcaligenesfaecalisZJUTB10[J].J Agr Food Chem,2011,59(21):11560-11570.
