MAPK和PI3K调节缺氧诱导因子 2α对慢性阻塞性肺疾病的作用
2012-04-29孔春初戴爱国
孔春初 戴爱国
[摘要] 目的 探讨缺氧诱导因子2α(HIF-2α)、丝裂原活化蛋白激酶(MAPK),磷酸肌醇3-激酶(PI3K) 的表达变化在缺氧性肺动脉高压(HPH)中的作用和意义。 方法 选择COPD患者(24例)和非COPD对照组(28例)患者为研究对象,行HE染色检测两组患者肺小动脉形态学改变,应用免疫组化检测肺小动脉壁内P-AKT、P-ERK、P-JNK、P-P38表达水平,应用原位杂交和免疫组化检测肺小动脉壁内HIF-2α的表达水平。 结果 COPD患者管壁面积与管总面积比值及肺小血管中膜厚度均较对照组增高(P < 0.01)。COPD患者肺小血管壁P-ERK以及P-AKT和HIF-2α基因表达水平较对照组患者肺血管壁内增强,而P-JNK、 P-P38表达水平较对照无明显变化。 结论 MAPK信号通路和磷酸肌醇3-激酶(PI3K)信号通路以及HIF-2α可能参与了COPD患者HPH的发生。
[关键词] 丝裂原活化蛋白激酶;磷酸肌醇3-激酶;缺氧诱导因子2α;缺氧;高血压,肺性
[中图分类号] R563.9[文献标识码] A[文章编号] 1673-9701(2012)21-0001-03
慢性阻塞性肺病(chronic obstructive pulmonary diseases,COPD)是一种具有气流受限特征的可以预防和治疗的疾病,气流受限不完全可逆、呈进行性发展,与肺部对香烟烟雾等有害气体或有害颗粒的异常炎症反应有关。COPD主要累及肺脏,但也可引起全身(或称肺外)的不良反应,长期COPD患者因气流长期受限多存在低氧血症,肺小动脉痉挛,结构重塑,最终导致肺动脉压力增高,肺血管阻力增加,左心代偿性肥厚,进行导致慢性肺心病。HIF-2α是机体低氧适应反应过程中的关键性转录因子,由α功能亚基 (HIF-2α)和β结构亚基(HIF-2β)组成[1-2],可与下游目的基因的低氧反应元件(HRE)结合,促进低氧反应基因的转录来适应低氧状态。笔者前期的研究提示,HIF-2α参与 COPD的肺血管重塑,磷脂酰肌醇3-激酶(PI3K)、有丝分裂原激活蛋白激酶(MAPK)通路调控HIF 在缺氧大鼠HPSR 形成中有重要作用[3-4]。本研究通过观察COPD患者肺小动脉壁内HIF-2α与P-ERK、P-JNK、P-P38、P-Akt的表达变化,从而探讨其在HPH发病机制中的作用。
1 资料与方法
1.1 一般资料
选择湖南省老年医院胸外科2008年1~12月收治的行肺叶切除术患者52例,原发病为支气管扩张、肺癌、肺炎性假瘤、肺结核等。全部患者术前均进行体检、肺功能检查、胸部CT、X线检查,并结合病史进行诊断。其中COPD患者24例,非COPD患者28例,COPD的诊断符合2002年合中华医学会标准。COPD组24例患者中,男16例,女8例,年龄(61±5)岁,其中轻度5例,中度7例,第一秒用力呼气容积(FEV1)占预计百分比为(68±7.1)%,切除标本的位置位于肺右下叶7例,左上叶5例;对照组(无COPD者)28例,其中男18例,女10例,年龄(59±7)岁,切除标本的位置位于右下叶8例,左上叶6例,FEV1占预计百分比为(90±4.5)%。两组患者的性别、年龄、标本位置比较,差异无统计学意义。
1.2 免疫组化实验
切除标本采用中性甲醛固定12 h,行常规石蜡包埋切片,然后在37℃温控下采用0.125%胰蛋白酶消化20 min后行抗原修复,加入一抗体,抗体主要有小鼠抗人HIF-2α,P-ERK、P-JNK、P-P38、P-Akt 单克隆抗体(购自美国Santa Cruz公司,1∶100 稀释);即用型兔抗人iNOS 多克隆抗体(美国Santa Cruz 公司生产),设定温度为 4℃,孵育过夜,采用福州迈新生物技术开发公司生产的超敏S-P试剂盒,严格按使用说明书操作,先后行DAB 显色,苏木素复染。设置阴性对照,加入试剂为PBS(代替一抗)。
1.3 原位杂交实验
原位杂交的前期暴露mRNA的标本处理同免疫组化检查加入抗体前的操作步骤,预杂交温度为40℃,预杂交时间为2 h,2 h后加入HIF-2α mRNA 探针(高辛标记的多相寡核苷酸探针),探针序列依次为:(1)5''-CGAAC ACATA AACTC CTGTC TTCAG TGTGC-3'';(2)5''-ATCCG AGAGA ACCTG ACACT CAAAA CTGGC-3'';(3)5''-GGGCA AGTGA GAGTC TACAA CAACT GCCCC-3''。设定杂交温度为38℃,时间为12 h,过夜后检测杂交结果,检测方法采用武汉博士德生物工程公司生产的原位杂交检测试剂盒,操作步骤严格按说明书进行。设置阴性对照,对照标本在杂交实验中加入空白杂交液(代替探针)。
1.4 结果判断与统计学分析
染色结果判断,光学显微镜下观察标本背景颜色判断染色结果,背影无明显染色为阴性(-);背景染色为淡黄色提示弱阳性(+);背景染色为黄色提示阳性(++),背景染色为深黄色或棕色则提示为强阳性(+++)。每位患者的切片标本均选择3条肺动脉,观察其染色情况,并进行比较,统计方法采用Ridit 分析及卡方检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 肺组织构型观察
COPD 患者肺部出现巨噬细胞炎性浸润,肺泡隔纤维组织增生,支气管壁增厚,肺部微动脉管壁平滑肌层显著增生,微血管管壁明显增厚,导致管腔变窄。对照组患者肺组织标本显示除部分存在炎症细胞浸润外,肺血管、支气管、微血管及官腔未见明显异常。
2.2 HIF-2α mRNA表达
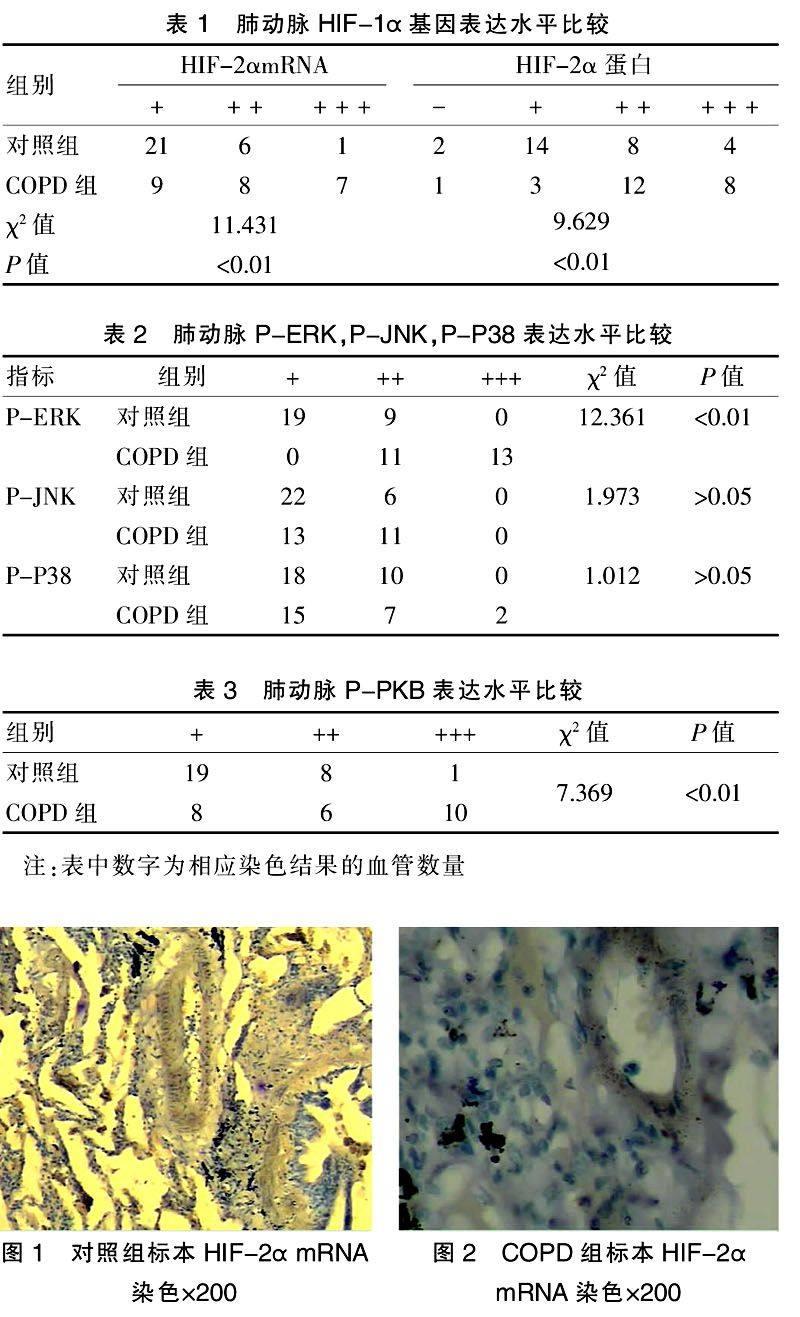
COPD 患者肺组织标本染色显示,肺部炎症细胞、部分肺泡上皮细胞及部分肺动脉壁细胞HIF-2α mRNA和蛋白质染色呈强阳性,其余部位HIF-2αm RNA和蛋白质染色均呈阳性(图2、4)。对照组患者肺组织标本免疫组化及杂交试验显示,HIF-2α mRNA染色弱阳性,蛋白质染色呈阴性,很少部分患者肺组织中肺泡上皮细胞及小部分肺动脉壁HIF-2α mRNA 染色阳性,蛋白质染色呈弱阳性(表1,图1、3) 。
2.3 P-ERK、P-JNK、P-P38、P-Akt蛋白质的表达
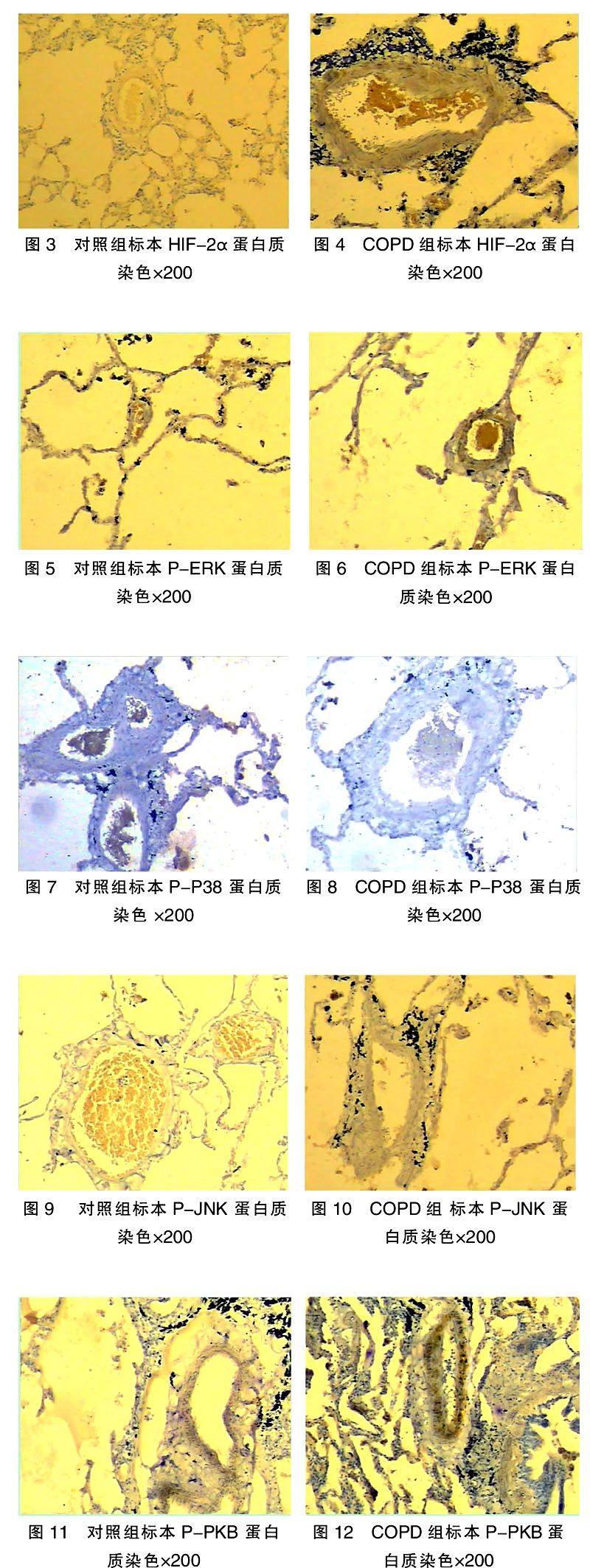
COPD 患者肺部部分肺动脉壁细胞P-ERK蛋白质染色呈强阳性,其余部位P-ERK蛋白质染色均呈阳性(表2,图6),对照组大部分肺组织P-ERK染色呈阴性,部分肺泡上皮细胞及少量肺动脉壁染色呈弱阳性(表2,图5)。COPD 患者肺部标本组织免疫组化及杂交试验显示,部分肺动脉壁细胞P-Akt蛋白质染色呈强阳性,其余部位P-Akt蛋白质染色均呈阳性(表3,图12),对照组患者肺标本免疫组化及杂交试验染色显示,大部分肺组织P-Akt染色呈阴性,少量肺泡上皮细胞及小部分肺动脉壁染色呈弱阳性(表3,图11)。COPD 患者肺部组织免疫组化及杂交试验染色显示,部分肺动脉壁细胞P-JNK,P-P38蛋白质染色呈阴性,其余部位P-JNK、P-P38蛋白质染色均呈弱阳性(表2,图8,10)。对照组患者肺部组织免疫组化及杂交试验染色显示大部分肺组织P-JNK、P-P38染色呈阴性(表2,图7,9),少量肺泡上皮细胞及小部分肺动脉壁染色呈弱阳性。
表1 肺动脉HIF-1α基因表达水平比较
表2 肺动脉P-ERK,P-JNK,P-P38表达水平比较
表3 肺动脉P-PKB表达水平比较
注:表中数字为相应染色结果的血管数量
3 讨论
COPD的发病机制尚未完全明了,目前普遍认为COPD以气道、肺实质和肺血管的慢性炎症为特征,在肺的不同部位有肺泡巨噬细胞、T淋巴细胞(尤其是CD)和中性粒细胞增加,部分患者有嗜酸性粒细胞增多。激活的炎症细胞释放多种介质,包括白三烯B4(LTB4)、白细胞介素8(1L-8)、肿瘤坏死因子α(TNF-α)和其他介质。这些介质能破坏肺的结构和(或)促进中性粒细胞炎症反应。除炎症外,肺部的蛋白酶和抗蛋白酶失衡、氧化与抗氧化失衡以及自主神经系统功能紊乱(如胆碱能神经受体分布异常)等也在COPD发病中起重要作用。
本文研究显示对照组患者肺组织少量肺泡上皮细胞及很少的肺动脉壁HIF-2α mRNA阳性、HIF-2α,P-ERK,P-Akt蛋白质弱阳性,其余肺组织HIF-2α mRNA 弱阳性,HIF-2α、P-ERK、P-Akt蛋白质阴性;COPD 患者肺部HIF-2α mRNA 及蛋白质和P-ERK、P-Akt蛋白表达均明显增强,由此可见HIF-2α基因的转录和翻译以及P-ERK、P-Akt蛋白在COPD 患者肺组织内均明显增强或上调,这提示HIF-2 和P-ERK、P-Akt参与了COPD 的发病过程。COPD 患者气流受限,导致的低氧血症,肺泡通气不足氧分压下降及反应性气道狭窄肺泡通气不均等因素可有效引发患者肺部HIF-2α蛋白质和P-ERK、P-Akt表达增强。
动物和细胞实验证明[5-10],在缺氧条件下,P-ERK和P-Akt活化表达,可使HIF-2α中氧依赖性降解区内氨基酸磷酸化,进而增加HIF-2α的稳定性,还可通过其磷酸化解除其翻译调控蛋白EIF-4E的抑制因素,进一步增加HIF-2α的翻译、转录,间接促进HIF-2α蛋白表达的增加。本组实验发现,伴随肺部P-ERK和P-Akt蛋白表达增加,对应部位的HIF-2α蛋白表达也明显增加,并且COPD患者肺动脉管壁,P-Akt、P-ERK蛋白和HIF-2α表达均显著增高,且同时显微镜观察显示COPD患者微动脉平滑肌增厚,肺动脉壁增厚、动脉管腔变窄,由此可以得出P-ERK,P-Akt通过增加HIF-2α基因的表达而间接参与了COPD患者的肺血管重构。
[参考文献]
[1]李启芳,戴爱国. 大鼠缺氧性肺动脉高压时三种缺氧诱导因子α亚基在肺动脉中的差异表达[J]. 中华结核和呼吸杂志,2006,29(2):113-117.
[2]李启芳,戴爱国. 慢性阻塞性肺疾病患者肺小血管低氧诱导因子-α的表达[J]. 中华内科杂志,2006,45(2):136-139.
[3]孔春初,戴爱国,胡瑞成. 磷酸肌醇3-激酶调控缺氧诱导因子1α对大鼠缺氧性肺动脉高压的作用[J]. 中国病理生理杂志,2006,22(11):2132-2137.
[4]孔春初,戴爱国. 丝裂原活化蛋白激酶调节缺氧诱导因子1α对大鼠缺氧性肺动脉高压的作用[J]. 中华结核和呼吸杂志,2005,28(5):328-332.
[5]Sally K. Martin, Peter Diamond, et al. Hypoxia-inducible factor-2 is a novel regulator of aberrant CXCL12 expression in multiple myeloma plasma cells[J]. Haematologica,2010,95(5):776-784.
[6]Sascha Seidel,Boyan K. Garvalov et al. A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2[J]. Brain,2010,133(pt 4):983-995.
[7]Julie M. Roda,Laura A. Sumner et al. Hypoxia-Inducible Factor-2α Regulates GM-CSF-Derived Soluble Vascular Endothelial Growth Factor Receptor 1 Production from Macrophages and Inhibits Tumor Growth and Angiogenesis J[J]. Immunol Aug,2011,187(4):1970-1976.
[8]Hye-Sik Kong,Sunmin Lee,Kristin Beebe,et al. Emetine Promotes von Hippel-Lindau-Independent Degradation of Hypoxia-Inducible Factor-2 in Clear Cell Renal Carcinoma[J]. Mol Pharmacol,2010,78(6):1072-1078.
[9] Faten Bougatef,Cathy Quemener,Sabrina Kellouche,et al. EMMPRIN promotes angiogenesis through hypoxia-inducible factor-2-mediated regulation of soluble VEGF isoforms and their receptor VEGFR-2[J]. Blood, Dec,2009,114(27):5547-5556.
[10]Samar Farha, Kewal Asosingh, Weiling Xu,et al. Hypoxia-inducible factors in human pulmonary arterial hypertension: a link to the intrinsic myeloid abnormalities[J].Blood,2011,117(13):3485-3493.
(收稿日期:2012-05-15)
