酸浆宿萼总皂苷对小鼠胃癌细胞(MFC)生长的影响
2012-04-25任石涛曹虎灵王晓闻
任石涛,曹虎灵,王晓闻
(山西农业大学 食品科学与工程学院,山西 太谷030801)
酸浆[Physalis alkekengi L.var.franchetii(Mast.)Makino]又名红姑娘,为茄科植物酸浆带宿萼的果实[1],是一种独特的浆果。酸浆的药理作用有:消炎、降血糖、降血脂、镇痛、抗氧化、抗菌和抗癌等[2]。
皂苷(Saponins)又称皂素,是广泛存在于植物界的一类特殊的甙类,它的水溶液振摇后可产生持久的肥皂样的泡沫,因而得名[3,4]。皂苷的药理作用有:双向调节免疫、抗缺氧、抗疲劳、,抗低温应激、抗脂质氧化和抗致突变作用等[5]。
近年来,大量的临床和实验研究证明,中药在肿瘤的防治和康复方面均具有重要的作用[6]。天然产物是新药研发的可靠和较好来源[7]。据不完全统计,来源于植物药的抗癌制剂,占总抗癌药物的32.25%。常用抗癌药物秋水仙碱、长春碱、紫杉醇等均来自天然产物的提取分离或合成[8]。近年来,一些皂苷也被发现具有防癌治癌的效果:人参皂苷Rh2,Rg3,Rs4等可通过抑制肿瘤细胞的生长和增殖,诱导肿瘤细胞分化和凋亡,抑制肿瘤细胞的侵袭和转移等途径发挥抗肿瘤作用,且这些皂苷对正常细胞的毒副作用均较小[9~12];杜德极[13]发现葛根总皂甙对P388白血病的3H-TdR掺入法均有不同程度的抑制作用;徐长福[14]发现绞股蓝总皂甙(GP)对S180肉瘤有明显抑制作用,使肿瘤生长延缓,瘤周期中淋巴细胞、巨噬细胞浸润明显增多。在对植物酸浆的研究中,分离出酸浆总皂苷,并对肿瘤细胞的生长等方面的影响进行探索性研究,以期扩展酸浆的应用。
1 材料与仪器
1.1 试验材料
酸浆宿萼:采自山西省大同市阳高县种植基地
小鼠胃癌细胞(MFC):购于北京北纳创联生物技术研究院
1.2 试验试剂
RPMI-1640培养基(美国Gibico公司)、胎牛血清(杭州四季青公司)、胰蛋白酶,MTT(Sigma公司)、青,链霉素(华北制药)、DNA ladder maker(生工生物工程)、细胞凋亡检测试剂盒(TaKaRa公司)、二甲基亚砜(DMSO)(北京试剂公司产品)
1.3 试验仪器
凝胶成像系统(捷达)、酶标仪(Thermo Labsystems)、医用型超净工作台(上海博讯实业有限公司)、电泳仪/槽(北京市六一仪器厂)、倒置相差显微镜(OLYMPUS公司)、二氧化碳培养箱(HEAL FORCE)、可调式微量移液器(德国Eppendorf)、离心机(上海安婷科学仪器有限公司)
2 试验方法
2.1 肿瘤细胞体外培养
小鼠胃癌细胞MFC以适量浓度接种于培养瓶中,加入RMPI-1640培养液(含10%小牛血清),置于37℃,5%CO2,饱和湿度恒温培养箱中培养。隔天换液一次,细胞呈单层贴壁生长,每3~4天传代一次,传代时加1mL胰蛋白酶消化5~10s,用培养液吹打制成细胞悬液,按照所需要的浓度接种。
2.2 不同浓度TPS对小鼠胃癌细胞MFC细胞形态的影响
根据文献中细胞培养方法[16~18,20]。用胰蛋白酶消化 MFC细胞,用含10%FBS RMPI-1640培养液制成细胞悬液,以适当的细胞密度将细胞悬液加入96孔板中,置于二氧化碳培养箱中,在37℃、5%CO2及饱和湿度条件下培养24h,然后加入不同浓度的TPS,使 TPS的终浓度分别为0、0.5、10、20、40、80μmol·L-1,继续培养24h后在显微镜下观察、记录。
2.3 不同浓度TPS对小鼠胃癌细胞MFC细胞增殖抑制的影响
根据文献中细胞增殖抑制培养方法[16~20]。取对数生长期 MFC细胞,用含10%FBS RMPI-1640培养液制成一定浓度细胞悬液,接种于96孔培养板中,每孔体积100μL。将培养板移入CO2培养箱中,在37℃、5%CO2及饱和湿度条件下培养24h,吸掉培养基然后加入含有不同浓度TPS(0、0.5、10、20、40、80μmol·L-1)的培养基100 μL,继续培养24h,每孔加入 MTT溶液(5g·L-1)50μL后,继续培养4h,小心吸弃孔内培养上清液,加入150μL DMSO轻轻振荡使之充分溶解,选择460nm波长在酶联免疫检测仪上测定各孔光吸收值,进行细胞增殖分析。同样的方法分别在48,72h进行培养。用酶联免疫检测仪在460 nm波长下测定各孔光吸收值(A),进行细胞增殖分析。

2.4 不同浓度TPS对小鼠胃癌细胞MFC细胞凋亡的影响
根据细胞凋亡检测试剂盒步骤。把106~107的细胞用PBS(-)Buffer清洗后,悬浮于少量的PBS(-)Buffer中,移入1.5mL Micro tube中,离心5min,除去上清。将Micro tube底部的细胞沉淀加入100μL的Lysis Buffer,用振荡器激烈混合10s后,离心5min。把上清移入1.5mL Micro tube中。其沉淀再加入Lysis Buffer重复一次。合并上清液,向其中加入10%SDS Solution 20 μL,再加入Enzyme A 20μL,56℃反应1h。反应完成后加入Enzyme B 20μL,37℃反应1h。加入Precipitant 130μL、0.95mL的乙醇,-20℃放置1h以上。取出离心15min,弃上清,用80%乙醇清洗沉淀。同样离心15min后除去乙醇,干燥沉淀。向沉淀中加入适量的TE Buffer(10~50 μL左右)充分搅拌溶解,得到凋亡细胞的片断化μDNA。得到的DNA样品的一部分,按样品:6×Loading buffer=5∶1的比例混合后(全量6~15 μL),进行琼脂糖凝胶电泳。
3 结果与分析
3.1 不同浓度TPS对MFC细胞形态的影响
由图1可以看出,a图为正常生长细胞,呈现拉网状的生长。b、c、d、e、f为加入TPS后 MFC细胞的情况,细胞数不同程度的减少,细胞形态发生改变,表现为胞浆皱缩,染色质浓聚,形成致密的染色质,特别是图e和图f的细胞,细胞体积缩小、成圆状,凋亡小体形成、细胞发生凋亡。随着浓度的增大细胞形态改变的越明显。

图1 24h不同TPS浓度下小鼠胃癌细胞的形态Fig.1 Cell morphology changes of MFC treated by different TPS concentration注:a、b、c、d、e、f TPS浓度分别为0、5、10、20、40、80μmol·L-1Note:a,b,c,d,e,f present the concentration of TPS 0,5,10,20,40,80μmol·L-1 respectively.
3.2 不同浓度TPS对小鼠胃癌细胞MFC的增殖抑制
不同浓度TPS作用于MFC,24、48、72h后用MTT法测定细胞生长,结果见表1、图2。
由表1可以看出,40μmol·L-1和80μmol·L-1在不同的时间段与对照组比较均差异极显著(p<0.01);10μmol·L-1和20μmol·L-1在不同的时间段与对照组相比均差异显著(p<0.05);5 μmol·L-1与对照组相比在各个时间段均差异不显著(p>0.05)。从24h开始,不同浓度TPS即对MFC细胞的增殖表现出不同程度的抑制作用,到72h最大抑制率达到53.06%。TPS对 MFC的抑制作用呈浓度依赖关系。当TPS浓度分别为20、40、80μmol·L-1抑制率分别为25.85%~34.96%,35.37%~41.67%,42.00%~53.06%。说明TPS对癌细胞有一定的抑制作用,抑制的效率随着TPS的浓度增加而增强。
3.3 不同浓度TPS对小鼠胃癌细胞MFC细胞凋亡DNA片段分析
TPS感染MFC细胞电泳图谱见图3。
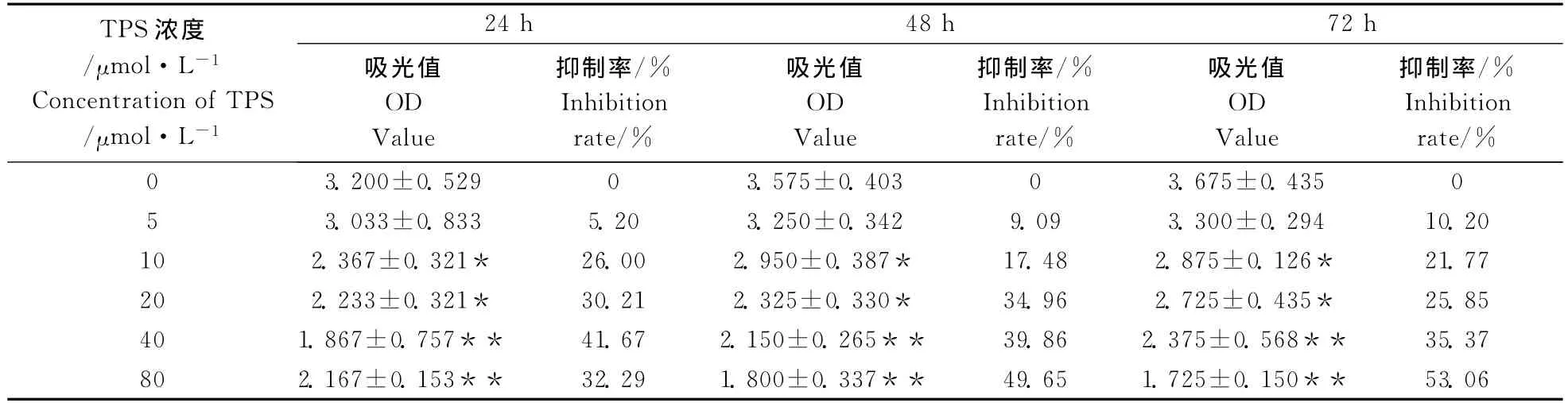
表1 不同浓度TPS对MFC细胞增殖抑制影响(X±SD)Table 1 The inhibitory rates of TPS of different concentrations on MFC(X±S)

图2 不同浓TPS对MFC细胞增殖抑制率Fig.2 The inhibitory rates of TPS of different concentrations on MFC

图3 TPS感染MFC细胞24h、48h、72h3个时间段的电泳图谱Fig.3 The electrophoretic results of TPS infect MFC cells in 24h,48hand 72hrespectively注:M 为 Marker(100bp);0(对照组)、5、10、20、40、80μmol·L-1分别为不同浓度的TPSNote:M is Marker(100bp);0,5,10,20,40,80μmol·L-1 mean the TPS concentration
由图3可以看出,24h、48h、72h3个时间段的对照组细胞无凋亡,不呈现DNA条带;TPS加入24h后的电泳DNA片段不明显,只在最大浓度80μmol·L-1处出现DNA片段;TPS加入48h、72h后的细胞DNA均出现细胞凋亡的典型梯状条带,且72h最明显。该电泳结果可初步说明MFC细胞凋亡受TPS的作用剂量和作用时间影响。作用的时间越长干预效果越强;在相同的时间段里呈剂量依赖性。说明TPS对癌细胞有一定的致死效用,作用的时间的越长,效果越明显,且呈现剂量依赖性。
4 结论与讨论
细胞凋亡(apoptosis),即程序性细胞死亡(programmed cell death,PCD),是指细胞在分化和发育过程中由基因调控而发生的主动的、自发性死亡方式,它与坏死有着本质的区别[16,20~23]。尽管凋亡是一种生理性细胞死亡,但它也能被各种病理因素所触发,任何可直接破坏细胞、导致细胞坏死的物质,均可诱发细胞的凋亡[17,20]。
通过对细胞形态的观察发现,加入不同浓度的TPS作用24h后细胞数量明显少于对照组,凋亡发生率升高,细胞失去贴壁的能力,细胞由不规则形逐渐变成圆形,胞浆皱缩,细胞体积缩小,凋亡小体生成,且浓度越高作用效果越明显。实验结果显示,当TPS浓度分别为20、40、80μmol·L-1抑制率分别为25.85%~34.96%,35.37%~41.67%,42.00%~53.06%。所以TPS能够抑制 MFC细胞增殖,且呈时间浓度依赖性;TPS能引起肿瘤细胞的凋亡,并且随着浓度的增加其凋亡作用就越明显。在48h和72h10、20、40、80μmol·L-1的TPS与对照组相比能显著提高细胞凋亡效果。通过本实验的研究结果还能看出,随着作用时间的延长其凋亡效果也随之上升,表现出一定的浓度依赖性。在以后的试验中,对其最大作用剂量和毒性进行研究,可能将其作为新的抗肿瘤药物得以开发和利用。
[1]帕提古丽·马合木提,高莉,史博,等.酸浆花萼色素的提取及理化性质研究[J].食品科学,2004,25(9):35-38.
[2]甄清,李静,李勇,等.锦灯笼宿萼提取物体外抗菌作用研究[J].天然产物研究与开发,2006,18(2):273-274.
[3]吴方晖,李文亮,边鸣镝.大孔吸附树脂纯化大豆皂甙的研究[J].河北农业科学,2007,12(6):87.
[4]王东冬,赵大云.大豆皂带的提取纯化与分离检测[D].上海:上海交通大学硕士学位论文,2007.
[5]李广,李浩波,刘璐,等.皂甙的生理活性及应用研究进展[J].中国农学通报,2003,9(6):3-6.
[6]Graham JG,Quinn ML,Fabricant S.Plants used against cancer——an extension of the work of Jonathan Hartwell[J].Journal of Ethnopharmacology,2000,73(3):347-377.
[7]Newman DJ,Cragg GM,Snader KM.The influence of natural products upon drug discovery[J].Natural Products Report,2000,17:215-234.
[8]Pezzuto JM.Plant-derived anticancer agents[J].Biochem Pharmacol,1997,53(2):121-133.
[9]Yun TK,Lee YS,Lee YH,et al.Anticarcinogenic effect of Panax ginseng C A Meyer and identification of active compounds[J].Journal of Korean Medical Sciences,2001,16:16-18.
[10]Liu WK,Xu SX,Che CT.Anti-proliferative effect of ginseng saponins on human prostate cancer cell line[J].Life Sciences,2000,67(11):1297-1306.
[11]Popovich DG,Kitts DD.Mechanistic studies on protopanaxadiol,Rh2,and ginseng(Panax quinyuefolius)extract induced cytotoxicity in intestinal Caco-2cells trite penoid compounds[J].J Korean Medical Sciences,2001,16:28-37.
[12]Kim HS,Lee EH,Ko SR,et al.Effects of ginsenosides Rg3and Rh2on the proliferation of prostate cancer cells[J].Archives Pharmacology Research,2004,27(4):429-435.
[13]杜德极,杨薇.葛根主要成分对体外癌细胞的毒活性[J].癌症,1997,16(3):165-167.
[14]徐长福,杨艳萍.绞股蓝总皂甙与阿霉素、5-氟尿嘧啶连用的抑瘤效果[J].西安医科大学学报,1996,17(2):170-174.
[15]梁朝晖.黄豆皂苷的提取和分离方法的初探[J].中国公共卫生,1999,15(11):1043-1044.
[16]杨纯正,王树滨.肿瘤化疗和细胞凋亡[J].中华血液学杂志,2000,21(6):285-286.
[17]赛燕,刘勇,朱明学,等.四肽AC-DEVD-CHO对硫芥诱导淋巴细胞凋亡的干预作用[J].第三军医大学学报,2003,25(14):1223-1226.
[18]朱永仁,刘志明.细胞凋亡的研究进展[J].贵州畜牧兽医,2008,32(1):25-27.
[19]刘伍梅,汪铭书,程安春.细胞凋亡检测技术研究进展[J].中国兽医科技,2004,34(11):45-49.
[20]刘芳,李雪梅,张平英,等.DNA Ladder和ELLSA合检测PRRSV诱导Marc 145细胞凋亡动态变化规律的研究[J].四川农业大学学报,2005,23(1):95-98.
[21]Yu G,Dyan Y,Fang G,et a1.Polysaccharides from fruit calyx of Physalis alkekengi L.var.franchetii:isolation,purification,structural features and antioxidant activities[J].Carbohyd Polym.2009,77(2):188-193.
[22]Lin Liu,Yuesheng Dong,Zhilong Xiu.Three-liquid-phase extraction of diosgenin and steroidal saponins from fermentation of Dioscorea zingibernsis C.H.Wright[J].Process Biochemistry,2010,45(5):752-756.
[23]Liu W M,Wang M S,Cheng A C.Progress in the detection methods of apoptosis[J].Chinese Journal of Veterinary Science and Technology,2004,34(11):45-49.
