缺血预适应对失血性休克大鼠的保护作用研究
2012-04-15杨光明刘良明
徐 竞,蓝 丹,李 涛,杨光明,刘良明
严重创伤/休克失代偿期常出现血管低反应性(全身血管对缩血管物质和舒血管物质的反应降低或不反应),是血压不能有效提升、组织灌注不良,细胞缺氧和损伤加重,最终导致多器官功能障碍(MODS)和多器官功能衰竭(MOF)的重要原因[1-2]。本实验前期研究发现,休克后血管低反应性的发生与血管平滑肌细胞钙失敏有关[3];缺血预适应(5%失血量休克前30min预处理)可通过增高血管钙敏感性诱导对失血性休克血管反应性的保护效应[4]。然而,在休克动物,缺血预适应能否通过恢复血管反应性和钙敏感性,改善血流动力学,维持重要器官血流灌注和线粒体功能,从而对失血性休克大鼠起到保护作用,目前原理尚不清楚。
因此,本实验采用失血性休克大鼠模型,观察缺血预适应对休克复苏大鼠存活时间、血管反应性和钙敏感性、血流动力学指标、肝肾重要器官的血流灌注和线粒体功能的影响,以阐明缺血预适应对失血性休克大鼠的保护作用。
材料与方法
1 实验分组和大鼠处理
清洁级Wistar大鼠60只,雌雄各半,体重200~230g,戊巴比妥钠腹腔注射麻醉,分作两部分实验:(1)取40只大鼠,观察存活率及测定血管反应性、钙敏感性,随机分为4组,每组10只。分为正常对照组、休克组(40mmHg休克2h,不复苏)、乳酸格林液(LR)复苏组(休克后用2倍失血量LR复苏)、缺血预适应组(5%失血量休克前30min预处理,再进行失血性休克和2倍失血量LR复苏)。右侧股动脉插管接血压计,右侧股静脉插管进行复苏。(2)取20只大鼠,测定血流动力学指标及肝肾血流量、线粒体功能,随机分为2组,每组10只。分为LR复苏组(休克后用2倍失血量LR复苏)、缺血预适应组(5%失血量休克前30min预处理,再进行失血性休克和2倍失血量LR复苏)。右侧股动脉插管接血压计,右侧股静脉插管进行复苏,右颈总动脉插管至左心室,连接血流动力学测定仪(Power Lab,Australia)。
2 存活率观察
复苏完成后,结扎股动静脉,缝合伤口,按照10万U/kg体重的剂量肌肉注射青霉素和链霉素,给予正常饮水和食物,观察1d内大鼠存活情况,计算24h内的存活率和存活时间(存活时间>24h的按照24h计算)。
3 血管反应性和钙敏感性测定
复苏完成2h后,活杀大鼠取肠系膜上动脉(superior mesenteric artery,SMA)一级分支,制成约2.5 mm长的微血管环,将其固定在微血管肌动描记仪上,浸入Krebs-Henseleit(K-H)液中平衡微血管环,直至张力曲线趋于水平。累积浓度法检测微血管环对梯度浓度去甲肾上腺素(NE)的收缩反应性;将K-H液换成髙钾液,累积浓度法检测微血管环对梯度浓度Ca2+的收缩反应性。作量-效曲线,曲线拟合法求最大收缩力(Emax),用NE和Ca2+的量-效曲线、Emax评价血管反应性和钙敏感性[5]。
4 血流动力学指标观察
在休克前、休克末、复苏0h、复苏1h、复苏2h时间点,通过右颈总动脉连接血流动力学测定仪测定血流动力学指标,包括左室收缩压(left intraventricular systolic pressure,LVSP),左室舒张末压(left ventricular end-diastolic pressure,LVEDP),左室压最大上升/下降速率(maximal change rate of left intraventricular pressure,±dp/dtmax),心 率(heart rate,HR)[6]。通过静脉插管推注NE(3μg/kg),记录给NE前后大鼠平均动脉压(MAP)值,其差值即为NE作用后MAP变化,即NE升压效应[7]。
5 肝、肾血流量检测
在休克前、休克末、复苏0h、复苏2h时间点,用激光多谱勒组织血流量测定仪(Periflux system 5000;Perimed,Stockholm,Sweden)的激光探针刺入肝、肾组织下约0.5cm,测定器官血流量。
6 肝、肾线粒体功能检测
呼吸控制率(respiration control ratio,RCR)测定:在休克前、休克末、复苏0h、复苏2h时间点,提取肝和肾线粒体,采用溶氧仪(MT 200;Strathkelvin,North Lanarkshire,Scotland)测定有二磷酸腺苷(ADP)刺激(3态呼吸)和无ADP刺激(4态呼吸)下的氧气消耗量(nmol/min/mg蛋白),呼吸控制率=呼吸3态/呼吸4态[6]。
Na+-K+-三磷酸腺苷(ATP)酶活性(μmol/g)测定:采用Na+-K+-ATP酶ELISA试剂盒(R&D Systems,Minneapolis,MN)测定。
7 统计学处理
结 果
1 大鼠存活时间变化
正常对照组的所有大鼠存活均>24h,休克组的所有大鼠均未能存活到24h,平均存活时间为1.75h;LR复苏组有5只大鼠存活>24h,平均存活时间为14.90h;缺血预适应组延长大鼠的平均存活时间延长显著,可达20.50h(P<0.01),8只大鼠存活>24h(图1)。
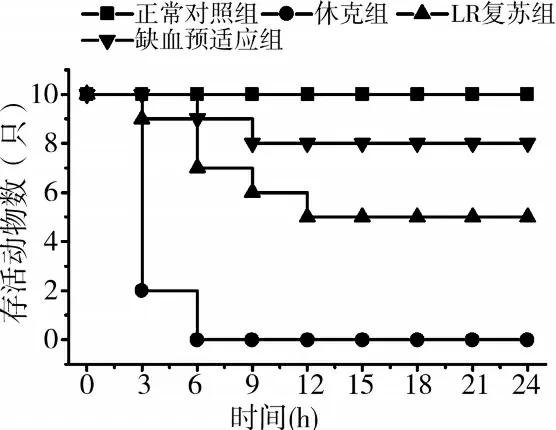
图1 缺血预适应延长失血性休克复苏大鼠存活时间(n=10)
2 血管反应性和钙敏感性变化
失血性休克后血管反应性和钙敏感性显著降低,NE和Ca2+的Emax降低至正常对照组的40.84%和54.57%,LR复苏组血管反应性和钙敏感性部分恢复,NE和Ca2+的Emax增高至正常对照组的59.45%和63.20%(P<0.01);缺血预适应组血管反应性和钙敏感性显著增高,使NE和Ca2+的Emax增高至正常对照组的85.07%和80.90%(P<0.01)(图2)。
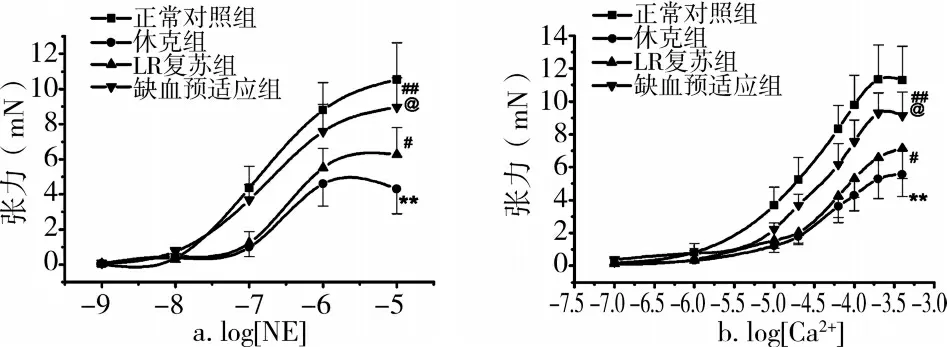
图2 缺血预适应对失血性休克大鼠血管反应性(a)和钙敏感性(b)的保护作用(n=10)
3 血流动力学的变化
失血性休克后,大鼠血流动力学指标MAP、LVSP、LVEDP、+dp/dtmax、-dp/dtmax和HR显著降低至正常对照组的31.61%、45.18%、37.41%、38.05%、28.83%和62.27%(P<0.01),LR复苏组血流动力学指标部分恢复,上升至正常对照组的50.73%、67.10%、45.10%、49.41%、37.76%和76.39%(P<0.01),缺血预适应组血流动力学指标显著恢复,接近正常水平(至正常对照组的74.59%、82.34%、76.04%、83.38%、78.94%和83.06%,P<0.01)。失血性休克后,NE的升压效应显著降低,血压由正常的29.36mmHg降低至11.70mmHg(P<0.01),LR复苏组可部分恢复NE的升压效应至20.89mmHg,缺血预适应组可进一步恢复NE的升压效应至接近正常水平(28.85mmHg,P<0.01,表1)。
4 肝、肾血流量的变化
失血性休克后肝、肾的血流量显著降低至正常对照组的44.17%和37.46%;LR复苏组血流量有显著回升,至正常对照组的75.70%和70.93%(P<0.01);缺血预适应组血流量进一步回升,至正常对照的96.63%和95.73%(P<0.01,表2)。
5 肝、肾线粒体功能的变化
失血性休克后,肝和肾的线粒体功能显著降低,表现为RCR和Na+-K+-ATP酶活性的降低,LR复苏组其功能显著恢复,缺血预适应组肝和肾的RCR分别较LR复苏组增高30.72%和28.66%(P<0.01),Na+-K+-ATP酶活性分别较LR组增高65.11%和72.18%(P<0.01,表2)。
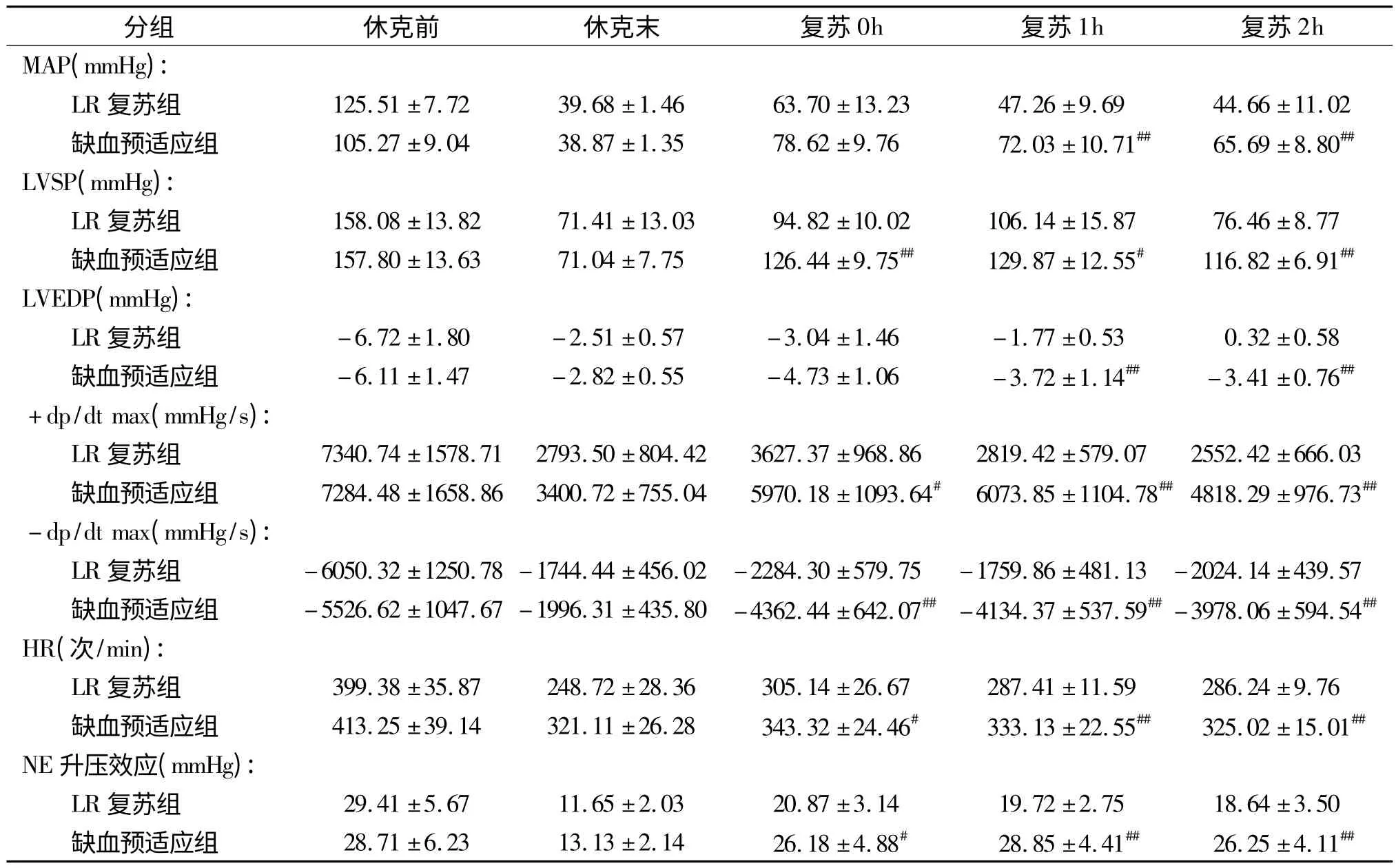
表1 缺血预适应改善失血性休克大鼠血流动力学指标(n=10)
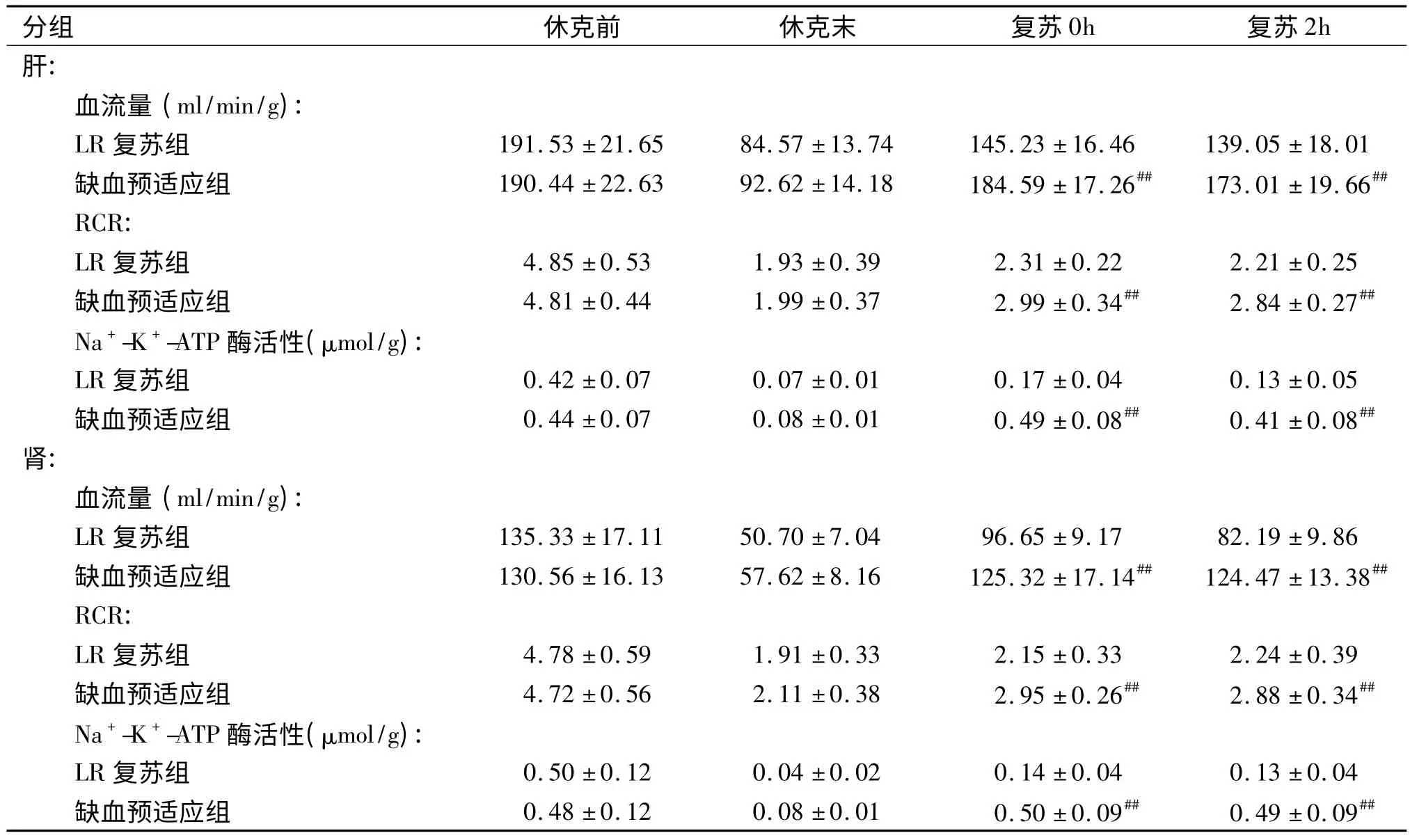
表2 缺血预适应增加失血性休克大鼠肝和肾血流量,改善线粒体功能(n=10)
讨 论
严重创伤/休克后的血管低反应性是导致休克晚期微循环功能障碍、组织细胞缺血缺氧的重要原因[1-3],然而目前却没有很好的方法可以有效地纠正血管低反应性。缺血预适应是目前常用的诱导内源性保护的方法,可在心脏、脑、肝、视网膜等多种器官诱导对抗缺血缺氧的保护作用[8-9],并能通过增高血管钙敏感性诱导对失血性休克血管反应性的保护效应[4]。但缺血预适应能否诱导对失血性休克的保护效应,尚未见文献报道。
本实验结果发现,缺血预适应可显著延长失血性休克复苏大鼠存活时间,恢复血管对NE和Ca2+的收缩反应性,改善血流动力学指标MAP、LVSP、LVEDP、+dp/dtmax、-dp/dtmax、HR和NE升压效应,增加肝和肾的血流量、线粒体RCR和Na+-K+-ATP酶活性,提示缺血预适应通过恢复血管反应性和钙敏感性,改善血流动力学,维持重要器官血流灌注和线粒体功能,从而延长失血性休克复苏大鼠的存活时间,起到对失血性休克的保护作用。
尽管在临床已存在缺血和休克的患者中,预适应保护的应用尚有很大局限,然而对于那些即将出现大量失血如接受大型手术的患者,仍有重要的保护意义。例如,在冠状动脉搭桥手术中,虽然术中采取了多种保护措施,但仍经常出现术后左室功能损伤,在急性冠状动脉综合征的高风险人群,死亡率可高达3.7%,术中梗死率约10%[10]。缺血预适应可发挥很好的保护作用,如86名冠脉搭桥手术患者,缺血预适应可降低术中,以及术后24h室性心律不齐的发生率[11]。本实验的研究发现为将缺血预适应用于改善血流动力学,维持重要器官血流灌注和线粒体功能,增强失血性休克复苏效果提供了理论基础。然而,此实验局限在啮齿类动物,缺血预适应能否在其它种属的动物甚至灵长类动物诱导对失血性休克的保护,仍需要进一步研究。
[1]江其生,胡德耀,肖南,等.失血性休克大鼠血管平滑肌收缩功能变化研究[J].中国病理生理杂志,2002,18(11):1425-1426.
[2]Liu LM,Dubick AM.Hemorrhagic shock induced vascular hyporeactivity of different vasculatures in rats:role of nitric oxide and endothelin[J].Shock,2003,19(3):208-214.
[3]Xu J,Liu LM.The role of calcium desensitization in vascular hyporeactivity and its regulation following hemorrhagic shock[J].Shock,2005,23(6):576-581.
[4]徐竞,杨光明,李涛,等.缺血预适应诱导的失血性休克大鼠血管反应性和钙敏感性保护作用及其与PKCα、PKCε的关系[J].第三军医大学学报,2010,32(17):1807-1811.
[5]Xu J,Yang GM,Li T,et al.Involvement of CPI-17 and ZIPK in the regulation of PKCα,on vascular calcium sensitivity following hemorrhagic shock[J].Shock,2010,33(1):49-55.
[6]Fang Y,Li T,Fan X,et al.Beneficial effects of activation of PKC on hemorrhagic shock in rats[J].J Trauma,2010,68(4):865-873.
[7]Yang GM,Liu LM,Xu J,et al.Effect of arginine vasopressin on vascular reactivity and calcium sensitivity after hemorrhagic shock in rats and its relationship to Rho-kinase[J].J Trauma,2006,61(6):1336-1342.
[8]James MD,Amanda MD,Michael VC.Signaling pathways in ischemic preconditioning[J].Heart Fail Rev,2007,12(3-4):181-188.
[9]Zaugg M,Lucchinetti E,Uecker M,et al.Anaesthetics and cardiac preconditioning.Part I.Signalling and cytoprotective mechanisms[J].Br J Anaesth,2003,91(4):551-565.
[10]Yellon DM,Dana A.The preconditioning phenomenon:a tool for the scientist or a clinical reality[J].Circ Res,2000,87(7):543-550.
[11]Wu ZK,Livainen T,Pehkonen E,et al.Ischemic preconditioning suppresses ventricular tachyarrhythmias after myocaidial revascularization[J].Circulation,2002,106(24):3091-3096.
