旋转反应器胶原支架的制备及复合软骨细胞修复骨软骨损伤的初步研究
2012-04-13孙晶綦惠陶剑锋杰永生陈磊程晓光孙磊
孙晶,綦惠,陶剑锋,杰永生,陈磊,程晓光,孙磊
·论著·
旋转反应器胶原支架的制备及复合软骨细胞修复骨软骨损伤的初步研究
孙晶,綦惠,陶剑锋,杰永生,陈磊,程晓光,孙磊
目的以胶原为原料开发一种小型胶原支架材料,尝试是否适合旋转反应器来复合软骨细胞,并探讨复合细胞后修复软骨损伤的效果。
胶原; 支架(骨科); 生物相容性材料;细胞培养技术
www.cmbp.net.cn 中国医药生物技术, 2012, 7(4):257-262
鉴于软骨细胞和软骨组织的特殊性,关节软骨的修复问题是当前临床面临的一大挑战,传统修复方法形成的新生组织主要是纤维软骨,不具有正常透明软骨的机械特性。应用组织工程学的方法进行软骨修复是目前的一大进步[1-5]。获取种子细胞(软骨细胞或某种干细胞),将种子细胞接种到可降解的支架材料上,构建成细胞-材料复合物,用于软骨组织的缺损修复[4-6]。因此,支架材料的选择和制备是应用组织工程学方法修复软骨损伤的重要环节。
胶原作为细胞生长的依附和支持物能诱导细胞增殖、分化和移行,与创伤愈合过程关系密切。胶原的水溶液经冷冻干燥后可制得胶原膜,可广泛用于皮肤创伤和烧伤的修复、牙周引导膜、皮肤缺陷、骨缺损的修复、神经及血管的修复、药物缓释系统、基因传递载体、整形美容、止血、伤口敷料等[7-10]。多孔胶原膜是组织工程常用的支架材料。由于软骨再生修复能力有限,本研究应用多孔胶原膜作为软骨修复的支架材料,采用旋转培养的体系,有利于细胞在培养过程中的物质交换,促进软骨细胞贴附以及后期软骨的修复。
1 材料与方法
1.1 材料
1.1.1主要试剂 DMEM/F-12 培养基购自美国Hyclone 公司;四甲基偶氮唑盐(MTT)购自韩国Biosharp 公司;胃蛋白酶、II 型胶原酶、胰蛋白酶是美国 Sigma 公司产品;乙酸、戊二醛等为国产分析纯试剂;透析袋和培养板分别来自生工生物工程(上海)股份有限公司和美国 Corning 公司。
1.1.2仪器 细胞培养箱是美国 Thermal 公司的产品;倒置相差显微镜购自日本 Olympus 公司;低温高速离心机购自美国 Sigma 公司;真空冷冻干燥机是美国 Virtis 公司产品;酶标仪购自美国Bio-Rad 公司。
1.1.3实验动物 SPF 级成年 SD 雄性大鼠,体重 250 ~ 300 g,由北京积水潭医院动物室提供,许可证号 SCXK(京)2011-0006;清洁级成年新西兰大白兔,雌雄不限,体重 2 ~ 2.5 kg,由北京积水潭医院动物室提供,许可证号 SCXK(京)2011-0003。
1.2 方法
1.2.1胶原提取 取新鲜成年猪跟腱,去除肌膜与筋膜,生理盐水反复冲洗数次;置入烤箱 35 ℃,12 h 烘干至透明;将跟腱用粉碎机粉碎至棉絮状;置入 0.5 mol/L 乙酸中,并加入胃蛋白酶消化,置4 ℃ 冰箱 96 h,在此期间每天定时摇振数次;去除乙酸胶原溶液外的其他杂质,于 4 ℃,离心半径10 cm,8 000 r/min 离心 20 min,取上清液;将上清液放置在磁力搅拌器中并加入 NaCl(质量浓度5%)盐析 24 h;4 ℃,12 000 r/min,20 min 离心取沉淀;将沉淀物放置在磁力搅拌器中再次溶解于0.5 mol/L 乙酸中。重复上述盐析步骤,反复盐析、溶解 3 次后,将乙酸-胶原溶液装入透析带,用0.01 mol/L,pH 7.4 PBS 缓冲液透析 24 h,重复3 次,更换蒸馏水透析 24 h,重复 3 次,至蒸馏水透析液中无 Na+为止。
1.2.2胶原支架的制备 制备 5 cm × 5 cm × 0.5 cm 的铝制载体模具,对其表面进行抗酸、抗氧化涂层处理;取透析后的胶原溶液,离心半径 10 cm,8 000 r/min 离心 20 min 取沉淀,加入 0.5 mol/L乙酸中,充分使之溶解;胶原液倒入模具内,铺成1 mm 厚的薄层,–80 ℃ 深低温冰箱中,预冻 1 h;将预冻后的胶原模板快速转入程序冷冻干燥机中,按照预先设定好的冻干程序,进行冷冻干燥 14 h。即成为 1 mm 厚的胶原载体材料,将胶原膜切成1 mm3的块状胶原支架材料。常规剂量60Co 辐照消毒备用。
1.2.3胶原支架细胞毒性、生物相容性和降解性的检测 复苏 L929 细胞,胰酶传代至第 3 代。将材料浸提液 2 倍稀释,阳性对照为 64 g/L 苯酚,阴性对照为细胞培养液。细胞贴壁 1、3、6 d 后(即第 2 天、第 4 天、第 7 天测值),将阳性对照、阴性对照和材料浸提液各加 100 μl,MTT 20 μl,37 ℃ 孵育 4 h,弃上清。每孔加 DMSO 150 μl,振荡 10 min。酶标仪上,490 nm 波长下测吸光值,取平均值。将胶原支架植入大鼠股部肌肉中,1、3、5 周后取材,组织切片观察胶原的生物相容性和降解情况。
1.2.4旋转培养 载体经60Co 辐照消毒后,放置胎牛血清中 30 min。从胎牛血清中取出载体,超净台中 24 h 无菌风干。将载体与 106个/ml 浓度的软骨细胞在含 10% 胎牛血清的 DMEM 中共同培养 24 h 后,将载体与细胞放置旋转培养腔中,旋转培养 14 d,每 3 天半换液一次。
1.2.5软骨损伤动物模型制备 新西兰大白兔仰卧于手术台上,四肢固定,耳缘静脉注射0.1% 的戊巴比妥钠(40 mg/kg)麻醉,膝外侧切口,股骨外侧髁关节面取软骨,关节平面做直径 3 mm 的圆形缺损,纵向钻入 3 mm,深达骨髓腔,造成关节骨软骨损伤模型。将14 只新西兰大白兔随机分为2 组,支架组(n = 8):兔膝关节软骨缺损区植入到旋转细胞培养系统(rotary cell culture system,RCCS)中复合软骨细胞的胶原支架;空白对照组(n = 6):不进行任何植入处理。实验过程中对动物的处置符合 2006 年科技部颁布的《关于善待实验动物的指导性意见》[11]。
2 结果
2.1 胶原膜制备情况
乙酸处理胶原溶液之后溶液呈浑浊状态,应用透析袋将液体进行透析去除 Na+和其他杂质之后,获得黏稠的胶原凝胶。冷冻干燥之后的胶原膜呈白色,表面光滑,肉眼观察表面空隙均匀(图 1)。手工切成边长为 1 mm 小块,形成载体后,体视显微镜下观察成海绵状多孔结构(图 2)。

图1 制备的胶原膜Figure 1 Collagen film

图2 自制的 RCCS 载体(体视显微镜 × 40)Figure 2 RCCS scaffold (stereomicroscope × 40)
2.2 旋转培养
软骨细胞与支架旋转培养 24 h 后有部分细胞与载体相复合,细胞的形态为球形(图 3A);48 h后大量细胞与载体相复合,细胞之间相互贴附(图3B),14 d 后在旋转腔中载体与细胞相互粘接,载体中细胞形成团块(图 3C)。

图3 倒置相差显微镜(× 200)观察软骨细胞与支架旋转培养(A:24 h;B:48 h;C:14 d)Figure 3 Observation of culturing condrocytes with collagen scaffold by inverted phase contrast microscope × 200 (A: 24 h; B: 48 h; C: 14 d)
2.3 生物相容性和降解性的检测
载体植入大鼠肌肉,HE 染色显示 1 周、3 周时,材料周围有一定的炎细胞浸润,5 周后材料周围的炎症反应逐渐消失,但降解达 60% 左右(图 4)。

图4 载体的组织相容性检测(HE 染色,× 100)(A:植入大鼠皮下 1 周;B:植入大鼠皮下 3 周;C:植入大鼠皮下5 周)Figure 4 Histocompatibility of the scaffold (Hematoxylin-eosin staining, × 100) (A: Implanted into the skin of rat for 1 week; B: Implanted into the skin of rat for 3 weeks; C: Implanted into the skin of rat for 5 weeks)
2.4 细胞毒性检测
材料浸提液与 L929 细胞作用后,细胞活性与阴性对照相比没有显著差异(表 1)。按照公式:[(OD浸提液-OD阳性对照)/(OD阴性对照-OD阳性对照)] × 100%,数值 ≥ 100%,为 0 级,证明没有任何细胞毒性;数值在 75% ~ 100% 之间,为 1 级,极低细胞毒性;数值在 50% ~ 75% 之间,为 2 级,低细胞毒性;小于 50% 出现一次,即证实有细胞毒性。经计算,数值 ≥ 100%,因此,用本方法制备的载体无细胞毒性。

表1 MTT 法检测细胞毒性(吸光度值)Table 1 Determination of cytotoxicity by MTT assay (x±s)
2.5 动物模型体内植入
胶原支架复合软骨细胞植入后 4 周,可见缺损处少量软骨细胞出现(图 5A),对照组仅见少量纤维组织(图 6A);12 周,胶原支架复合软骨细胞植入组(图 5B)可见缺损底部的软骨细胞,软骨下形成骨组织,软骨缺损接近修复。对照组(图6B)仅为纤维组织生成,靠下方的组织逐渐形成骨组织,但软骨缺损处依然为明显凹陷状。

图5 胶原支架复合软骨细胞植入动物模型(A:植入 4周;B:植入 12 周)Figure 5 Cartilage defects implanted with carrier and chondrocytes (A: 4 weeks after operation; B: 12 weeks after operation)
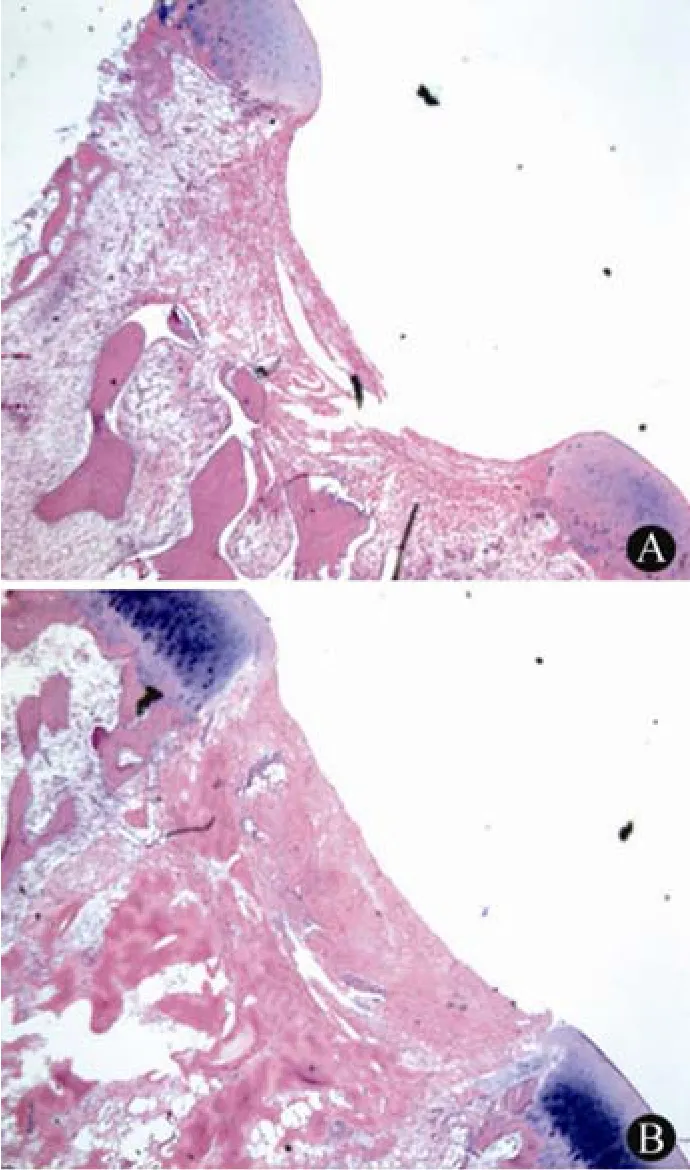
图6 对照组软骨修复情况(A:术后 4 周;B:术后 12 周)Figure 6 Cartilage defects without implantation (A: 4 weeks after operation; B: 12 weeks after operation)
3 讨论
软骨损伤修复一直以来都是组织工程研究的热点问题。近年来,用细胞外基质支架修复软骨损伤的技术得到了迅速发展。但由于软骨细胞在传代扩增时,容易丧失表型[12-13]。有报道证明,旋转培养系统,可以较好地维持细胞的表型[14]。我们设想,如果利用旋转培养系统有利于维持细胞表型的特点,开发一种适宜旋转培养的系统的载体,该载体在旋转培养系统中可以良好地贴附软骨细胞,又能弥补传统旋转反应器微球载体不利于手术操作的特点,可为组织工程技术修复软骨损伤提供一个新的思路。
旋转细胞培养系统(RCCS)[14-16]可以模拟太空中的微重力环境,在 RCCS 模拟的微重力环境中,细胞克服重力影响,易于聚集,能够获得比普通重力环境中更高的细胞培养密度。而且,微重力环境也可以使细胞克服重力影响,更易于贴附在载体表面。细胞在模拟微重力环境中有一定程度的三维空间自由,有利于细胞-细胞、细胞-基质之间按照组织学特征相互接触,有利于细胞的增殖和分化。正常成人关节软骨主要由 II 型胶原和蛋白多糖组成的基质包绕着软骨细胞。软骨细胞的形态和基质的产生受复杂的环境因素影响。在体外常规单层软骨细胞培养过程中,二维的环境和坚硬的基质会改变基因表达和阻止分化,导致细胞扩增数量有限及去分化等现象。用 RCCS 进行人软骨细胞载体的体外培养,整个培养容器由电机驱动沿水平轴旋转,培养基以及细胞颗粒随容器一起旋转,细胞与营养物质易于均质分布,显著改善体外培养的营养交换,有利于维持软骨细胞的表型和功能[16]。
胶原是脊椎动物的主要结构蛋白,大量存在于动物的皮肤、骨、肌腱和其他结缔组织中。胶原具有组织同源性和生物可降解性、免疫原性低、生物相容性好等特点,作为细胞生长的依附和支持物能诱导细胞增殖、分化和移行,在生物医学领域中有着广泛的应用[7-10],是组织工程、药物控释、创伤修复等领域研究的热点。我们采用胶原作为原料,制备成 1 mm3的载体,在 RCCS 中,观察软骨细胞对该载体的贴附情况。结果显示,软骨细胞对该载体有良好的贴附效果。
胶原载体本身又能够为贴壁依赖性细胞体外生长提供更大的表面积。这些细胞培养微环境的变化,提供了细胞聚集、快速三维生长和分化的条件。在本研究中,胶原载体作为支架与软骨细胞复合进行旋转培养时,24 h 后有部分细胞与载体相复合,48 h 细胞与载体贴附良好,细胞明显增殖,96 h 在旋转腔中出现块状物体,将其吸出显微镜下观察,为载体与细胞的混合物共生长。证实,在 RCCS 系统中,胶原载体可以使软骨细胞贴附、伸展、增殖。利用 RCCS 系统以及胶原载体复合培养技术有利于细胞的大规模扩增。
为检测载体的生物相容性情况,我们首先对载体进行细胞毒性的检测,该载体的细胞毒性结果可以满足细胞载体的要求。本研究还将载体植入大鼠股部肌肉中,1、3、5 周后取材,均未见到明显的炎症反应。同时也观察到,5 周后支架有明显的降解。我们分析可能是没有进行交联导致了材料过快地降解[17-19]。具有适合的生物降解性是组织工程载体的一个重要特性之一,但是,如何使材料在完全发挥其修复损伤的同时达到降解,目前仍值得进一步研究。
本实验在动物模型的构建上,钻孔直径 3 mm,突破软骨下骨,对于兔股骨外侧髁已是巨大缺损,观察孔内壁有渗血,能够确保移植后营养供应。之后植入在 RCCS 中复合了软骨细胞的胶原支架。结果显示术后 4 周即有少量软骨组织在关节损伤处形成;12 周后,软骨细胞数量和排布逐渐接近周围正常的软骨组织。我们认为,本实验将软骨细胞与胶原支架在 RCCS 中复合,软骨细胞可以在旋转培养系统中与支架良好的结合,同时,细胞表型的良好维持,对软骨缺损的修复也是有力的因素。
构建动物模型并植入体内,材料不仅受到各种器官组织的动态作用,还处于代谢、吸收、酶催化反应之中,软骨细胞或骨髓来源的间充质干细胞在支架材料上不一定能够维持其表型和功能,因此,在之后的试验中我们将继续探讨软骨细胞或间充质干细胞在胶原支架上复合之后植入动物软骨缺损处的修复软骨缺损的效果,并进一步研究如何维持软骨细胞的表型和功能。另一方面的原因可能在于 12 周的时间并不能使深达 3 mm 的缺损完全修复,如果时间允许,我们还将探讨 24 周以后及更长的时间周期中软骨缺损修复的效果。
[1] Schindler OS. Current concepts of articular cartilage repair. Acta Orthop Belg, 2011, 77(6):709-726.
[2] Simon TM, Jackson DW. Articular cartilage: injury pathways and treatment options. Sports Med Arthrosc, 2006, 14(3):146-154.
[3] Panseri S, Russo A, Cunha C, et al. Osteochondral tissue engineering approaches for articular cartilage and subchondral bone regeneration. Knee Surg Sports Traumatol Arthrosc, 2012, 20(6):1182-1191.
[4] Zhang L, Hu J, Athanasiou KA. The role of tissue engineering in articular cartilage repair and regeneration. Crit Rev Biomed Eng, 2009, 37(1-2):1-57.
[5] Moreira-Teixeira LS, Georgi N, Leijten J, et al. Cartilage tissue engineering. Endocr Dev, 2011, 21:102-115.
[6] Cui W, Wang Q, Chen G, et al. Repair of articular cartilage defects with tissue-engineered osteochondral composites in pigs. J Biosci Bioeng, 2011, 111(4):493-500.
[7] Mafi P, Hindocha S, Mafi R, et al. Evaluation of biological protein-based collagen scaffolds in cartilage and musculoskeletal tissue engineering- A systematic Review of the Literature. Curr Stem Cell Res Ther, 2012.
[8] Mullen LM, Best SM, Brooks RA, et al. Binding and release characteristics of insulin-like growth factor-1 from a collagen-glycosaminoglycan scaffold. Tissue Eng Part C Methods, 2010, 16(6):1439-1448.
[9] Xu CC, Chan RW, Weinberger DG, et al. Controlled release of hepatocyte growth factor from a bovine acellular scaffold for vocal fold reconstruction. J Biomed Mater Res A, 2010, 93(4):1335-1347.
[10] Tchemtchoua VT, Atanasova G, Aqil A, et al. Development of a chitosan nanofibrillar scaffold for skin repair and regeneration. Biomacromolecules, 2011, 12(9):3194-3204.
[11] The Ministry of Science and Technology of the People’s Republic of China. Guidance suggestion of caring laboratory animals. 2006-09-30. (in Chinese)中华人民共和国科学技术部. 关于善待实验动物的指导性意见. 2006-09-30.
[12] Kerkhofs J, Roberts SJ, Luyten FP, et al. Relating the chondrocyte gene network to growth plate morphology: from genes to phenotype. PLoS One, 2012, 7(4):e34729.
[13] García Cruz DM, Salmerón-Sánchez M, Gómez-Ribelles JL. Stirred flow bioreactor modulates chondrocyte growth and extracellular matrix biosynthesis in chitosan scaffolds. J Biomed Mater Res A, 2012.
[14] Hwang YS, Cho J, Tay F, et al. The use of murine embryonic stem cells, alginate encapsulation, and rotary microgravity bioreactor in bone tissue engineering. Biomaterials, 2009, 30(4):499-507.
[15] Unsworth BR, Lelkes PL. Growing tissues in microgravity. Nat Med, 1998, 4(8):901-907.
[16] Hidaka M, Su GN, Chen JK, et al. Transplantation of engineered bone tissue using a rotary three-dimensional culture system. In Vitro Cell Dev Biol Anim, 2007, 43(2):49-58.
[17] Yu B, Yu D, Cao L, et al. Simulated microgravity using a rotary cell culture system promotes chondrogenesis of human adipose-derived mesenchymal stem cells via the p38 MAPK pathway. Biochem Biophys Res Commun, 2011, 414(2):412-418.
[18] Vinatier C, Mrugala D, Jorgensen C, et al. Cartilage engineering: a crucial combination of cells, biomaterials and biofactors. Trends Biotechnol, 2009, 27(5):307-314.
[19] Jin CZ, Choi BH, Park SR, et al. Cartilage engineering using cell-derived extracellular matrix scaffold in vitro. J Biomed Mater Res A, 2010, 92(4):1567-1577.
Preparation of collagen scaffold for rotary cell culture system and effect on repairing cartilage damages of it with adhension of chondrocytes
SUN Jing, QI Hui, TAO Jian-feng, JIE Yong-sheng, CHEN Lei, CHENG Xiao-guang, SUN Lei
ObjectiveRepair of focal articular cartilage injury may be solved by tissue engineering. The preparation of proper scaffold is one of the most important problems to be solved. The aim of the study was to construct a kind of collagen scaffold, co-culture with L929 cells in rotary cell culture system, and implant into animal models with cartilage damage.MethodsCollagen scaffold was prepared from achilles tendon of pigs. Collagen scaffold was cut into small pieces with the size of 1 mm3and co-cultured with L929 cells in rotary cell culture system, and the cytotoxicity and biocompatibility were tested. Rabbit articular cartilage damage models were prepared and divided into 2 groups: the experimental group treated by scaffold with chondrocytes (n = 8) and control group (n = 6) without treatment. After 4 or 12 weeks, the specimens were extracted after surgery. The effects on repairing cartilage injury were examined with haematoxylin and erosin staining.ResultsThe collagen scaffold exhibited good biocompatibilities, and had no cell toxicity. It was proper to co-culture with chondrocytes in rotary cell culture system. The collagen scaffold with adhension of chondrocytes showed effect of repairing cartilage damage, but still could not completely reconstruct the damage.ConclusionThe collagen scaffold with adhension of chondrocytes can repair cartilage damage in a short period, but it shows less potent effect in a long period, which may be correlated with the rapid degradation of the scaffold. The method of collagen scaffold preparation should be improved in our future work.
Collagen; Braces; Biocompatible materials; Cell culture techniques
SUN Lei, Email: dr_sunlei@263.net
10.3969/cmba.j.issn.1673-713X.2012.04.002
100035 北京积水潭医院放射科(孙晶、程晓光);100035 北京市创伤骨科研究所(綦惠、陶剑锋、杰永生、陈磊、孙磊)
孙磊,Email:dr_sunlei@263.net
2012-06-06
方法成年猪跟腱中提取胶原,制备胶原支架,进行细胞毒性检测和生物相容性分析。将其切成 1 mm3小块,置于旋转培养器中与软骨细胞共培养,倒置相差显微镜观察细胞贴附效果。建立兔关节软骨缺损模型,编号后,将 14 只新西兰大白兔随机分为 2 组:支架材料组(n = 8),兔膝关节软骨缺损区植入胶原支架材料和软骨细胞;空白对照组(n = 6),不进行任何植入处理。进行 HE 染色后观察。
结果胶原支架呈瓷白色,表面空隙均匀,无细胞毒性,生物相容性良好,但在体内降解较快。在旋转反应器中,支架可以与软骨细胞良好结合。胶原支架植入动物体内 12 周,虽未完全修复缺损,但已有少量软骨细胞在缺损处出现,修复效果优于对照组。
结论制备的胶原支架复合软骨细胞短期内有一定的修复软骨缺损的能力,长期效果欠佳,可能与胶原支架在体内过快降解有关,尚需对制备方法进行改进。
Author Affiliations:Department of Radiodiagnosis, Beijing Jishuitan Hospital, Beijing 100035, China (SUN Jing, CHENG Xiao-guang); Beijing Institute of Traumatology and Orthopaedics, Beijing 100035, China (QI Hui, TAO Jian-feng, JIE Yong-sheng, CHEN Lei, SUN Lei)
www.cmbp.net.cn Chin Med Biotechnol, 2012, 7(4):257-262
