黑暗条件下普通小球藻处理废水的研究
2012-03-15余云龙
余云龙,邹 华,张 强,郝 女
(江南大学 环境与土木工程学院,江苏 无锡 214122)
微藻在无光照的情况下可以利用有机碳源进行异养生长[1]的能力可以被用来达到处理废水的目的。有研究表明,异养培养小球藻的生物量远大于自养时的生物量,异养培养的小球藻的比生长速率是自养时的2.13倍[2]。与传统污水处理方法相比,利用藻类处理污水可以克服传统污水处理方法引起的二次污染、潜在营养物质丢失等弊端,同时能够作为污水深度处理,有效且低成本地去除氮、磷等营养物质。因此,研究利用微藻处理氮磷废水受到广泛重视[3-4]。
目前微藻处理废水的研究,无论是从应用方面[5-8],如高效藻类塘,藻菌协同、藻菌固定化废水处理技术等,还是从理论研究方面[9-11],如COD、氮磷去除的机理、生长环境因素等均主要集中在光照条件下,对黑暗条件下微藻处理废水却少有研究。黑暗条件下,利用微藻的异养生长处理废水,可避免光自养生长过程中光抑制或光限制等问题,由于不受光照条件限制,处理效果稳定,运行费用低廉。
1 材料与方法
1.1 实验材料
1.1.1 普通小球藻 Chlorella Vuganis:购自中科院水生生物研究所(FACHB-1068)。
1.1.2 活性污泥 取自无锡市芦村污水处理厂二沉池。
1.1.3 模拟养殖废水 根据无锡市南洋农畜业有限公司的养猪场冲洗废水的水质人工配制,COD约500 mg/L、TN 约 100 mg/L、TP 约 20 mg/L,具体成分见表1。
以上试剂溶于10 L水、调节pH至7即得模拟废水。
1.2 测定方法
COD的测定:采用GB11914-89重铬酸盐法;TN的测定:采用GB 11894-89碱性过硫酸钾消解紫外分光光度法;TP的测定:采用GB 11893-89钼酸铵分光光度法。
MLSS的测定:取定量污泥用滤纸过滤,在103~105℃烘2 h至恒重,干燥器中冷却至室温后称重;小球藻干重的测定:取0.45 μm的纤维滤膜过滤藻,103℃烘至恒重;总叶绿素测定:采用乙醇提取比色法。

表1 模拟废水成分表Tab.1 Ingredient of simulant wastewater
1.3 实验方法
1.3.1 藻种培养 藻种培养采用BG-11培养基,培养条件为25℃、光照强度5 000 Lx、光暗周期12 h:12 h、每天振摇3~5次,培养至对数生长期。
另一方面,这也是保护我国金融衍生品市场安全的必要之举。2006年8月28日,美国芝加哥商业交易所率先推出人民币期货和期权产品交易。一来让将来赴美国后尘的我国处于竞争的不利地位,二来由于我国的监管机关对于境外衍生产品市场没有监管权,人民币期货期权市场价格操纵行为的负面影响传到国内时,我国能采取的监管措施是十分有限的。因此,我们必须加强与国际货币法制、国际银行监管法制、国际证券监管法制、国际贸易法、国际投资发展的协调。
1.3.2 藻种与污泥的驯化 取培养至对数生长期的藻种按体积分数20%接种到废水中进行驯化,驯化条件为25℃、光照强度5000 Lx、光暗周期12 h:12 h、每天振摇3~5次,使其适应在废水环境中生长。污泥接种至废水中,曝气20 h,静置沉淀2 h,排出上清液后重新添加废水曝气,如此循环。
1.3.3 光暗条件下普通小球藻的废水处理 取小球藻接种于灭菌模拟废水,质量浓度34 mg/L,光照(强度5 000 Lx)或黑暗培养,温度为25℃。定时取样测定水质。做3个平行实验,文中数据为3个平行实验平均值。
1.3.4 黑暗条件下菌藻协同处理废水 以黑暗静置、黑暗摇床培养条件下对藻、菌、藻菌混合设置6组实验组,分别编号 A1(藻静)、A2(藻摇)、B1(菌静)、B2(菌摇)、C1(藻菌静)、C2(藻菌摇),温度 25℃,摇床150 r/min。藻菌混合组中藻、菌质量浓度均为34 mg/L;纯藻与纯泥组中藻和泥的质量浓度也均为34 mg/L。其中,纯藻组中加入灭菌离心活性污泥上清液为补偿液,纯泥组中加入灭菌离心藻液上清液为补偿液,实验阶段每天对各实验组进行水质测定,以此探究黑暗条件下小球藻与活性污泥混合相对于藻、菌单独处理废水时的差异。做3个平行实验,文中数据为3个平行实验平均值。
1.3.5 黑暗条件下普通小球藻可持续废水处理的研究 取小球藻接种于灭菌后的模拟废水中,质量浓度34 mg/L,于黑暗、25℃培养箱内培养,4 d后将离心获得藻重新接种到新的模拟废水,如此重复,期间定时测定藻干重、总叶绿素及COD、TN、TP。做3个平行实验,文中数据为3个平行实验平均值。
2 结果与讨论
2.1 光暗条件下普通小球藻的废水处理
由图1、图2可见,COD、TN、TP均在第一天有较大幅度的下降,这是因为开始时营养物质丰富,小球藻得以快速生长,吸收各营养物质,之后则随着藻数量上升以及营养物质不足的限制,生长趋缓,最后基本稳定。

图1 光/暗条件下小球藻废水处理COD变化曲线Fig.1 COD variation curves of Chlorella vuganis under light and dark condition

图2 光/暗条件下小球藻废水处理TN、TP变化曲线Fig.2 TN &TP variation curves of Chlorella vuganis under light and dark condition
从最后各指标的终值可见,黑暗条件下普通小球藻对COD的去除效果强于光照条件,而氮磷的去除则是光照条件强于黑暗条件。小球藻在光照及黑暗条件下分别进行自养及异养生长,对营养物质有着不同的利用途径及机理。有研究表明,某些微藻具有特殊的运送系统,可主动吸收培养基中的有机化合物。黑暗条件下,小球藻生长所必须的碳源主要来自废水,通过吸收利用以维持自身的生长。而光照条件下,小球藻进行光合作用,碳源主要为CO2,因此在黑暗条件下小球藻对COD的去除强于光照条件。光照条件下,藻类通过光合作用把污水中 NH4+,NO3-、NO2-、H2PO4-等无机离子和尿素等有机物质所含有的N、P等元素缔合到碳骨架上,形成藻类细胞,以此达到对废水中营养元素的去除;而黑暗条件下,藻仅通过上述的某些特殊通道对营养元素进行吸收,故在氮磷营养物质的去除方面,光照条件较黑暗条件有更好的效果。
2.2 黑暗条件下菌藻协同处理废水
图 3为 4 d后各组 COD、TN、TP的去除率比较。可见,A1、A2对COD去除率分别为71.14%、52.59%,对TN去除率分别为76.58%和50.82%,对TP去除率为58.82%、49.44%。可见黑暗条件下,静置的环境更利于小球藻对废水中COD及氮磷的吸收。实验发现,A2较A1的pH值有较大波动,但均稳定在7~8之间,因此可排除pH值为主要影响因素,考虑溶解氧的影响。

图3 各实验组去除效果Fig.3 Removal efficiency of each group
Gladue对微藻的异养生长总结了3个必需条件,其中一个就是细胞膜具通透性。有机物只有通过细胞膜进入细胞内部,才能被藻类吸收利用,如果存在通透性障碍,必然限制藻类对有机物的利用[13]。研究发现,影响细胞膜通透性的因素很多,比如溶解氧,较高的氧浓度可能导致细胞体内活性氧积累而对细胞产生毒性,由此导致细胞膜通透性的下降[14],影响了微藻的异养生长。因此,摇床条件其溶解氧较高,普通小球藻对营养物质去除效果不佳。
A1、B1、C1对 COD 去除率分别为 71.14%、53.69%、77.70%,对TN的去除率分别为76.58%、56.07%、85.77%,对 TP去除率分别为 58.82%、46.66%、58.24%。可见,在黑暗、静置条件下,COD及氮磷的去除,普通小球藻占主导地位。因为静置条件下废水中的溶氧有限,抑制了活性污泥的活性,藻菌两者在碳、氮、磷等能源物质有限的条件下存在竞争作用,因而在利于藻生长的条件下,藻菌混合体系藻的生长占优势,其对COD及氮磷的吸收占主导。
A2、B2、C2对 COD的去除率分别为 52.59%、98.62%、99.28%,对 TN去除率分别为 50.82%、82.43%、80.74%,对TP去除率分别为 49.44%、56.64%、55.05%。可见,在黑暗、摇床条件下,藻菌混合体系中COD及氮磷的去除主要依靠活性污泥。原因同上。
从A1与C1、B2与C2对各指标的去除效果来看,黑暗条件下,藻菌两者的混合相比于纯藻、纯菌对COD、TN、TP的去除效果没有显著提升。因此,利用藻菌互利共生提升废水处理效果的高效藻类塘在黑暗条件下其强化作用并不会发生。藻类在高效藻类塘中的大量繁殖,其作为一种生物载体不仅为细菌提供了大量的附着环境,而且藻类的光合作用也为细菌提供了充足的溶解氧,保证了好氧细菌的生长环境;细菌在藻类提供的友好环境中大量繁殖,其呼吸作用也为藻类提供了充足的碳源——二氧化碳,使高效藻类塘内形成了更紧密的藻菌共生系统[15]。在黑暗条件下,藻并不产生氧,也不吸收细菌释放的二氧化碳,因此其不具有类似高效藻类塘的互利共生作用;除此之外,藻类和细菌两者在同一环境下亦存在拮抗和竞争作用。Mayo等人发现异养菌在有小球藻存在的介质中生长要比没有小球藻的介质中慢得多[16],Oswald同样也发现细菌对藻类生长的限制作用,在灭菌的废水中小球藻生长迅速,产量较高[17]。因此,在黑暗条件下,藻菌混合并不会使其去除效果有显著提升。
2.3 黑暗条件下普通小球藻的持续生长研究
黑暗条件下藻类可以异养生长,但是长期无光照对藻类的生长、生理是否存在不利影响,对微藻处理废水效果有何种影响,关系到微藻异养处理废水的实际可行性。作者连续实验了4个周期,每个周期培养4 d,考察了小球藻生长和废水处理的情况。
图4、图5为第一批次及第四批次小球藻黑暗条件下生长过程中总叶绿素和藻干重变化曲线。从两个图可以看出,两个批次的小球藻不管是总叶绿素和藻干重的变化趋势还是两者的量都基本一致,第一天后小球藻快速生长,进入对数生长期,藻干重与叶绿素都有显著增长,之后由于藻的数量及营养物质缺乏的限制趋于稳定。由此可见,3个批次的培养后小球藻依然能够正常生长,而且并未出现叶绿素量减少或藻生长量下降的情况。

图4 第一批次小球藻总叶绿素和藻干重变化曲线Fig.4 Total chlorophyll&dry weight variation curve of the 1st batch Chlorella vuganis

图5 第四批次小球藻总叶绿素和藻干重变化曲线Fig.5 Total chlorophyll&dry weight variation curve of the 4th batch Chlorella vuganis
黑暗条件对藻类最大的影响在于叶绿素的合成,但有研究表明,某些藻类具有在黑暗条件下合成叶绿素的能力。原叶绿素酸酯(protochlorophyllide)是叶绿素合成途径中关键的中间产物。在原叶绿素酸酯还原为叶绿素酸酯这一关键步骤,即D环的还原,有两条途径,即依赖于光的合成途径(光反应)和不依赖于光的合成途径(暗反应)[18],已知有两种酶催化原叶绿素酸酯D环双键的还原进而形成叶绿素a的直接前体叶绿素酸酯a[19-20]。一个是依赖于光的原叶绿素酸酯氧化还原酶(light -dependent NADPH -protochlorophyllide oxidoreduetase,POR,EC 1.3.1.33)[21], 另一个酶是不依赖于光的(暗反应)原叶绿素酸酯还原酶(lightindependent protochlorophyllide oxidoreductase,LIPOR),这种酶不需要光就能催化原叶绿素酸酯的还原。蓝细菌、藻类和裸子植物(非开花植物)同时具有这两种酶。由于叶绿素无光合成酶的存在,光合细菌、藻类、裸子植物等都能在无光条件下合成菌绿素和叶绿素。而且近年来通过分子生物学手段分析各种能够进行暗反应的生物,包括细菌、藻类和植物,发现了与叶绿素的无光合成有关的基因位点[22]。闫海等的研究也表明,小球藻在有无光照条件下对其细胞色素合成的影响不大[23]。
图6、图7为黑暗条件下4个批次小球藻培养过程中COD、TN、TP的变化曲线。由图可知,每个批次的COD与TN、TP一致,均在第一天内大幅下降,说明小球藻已适应该类废水,无需长时间的调整适应,之后各项指标逐步稳定。4个批次COD去除率均保持在65%左右、TN为70%左右、TP50%左右,可见,黑暗条件下普通小球藻能够持续生长且能对废水进行长期处理。

图6 4个批次小球藻废水处理COD变化曲线Fig.6 COD variation curve of the 4 batches Chlorella vuganis
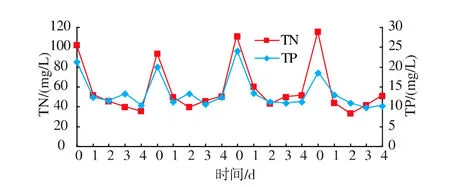
图7 4个批次小球藻废水处理TN、TP变化曲线Fig.7 TN&TP variation curve of the 4 batches Chlorella vuganis
3 结语
1)相比于光照条件,黑暗条件下普通小球藻对COD的去除更强,但其氮磷去除效果不如光照条件。而且,普通小球藻在黑暗环境下,静置的条件对废水中COD及氮磷的去除相比于摇床有更好的效果。
2)在黑暗、摇床条件下的藻泥混合体系中,活性污泥对废水中COD及氮磷的去除占主导作用。在黑暗、静置的条件下,则是普通小球藻对废水中COD及氮磷的去除占主导作用。而且,黑暗条件下,藻菌混合并不会出现两者互利共生强化废水处理的效果。
3)普通小球藻能够在黑暗条件下长期生长,且在过程中能对废水进行持续处理。
[1]周华伟,林炜铁,陈涛.小球藻的异养培养及应用前景[J].氨基酸和生物资源,2005,27(4):69-73.ZHOU Hua-wei,LIN Wei-tie,CHEN Tao.The heterotrophy and applications of Chlorella[J].Amino Acids and Bioticresource,2005,27(4):69-73.(in Chinese)
[2]王海英,郭祀远,郑必胜,等.自养、异养和混养下小球藻的生长及生化成分[J].华南理工大学学报:自然科学版,2004,32(5):55.WANG Hai-ying,GUO Qi-yuan,ZHENG Bi-sheng,et al.Growth and biochemical components of Chlorella vulgars under autotrophic heterotrophic and mixotrophic cultivations[J].Journal of South China University of Technology:Natural Science Edition,2004,32(5):55.(in Chinese)
[3]WANG B,Christopher,Lan Q.Biomass production and nitrogen and phosphorus removal by the green alga Neochloris oleoabundans in simulated wastewater and secondary municipal wastewater effluent[J].Bioresource Technology,2011,102:5639-5644.
[4]Jinsoo K,Bala P L,Rachael R,et al.Removal of ammonia from wastewater effluent by Chlorella vulgaris[J].Tsinghua Science and Technology,2010,15:391-396.
[5]黄翔峰,闻岳,何少林,等.高效藻类塘对农村生活污水的处理及氮的迁移转化[J].环境科学,2008,29(8):2219-2226.HUANG Xiang-feng,WEN Yue,HE Shao-lin,et al.Migration and transformation of nitrogen in a HRAP treating domestic wastewater in rural area[J].Chinese Journal of Environmental Science,2008,29(8):2219-2226.(in Chinese)
[6]邓旭,魏斌,胡章立.利用莱茵衣藻去除污水中氮磷的研究[J].环境科学,2010,31(6):1489-1493.DENG Xu,WEI Bin,HU Zhang-li.Study on the removal of nitrogen and phosphorus from wastewater by Chlamydomonas reinhardti[J].Chinese Journal of Environmental Science,2010,31(6):1489-1493.(in Chinese)
[7]孟睿,何连生,席北斗,等.利用菌-藻体系净化水产养殖废水[J].环境科学研究,2009,22(5):511-515.MENG Rui,HE Lian-sheng,XI Bei-dou,et al.Purifying deteriorated aquacultural water with a bacteria-alga system[J].Research of Environmental Sciences,2009,22(5):511-515.(in Chinese)
[8]何萍,杨启银,陈育如,等.光合细菌与小球藻复合处理豆制品废水[J].食品与生物技术学报,2001,20(6):578-581.HE Ping,YANG Qi-yin,CHEN Yu-ru,et al.Bean product wastewater treatment using photosynthetic bacteria and Chlorella vulgaris[J].Journal of Food Science and Biotechnology,2001,20(6):578-581.(in Chinese)
[9]董芳芳,程凯,许敏,等.藻类对造纸废水中COD的去除效率研究[J].环境科学与技术,2010,33(1):166-169.DONG Fang-fang,CHEN Kai,XU Min,et al.Removal of COD in paper-making wastewater by algae[J].Environmental Science&Technology,2010,33(1):166-169.(in Chinese)
[10]贾璇,闫海,肖宝清,等.原核小球藻USTB-01去除化肥厂废水中总氮的研究[J].环境工程学报,2010,4(4):737-740.JIA Xuan,YAN Hai,XIAO Bao-qing,et al.Removal of total nitrogen from wastewater discharged from a chemical fertilizer plant by Chlorella protothecoides USTB-01[J].Chinese Journal of Environmental Engineering,2010,4(4):737-740.(in Chinese)
[11]杨海波,刘艳,吕福荣.环境条件对小球藻去除水产加工废水中氨态氮的影响[A].中国环境科学学会学术年会优秀论文集[C].北京:中国环境科学出版社,2006:2408-2411.
[12]陈春云,庄源益,方圣琼.小球藻对养殖废水中N、P的去除研究[J].海洋环境科学,2009,28(1):9.CHEN Chun-yun,ZHUANG Yuan-yi,FANG Sheng-qiong.Study on N,P removed in culturing wastewater by Chlorella[J].Marine Environmental Science,2009,28(1):9.(in Chinese)
[13]吴薇.不同培养方式下普通小球藻降解苯酚的研究[D].南昌:南昌大学,2007:7.
[14]未作君,元英进,倪晋仁.溶氧浓度对东北红豆杉悬浮细胞的生理影响[J].北京大学学报,2004,40(4):574-575.WEI Zuo-jun,YUAN Ying-jin,NI Jin-ren.Physiology effect of dissolved oxidation concentration on suspension culture of Taxus cuspidate[J].Acta Scientiarum Naturalium Universitatis Pekinensis,2004,40(4):574-575.(in Chinese)
[15]何少林,黄翔峰,乔丽,等.高效藻类塘氮磷去除机理的研究进展[J].环境污染治理技术与设备,2006,7(8):6-7.HE Shao-lin,HUANG Xiang-feng,QIAO Li,et al.Research progress on the removal mechanisms of nitrogen and phosphate in high rate algal ponds[J].Techniques and Equipment for Environmental Pollution Control,2006,7(8):6-7.(in Chinese)
[16]Mayo A W,Noike T.Effects of temperature and pH on the growth of heterotrophic bacterial in waste stabilization ponds[J].Water Research,1996,30(2):447-455.
[17]Oswald W J,Gotaas H B,Ludwig H F,et al.Algae symbiosis in oxidation ponds growth characteristics of Chorella pyrenoidosa cultured in sewage[J].Sewage and Industrial Wastes,1953,25(1):26~37.
[18]Guglielmi G,Cohen-Bazire G,Bryant D A.The structure of Gioeobaeter violaceus and its phycobilisomes[J].Archives of Microbiology,1981,129:181-189.
[19]Nelissen B,Van de Peer,Y Wilmotte A,et al.An early origin of plastids within the cyanobacterial divergence is suggested by evolutionary trees based oncomplete 16S rRNA sequences[J].Molecular Biology and Evolution,1995,12:1166-1173.
[20]Sharp P M,LI WH.An evolutionary perspective on synonymous codon usage in unicellular organisms[J].Journal of Molecular Evolution,1986,24:28-38.
[21]Sharp P M,Cowe E.Synonymous codon usage in Saccharomyces cerevisiae[J].Yeast,1991,7:657-678.
[22]施春雷,史贤明.原壳小球藻中不依赖于光的原叶绿素酸酯还原酶基因的克隆与分析[J].食品与生物技术学报,2007,26(1):112.SHI Chun-lei,SHI Xian-ming.Cloning and analysis of three genes encoding the subunits of light-independent protochlorophyllide reductase in Chlorella protothecoides CS-41[J].Journal of Food Science and Biotechnology,2007,26(1):112.(in Chinese)
[23]闫海,周洁,何宏胜,等.小球藻的筛选和异养培养[J].北京科技大学学报,2005,27(4):409-410.YAN Hai,ZHOU Jie,HE Hong-sheng,et al.Isolation and heterotrophic culture of Chlorella sp[J].Journal of University of Science and Technology Beijing,2005,27(4):409-410.(in Chinese)
