EMA-LAMP方法快速鉴别检测单增李斯特菌
2012-03-15吕淑霞于晓丹金雪花
吕淑霞,徐 彬, 于晓丹,金雪花,林 英
(沈阳农业大学 生物科学技术学院,辽宁 沈阳110866)
细胞增生性李斯特氏菌(Listeria monocytogenes)属于李斯特氏菌属(Listeria),是一种重要的人畜共患病原菌,由于其在自然界分布广泛,极易通过污染食品传播,感染人和动物引起食源性李斯特菌病,使易感人群产生腹泻发热,严重的导致脑膜炎、败血症、流产等,死亡率高达20%~30%[1]。在北美平均每年有500人死于此病,因此美国和欧盟对此污染非常重视,对即食性食品检出率要求为零。传统的检测方法费时、费力且灵敏度低,多重PCR[2]、RTPCR等虽有较高的特异性和敏感性,但需要特殊的仪器设备,不适合在基层推广。此外,在基因水平食源性病原菌检测方面,死菌DNA的存在通常会导致检测结果高于样品中活菌的实际含量。因此,建立快速准确的检测方法意义极为重要。
环介导等温扩增技术(loop-mediated isothermal amplification,简称LAMP)是2000年开发的一种新的核酸扩增方法,针对靶基因的六个区域设计4条LAMP特异性引物,利用一种链置换DNA聚合酶(Bst DNA Polymerase)在恒温条件(65 ℃左右)下保温约60 min进行扩增[3],仅需普通水浴锅即可。叠氮溴化乙锭(ethidium bromide monoazide,EMA)作为一种DNA结合染料,能够渗透到细胞壁(膜)不完整的菌体内,在光激活的条件下,易形成氮宾化合物与DNA结合[4-5],从而抑制死细胞DNA的扩增,而对活细胞的DNA不起作用,可以有效避免在基因检测中因死菌的存在而对样品污染活菌的高估。已有EMA-LAMP技术成功用于其他病原菌检测的报道[6-7]。作者在前人研究采用LAMP技术和建议用染料的基础上,使用叠氮溴化乙锭成功提高检测灵敏度,并且通过选择EMA浓度避免了污染性,使检测方法既快速又简易,且灵敏度高、特异性强,为食品安全该领域的检测技术提出了新方法,适合于基层使用。
1 材料与方法
1.1 材料、主要试剂与仪器
1.1.1 实验菌株 本研究共采用9株菌株,其中包括2株单增李斯特菌标准菌株ATCC19111和ATCC19115(阳性菌株),7株非单增李斯特菌(阴性菌株),均为作者所在实验室保存。
1.1.2 主要试剂和仪器 EMA、betaine:美国Sigma公 司 ;dNTPs、DL2000 DNA Marker、LAMP 引 物 :TAKARA宝生物(大连)工程有限公司;Lysozyme:宝泰克生物科技公司;Proteinase K:Roche公司;Bst DNA Polymerase,Large Fragment:New England Biolabs公司;电泳仪水平板电泳槽及附件JY600C:北京君意东方电用仪器有限公司;凝胶成像系统UNIVERSAL HOODⅡ-S.N.76S/03822:Bio-Rad 公司;500 W 卤钨灯:沈阳艺沈器化玻站;立式压力蒸汽灭菌锅LDZX-30KBS:上海申安医疗机械厂;数显恒温水浴锅HH-4:国华电器有限公司;移液枪:Eppendorf公司。
1.2 方法
1.2.1 单增李斯特菌的培养和处理 将单增李斯特菌ATCC19111接种于胰酪胨大豆酵母浸膏培养基(TSA-YE)中,过夜培养(37 ℃、160 r/min)。取 10 mL对数生长期的菌悬液于10 000 r/min离心1 min。菌悬浮在10 mL 0.85%的生理盐水中,10 000 r/min离心1 min。生理盐水稀释使菌浓度为2.0×108CFU/mL,菌悬液留作检测用。
1.2.2 LAMP反应引物设计与合成 根据GenBank数据库中的单增李斯特菌hly基因序列,利用在线LAMP引物设计软件PrimerExplorer V4进行分析,在其保守序列中的六个不同位点设计了4条引物:外引物 hly-F3、hly-B3,内引物 hly-FIP、hly-BIP。 内引物hly-FIP由F1C通过TTTT连接物与F2相连而组成,内引物hly-BIP为B1C通过TTTT连接物与B2相连而组成。引物委托TAKARA宝生物(大连)工程有限公司合成。引物设计原理见图1,引物序列见表1。
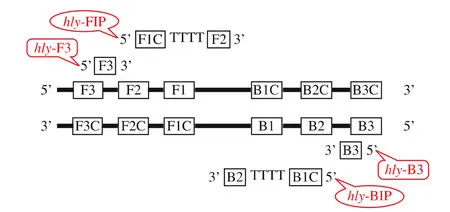
图1 LAMP引物设计原理Fig.1 Schematic representation of the primer design for EMA-LAMP assay

表1 LAMP引物序列Tab.1 Nucleotide sequence of primer sets designed for EMA-LAMP assay
1.2.3 模板DNA的提取 取菌浓度为2.0×108CFU/mL的菌悬液500 μL于1.5 mL离心管中,12 000 r/min离心5 min,弃上清液,收集菌体;向每管加入90 μL ddH2O 重悬,加入 6 μL Lysozyme(50 mg/mL),用枪头混匀,37℃温浴15 min;加入4 μL Proteinase K(20 mg/mL),振荡数秒,置于58℃恒温水浴锅内孵育45 min;接着95℃加热8 min,使酶失活;12 000 r/min离心5 min,取上清液备用。
1.2.4 LAMP反应体系与产物检测 LAMP反应总体积为 25 μL: 0.2 mmol/L 的 hly-F3 和 hly-B3,0.8 mmol/L 的 hly-FIP 和 hly-BIP,4mmol/L 的MgSO4,1 ×ThermoPol Reaction Buffer (20 mmol/L Tris-HCl、10 mmol/L KCl、10 mmol/L (NH4)2SO4、2 mmol/L MgSO4、0.1%Triton X-100,pH 8.8,25 ℃),1.6 mmol/L 的 dNTPs,1 mol/L 的 betaine,8 U Bst DNA Polymerase,2 μL 模板 DNA, 加 ddH2O 至 25 μL。轻弹混匀,63℃恒温反应1 h后,80℃灭活10 min。同时设立阴性对照,用ddH2O取代模板DNA,其它反应条件不变。取3 μL反应产物与1 μL 6×Loading Buffer混匀后点样于1 g/dL琼脂糖凝胶(含溴化乙锭)中,150 V电泳35 min后于凝胶成像系统中成像,观察扩增产物是否呈阶梯状条带。如果为阳性反应,则产生典型的阶梯状条带,如果为阴性反应,则无条带产生[8-9]。
1.2.5 热处理杀死菌细胞 取0.85%的生理盐水处理的500 μL菌悬液放于1.5 mL离心管中,95℃水浴8 min。待菌悬液冷却至室温,涂平板,置于37℃培养箱中培养24 h,以确保热处理的菌被完全杀死。
1.2.6 EMA-LAMP检测的特异性试验 用ddH2O溶解EMA,配制成1 mg/mL母液,用锡箔纸包裹置于-20℃备用。EMA为致癌物质,操作时注意安全。取20 μL质量浓度为0.1 mg/mL的EMA溶液分别加入含有500 μL菌浓度为2.0×108CFU/mL的单增李斯特菌ATCC19111和ATCC19115以及7株非单增李斯特菌的离心管中,混匀并于黑暗下室温放置5 min,后放在冰上,每5分钟补充一次冰,距500 W卤钨灯16 cm,曝光20 min。按照1.2.3方法提取DNA,作为LAMP反应的DNA模板进行LAMP扩增和电泳检测,验证其特异性。
1.2.7 不同浓度EMA对死菌DNA的LAMP扩增影响 分别向含有浓度为2.0×108CFU/mL的500 μL热杀死菌悬液中加入浓度为0.1 mg/mL的EMA溶液,使 EMA 的终质量浓度分别为 0、0.2、0.4、0.8、2.0、4.0、8.0、10 μg/mL, 混匀并于黑暗下室温放置 5 min,后放在冰上,每5 min补充一次冰,防止温度升高,距500 W卤钨灯16 cm,曝光25 min。按照1.2.3方法提取DNA,作为LAMP反应的DNA模板进行LAMP扩增和电泳检测。
1.2.8 不同浓度EMA对活菌DNA的LAMP扩增影响 分别向含有浓度为2.0×108CFU/mL的500 μL活菌悬液中加入1 mg/mL的EMA母液,使EMA终质量浓度分别为0、2.0、4.0、8.0、10、20、40、80 μg/mL,混匀并于黑暗下室温放置5 min,然后放在冰上,每5分钟补充一次冰,距500 W卤钨灯16 cm,曝光25 min。按照1.2.3方法提取DNA,作为LAMP反应的DNA模板进行LAMP扩增和电泳检测。
1.2.9 EMA曝光时间的优化 取20 μL质量浓度为0.1 mg/mL的EMA溶液,分别加入含有500 μL菌浓度为2.0×108CFU/mL的活菌和热杀死菌的离心管中,混匀并于黑暗下室温放置5 min,然后放在冰上,每5分钟补充一次冰,距500 W卤钨灯16 cm, 曝光时间分别为 0、1、5、10、15、20 min。 按照1.2.3方法提取DNA,作为LAMP反应的DNA模板进行LAMP扩增和电泳检测。
1.2.10 EMA-LAMP检测的灵敏度试验 取20 μL质量浓度为0.1 mg/mL的EMA溶液,分别加入含有500 μL 菌浓度依次为 2.0×107、2.0×106、2.0×105、2.0×104、2.0×103、2.0×102、2.0×101、2.0×100CFU/mL的活菌悬液的离心管中,混匀并于黑暗下室温放置5 min,后放在冰上,每5分钟补充一次冰,距500 W卤钨灯16 cm,曝光20 min。按照1.2.3方法提取DNA,作为LAMP反应的DNA模板进行LAMP扩增和电泳检测,检测其灵敏度。
2 结果与分析
2.1 EMA-LAMP检测的特异性评价
EMA-LAMP方法检测结果显示,两株单增李斯特菌标准菌种均出现LAMP的特征性条带,而7株非单增李斯特菌及阴性对照均未出现LAMP条带。上述结果表明,EMA-LAMP方法检测单增李斯特菌具有很好的特异性,见图2。

图2 EMA-LAMP的特异性检测结果Fig.2 Specificity of amplification results by EMA-LAMP
2.2 抑制死菌DNA的LAMP扩增的最小EMA质量浓度
不同浓度EMA处理菌浓度为2.0×108CFU/mL的热杀死的单增李斯特菌后,LAMP反应可扩增出特异性的阶梯状条带,EMA质量浓度在0.2~2 μg/mL内,扩增产物的电泳条带逐渐减弱;当EMA质量浓度大于等于4 μg/mL时,无扩增产物出现。因此抑制死菌DNA的LAMP扩增的最小EMA质量浓度为 4 μg/mL,见图 3。

图3 不同质量浓度EMA对死菌DNA的LAMP扩增影响Fig.3 Effect of the differential concentration of EMA on the LAMP for DNA from heat killed bacterial cells
2.3 不抑制活菌DNA的LAMP扩增的最大EMA质量浓度
不同浓度EMA处理菌浓度为2.0×108CFU/mL的单增李斯特菌活菌细胞后,LAMP反应都能扩增出特异性的阶梯状条带,EMA质量浓度在2~10 μg/mL内,扩增产物的电泳条带几乎无变化;EMA质量浓度在10~40 μg/mL时,扩增产物的条带逐渐减弱;但当EMA质量浓度大于等于80 μg/mL时,无扩增产物出现;所以不抑制活菌DNA的LAMP扩增的最大EMA质量浓度为10 μg/mL,见图4。因此作者采用质量浓度为4 μg/mL的EMA检测单增李斯特菌活菌细胞。

图4 不同质量浓度EMA对活菌DNA的LAMP扩增的影响Fig.4 Effect of the differential concentration of EMA onthe LAMP for DNA from viable bacterial cells
2.4 EMA激活光解的最佳曝光时间
利用 4 μg/mL EMA处理 菌浓度为 2.0×108CFU/mL的单增李斯特菌活菌细胞,在500 W卤钨灯下曝光0~20 min,LAMP反应均能够扩增出特异性的阶梯状条带且条带亮度几乎无变化,所以EMA的曝光时间对活菌DNA LAMP扩增无影响,见图5。

图5 EMA的曝光时间对活菌DNA LAMP扩增的影响Fig.5 Effect of the light exposure time on achieving complete photolysis of free EMA in suspensions of viable bacterial cells
同样,利用4 μg/mL EMA处理菌浓度为2.0×108CFU/mL的热杀死的单增李斯特菌,在500 W卤钨灯下进行曝光0~20 min,LAMP反应能够扩增出特异性的阶梯状条带;曝光时间在0~10 min,扩增产物的条带逐渐减弱;当曝光时间为15 min时,条带明显减弱;当日落光时间为20 min时,没有扩增条带。所以EMA激活光解的最佳曝光时间为20 min,见图6。因此作者建立EMA-LAMP鉴别检测单增李斯特菌死活菌细胞时,确定EMA曝光时间为20 min。
2.5 EMA-LAMP检测的灵敏度评价
随着活菌细胞数目的减少,LAMP的阶梯状条带也逐渐减弱,到活菌浓度为2.0×100CFU/mL时,不再出现LAMP条带,因此EMA-LAMP方法检测活的单增李斯特菌的检出限是20 CFU/mL,见图7。
3 结语
本研究表明:抑制活菌LAMP扩增的EMA质量浓度要大于10 μg/mL,与Lee和Levin[10]研究的抑制活菌PCR扩增的结果相符。抑制死菌LAMP扩增的最小EMA质量浓度为4.0 μg/mL。Gu和Levin[11]研究的抑制类志贺单胞菌死菌细胞的最小EMA质量浓度为 1.0 μg/mL,Lee 和 Levin[10]研究的抑制死菌PCR扩增的最小EMA质量浓度为0.8 μg/mL,Wang和Levin[12]研究的抑制死菌PCR扩增的最小EMA质量浓度为2.5 μg/mL。因此EMA-LAMP检测某种食源性致病细菌死活细胞时,必须选择最佳EMA质量浓度。试验结果证明4.0 μg/mL足以抑制2.0×108CFU/mL死菌细胞的扩增,而对活菌细胞的扩增无影响。

图6 EMA的曝光时间对死菌DNA LAMP扩增的影响Fig.6 Effect of the light exposure time on activating the DNA-bound EMA and on achieving complete photolysis of free EMA in suspensions of heat killed bacterial cells

图7 EMA-LAMP的灵敏度检测结果Fig.7 Sensitivity of amplification results by EMA-LAMP
利用EMA与LAMP检测相结合的技术,不仅可以有效区分单增李斯特菌病原菌的死活细胞,而且检测单增李斯特菌活菌细胞的灵敏度可达到20 CFU/mL。同时,EMA-LAMP法与 EMA-PCR法、EMA-实时荧光PCR等[13-15]相比,不需要使用PCR等昂贵、精密的仪器设备,避免了DNA的热变性、长时间的温度循环等步骤,反应更迅速、操作更简便、检测成本更低,为单增李斯特菌的快速鉴别检测提供了新的发展方向,有望成为简易的常规检测手段,尤其适用于基层检测和现场检测。
[1]Mengaud J,Vicente M F,Chenevert J,et a1.Expression in Escherichia coli and analysis of the Listeiolysino determinant of Listeria monocytogenes[J].Infect Immun,1998,56:766-772.
[2]王娜,陶妍.水产品三种致病菌多重PCR检测方法的建立[J].食品与生物技术学报,2009,28(3):397-402.WANG Na,TAO Yan.Establishment of a multiplex PCR for detection of three types of pathogen in aquatic foods[J].Journal of Food Science and Biotechnology,2009,28(3): 397-402.(in Chinese)
[3]Notomi T,Okayama H,Masubuehi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12): e63.
[4]Nocker A,Ching-ying C,Camper A K.Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs.dead bacteria by selective removal of DNA from dead cells[J].Journal of Microbiological Methods,2006,67:310-320.
[5]Walters C,Bolkan H,Luo L X,et al.Quantification of viable cells of clavibacter Michiganesis subsp.Michiganensis using a DNA binging dye and a real-time PCR assay[J].Plant Pathology,2008,57:332-337.
[6]鲁玉侠,郭祀远,石磊,等.EMA-LAMP方法快速检测死/活的食源性沙门氏菌[J].食品科学,2009,30(22):324-327.LU Yu-xia,GUO Si-yuan,SHI Lei,et al.Rapid detection of live/dead Salmonella via EMA-LAMP method[J].Food Science,2009,30(22): 324-327.(in Chinese)
[7]李月,王丽,钟青萍,等.DNA染料结合环介导等温扩增技术检测志贺氏菌死活细胞[J].食品工业科技,2011,32(8):216-219.LI Yue,WANG Li,ZHONG Qing-ping,et al.Differentiation of the viable and dead cells of Shigella by loop-mediated isothermal amplificaiton with a DNA binding dye[J].Science and Technology of Food Industry,2011,32(8): 216-219.(in Chinese)
[8]Hisatoshi K,Tomohiro I,Koki A,et al.Sensitive and rapid detection of herpes simples virus and varicella-zoster virus DNA by loop-mediated isothermal amplification[J].Journal of Clinical Microbiology,2005,43:3290-3296.
[9]Hayashi N,Arai R,Tada S,et al.Detection and identification of Brettanomyces/Dekkera ap.yeasts with a loop-mediated isothermal amplification method[J].Food Microbiology,2007,24 (7-8): 780-785.
[10]Lee J L,Levin R E.Use of ethidium bromide monoazide for quantification of viable and dead mixed bacterial flora from fish fillets by polymerase chain reaction[J].Journal of Microbiological Methods,2006,67:456-462.
[11]Gu W M,Levin R E.Quantification of viable Plesiomonas shigelloides in a mixture of viable and dead cells using ethidium bromide monoazide and conventional PCR[J].F B T,2007,21:145-159.
[12]Wang S S,Levin R E.Discrimination of viable Vibrio vulnificus cells from dead cells in real-time PCR[J].Journal of Microbiological Methods,2006,64:1-8.
[13]Knut R,Birgitte M,Signe M D,et al.Use of ethidium monoazide and PCR in combination for quan tification of viable and dead cells in complex samples[J].Applied and Environmental Microbiology, 2005, 71(2): 1018-1024.
[14]Lee J L,Levin R E.Discrimination of viable and dead Vibrio vulnificus after refrigerated and frozen storage using EMA,sodium deoxycholate and real-time PCR[J].Journal of Microbiological Methods, 2009, 79: 184-188.
[15]Nocker A,Camper A K.Selective removal of DNA from dead cells of mixed bacterial communities by use of ethidium monoazide[J].Applied and Environment Microbiology,2006,72:1997-2004.
