制备米糠蛋白降血压肽最佳用酶的筛选
2012-03-13于靖翟爱华
于靖,翟爱华
(黑龙江八一农垦大学食品学院,大庆163319)
近年来国内外研究表明,食物蛋白质酶解产物中的一些短肽具有广泛的生理调节功能[1-3],特别是具有降压活性的降压肽已成为生物活性肽研究领域的重要方面。Oshima等1979年报道了从明胶酶解液中分离提取了血管紧张素转化酶(ACE)抑制肽,这是首次用蛋白酶体外水解食品蛋白获得ACE抑制肽[4]。上世纪90年代Hata等研究发现,高血压患者每天喝95mL含有缬氨酸-脯氨酸-脯氨酸(Val-Pro-pro)和氨酸-脯氨酸-脯氨酸(Ile-pro-pro)的酸奶能够显著降低血压,单次口服Val-Pro-pro和Ile-pro-pro也能显著降低原发性高血压大鼠(SHR)的血压[5]。
目前,ACE抑制肽主要是通过微生物发酵或蛋白酶水解来生产,此外还有从自溶产物中提取、DNA重组技术,酸、碱水解法及化学合成法等[6]。酶法因其成本低、产品安全性高、无副作用等特点,是目前降解蛋白质制备ACE抑制肽最主要的生产方式[7]。国内外大多以大豆蛋白[8-10]、玉米蛋白[11-13]、鸡蛋蛋白[14,15]、胶原蛋白[16-18]等原料制备降血压肽。米糠是稻米加工过程中主要的副产物,目前主要用于饲料加工和初级产物的提取,造成资源的浪费。米糠蛋白质含量在10%以上,且其氨基酸组成接近于人体需要量模式[19],用米糠蛋白来生产降血压成本低、安全性高,适合大规模的工业化生产。研究选用七种蛋白酶单酶和复合酶酶解米糠蛋白,通过测定酶解物ACE抑制率及数学统计方法筛选酶,以期获得具有稳定ACE抑制活性的降压肽,以便为工业化生产米糠降血压提供技术参考。
1 材料与方法
1.1 材料与设备
1.1.1 原料
米糠蛋白(北大荒希杰食品科技公司),ACE、Hippuryl-His-Leu(美国sigma公司),中性、碱性蛋白酶(西安永屹生物技术有限公司),木瓜蛋白酶(北京奥博星生物技术有限责任公司),胰、胰凝乳蛋白酶(美国Amresco公司),碱性蛋白酶Alcalase 2.4 L(丹麦诺维信),蛋白酶K(德国merk),其他试剂均为国产分析纯。
1.1.2 主要设备
T6新世纪紫外-可见分光光度计(北京普析通用仪器有限责任公司),AR2140电子天平,(梅特勒-托利多仪器有限公司),LD5-10B低速离心机(北京京立离心机有限公司),PH-3C pH计(上海安亭雷磁有限公司),DK-S24电热恒温水浴锅(上海森信试验仪器有限公司),TDS-050冷冻干燥试验机(抚顺黎明机械厂)。
1.2 实验方法
1.2.1 米糠蛋白酶解液的制备
米糠蛋白按一定底物浓度加水配成悬浮液,90℃加热预处理10 min,降温至所需温度后加1 mol·L-1氢氧化钠溶液调pH,恒温恒pH下搅拌15min待pH稳定后加入酶水解(水解过程中不断加入氢氧化钠深夜维持pH在规定范围的±0.05内),反应结束后迅速加热10min灭酶,离心(4 000 r·min-1,15min),收集上清液备用。
1.2.2 ACE抑制活性的测定方法
试验选用黎观红建立的体外测定方法[7]并进行了适当调整来测定ACE抑制活性,此方法简便、灵敏、准确、重复性较好。方法如下:将ACE底物HHL溶于0.1 mol·L-1的含0.3 mol·L-1NaCl的硼酸盐缓冲液中(pH 8.3),配制成5 mol·L-1的浓度。取50μL 5 mol·L-1HHL溶液与20μL ACE抑制剂混合,在37℃恒温水浴中预热5min,随后加入10μL 0.1 U·mL-1ACE溶液,37℃反应 30 min。加入100μL 1mol·L-1HCl溶液终止反应,并加入蒸馏水至0.5mL。在避光条件下加入0.6 mL喹啉,旋涡器上混合10 s后加入0.2 mL苯磺酰氯(BSC),立即盖紧离心管管塞在旋涡混合器上混合20 s,反应液在30℃恒温水浴锅中避光放置30min。随后向管中加入3.7mL无水乙醇,混匀,继续避光放置30min。用紫外-可见分光光度计测定波长492 nm的吸光值,计算ACE抑制程度。计算公式如下:
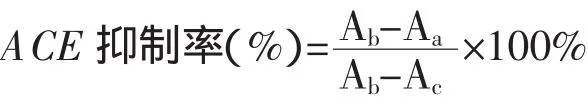
式中:Aa——ACE及ACE抑制剂都存在的条件下的吸光度;
Ab——ACE抑制剂不参与反应的条件下测得的吸光度;
Ac——ACE不参与反应的条件下的吸光度。
1.2.3 单酶筛选的研究
根据各种蛋白酶水解的特异性不同,试验分别选取了碱性蛋白酶、碱性蛋白酶Alcalase 2.4 L、中性蛋白酶、木瓜蛋白酶、胰蛋白酶、胰凝乳蛋白酶和蛋白酶K等七种蛋白酶进行水解,在各种酶的最适酶解条件下(各酶合适的pH和温度下),以底物浓度为3%,酶用量为3 000 U·g-1,时间为6 h进行试验,通过测定ACE抑制率和水解度筛选出适合于米糠蛋白酶解的最适用酶。
1.2.4 复合酶筛选的研究
选取ACE抑制活性较强的酶按比例(1∶1、1∶2、1∶3、2∶1、3∶1)进行两两组合,复合后总的酶活力为3 000 U·g-1,配制3%米糠蛋白溶液,在100℃热处理10 min先加入第一种酶作用2 h后,灭酶后调至第二种酶的适宜条件,继续水解2 h在100℃条件下热处理10min使酶失活,4 000 r·min-1离心15min取上清液进行冷冻干燥(干燥仓压力5 Pa,冻结温度-30℃,冷阱温度-50℃,干燥终点20℃),取干燥粉末溶解后测定ACE抑制活性。
1.2.5 最佳水解用酶的研究
把单酶和复合酶作用下较高的ACE抑制活性进行比较,通过差异显著性分析得到最佳的水解用酶。
1.3 统计分析
采用SAS8.2软件对所得数据进行分析。
1.4 米糠蛋白常规指标
蛋白质含量的测定(参照GB/T 5009.5-2010);
灰份的测定(参照GB/T 5009.4-2010);
水分的测定(参照GB/T 5009.3-2010);
粗脂肪的测定(参照GB/T5009.6-2003)。
2 结果与讨论
2.1 米糠蛋白常规指标
米糠蛋白中各组分含量见表1。

表1 米糠蛋白的成分分析结果Table 1 Rice bran protein componentanalysis result
2.2 单酶筛选的研究
七种单酶分别水解6 h,在1、2、3、4、5、6 h六个不同的时间点取样,测得降血压肽的ACE抑制率各不相同,见图1。
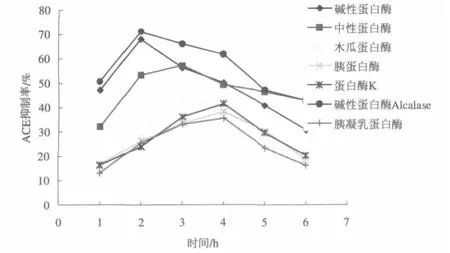
图1 单酶作用下降压肽的ACE抑制率Fig.1 ACE inhibition rate under single enzyme action of pressure drop peptide
米糠蛋白在碱性蛋白酶、碱性蛋白酶Alcalase、中性蛋白酶、木瓜蛋白酶、胰蛋白酶、胰凝乳蛋白酶和蛋白酶K各酶最适条件下酶解,随着各酶作用时间的延长,降血压活性先迅速升高,随着时间的延长,活性开始降低。水解蛋白酶Alcalase作用下得到的降压肽的ACE抑制率最高,达到71.1%。
酶解程度即水解度的大小对肽段长度、游离氨基酸的相对含量和产物ACE抑制活性至关重要。酶解程度不够,具有ACE抑制活性的氨基酸残基不能暴露出来,则显示不出ACE抑制活性;如果酶解程度太大,产物中的游离氨基酸相对含量增加,具有ACE抑制率的肽段被进一步水解,而破坏了其具有ACE抑制活性的肽段结构上的完整特征,ACE抑制活性因此也不高。
2.3 复合酶筛选的研究
通过单酶筛选实验,选取ACE抑制率较高的碱性蛋白酶Alcalase、中性蛋白酶和碱性蛋白酶三种酶进行复合酶筛选研究。复合酶在不同的比例下水解米糠蛋白,得到降血压肽的ACE抑制活性与其在单一的酶作用下的ACE抑制活性有所不同,结果见表2。

表2 不同复合酶组合及配比下降压肽的ACE抑制活性Table 2 ACE inhibited activity of different composite enzyme combination and ratio of antihypertensive peptide
由表2可知,酶在不同的复合比例条件下酶解米糠蛋白得到降血肽的ACE抑制活性各不相同。试验的目的是选取最佳的酶,每组复合酶水解4 h时有最大ACE抑制活性,对其进行差异显著性分析,其结果见表3。
由表3差异显著性分析可知,酶复合后各组的ACE抑制率均显著,水解蛋白酶Alcalase和中性蛋白酶组合(3∶1)的ACE抑制率显著高于水解蛋白酶Alcalase(3∶1)和碱性蛋白酶组合及碱性蛋白酶和中性蛋白酶组合。因此复合酶中优先选择水解蛋白酶Alcalase和中性蛋白酶(3∶1)组合。

表3 复合酶对ACE抑制活性的比较Table 3 ACE inhibitory activity of different composite enzyme
2.4 单酶和复合酶对ACE抑制活性的比较
把单酶作用下的最佳ACE抑制率和复合酶作用下最佳的ACE抑制率,通过差异显著性分析得到水解最佳用酶,其结果见表4。

表4 不同蛋白酶作用下降压肽ACE抑制活性的比较Table 4 ACE inhibited activity of different protease function antihypertensive peptide
由表4的差异显著性分析可以看出,复合酶的ACE抑制率与水解蛋白酶Alcalase单独作用时相比较,差异显著。这可能是由于中性蛋白酶作为第二步水解用酶,进一步将有活性的肽段水解为无活性的肽段,而导致复合酶水解后ACE抑制活性反而降低。
综合考虑,单酶及复合酶酶解米糠蛋白的酶解物ACE抑制活性,碱性蛋白酶Alcalase进行水解得到的肽段具有较高的ACE抑制活性,因此试验选取碱性蛋白酶Alcalase为水解用酶。
3 结论
3.1 米糠蛋白在酶的水解作用下得到的酶解物具有ACE抑制活性,不同的蛋白酶及其配比条件下得到的酶解物的ACE抑制活性各不同。
3.2 碱性蛋白酶Alcalase水解得到的ACE抑制活性最高,在2 h达到最大,为71.1%。
3.3 复合酶水解米糠蛋白4 h时,水解蛋白酶Alcalase与中性蛋白酶在3∶1的条件下ACE抑制率达到最高,达到61.10%。
3.4 通过单酶和复合酶的差异显著性分析,筛选出水解蛋白酶Alcalase为最佳水解用酶。
[1]Schaller M D.Biochemical signals and biological responses elicited by the focal adhesion kinase[J].Biochem Biophys Acta,2001,540:1.
[2]Bradford M M.A rapid and sensitive method for the quantitation ofmicrogram quantities of protein utilizing the principle of proteindye binging[J].Anal Biochem,1976,72:248.
[3]Garcia M G,Toney S J,Hille M B.Focal adhesion kinade(FAK) expression and phosphorylation in sea urchin embryos[J].Gene Expr Patterns,2004(4):223.
[4]Oshima G,Shimabukuro H,Nagasawa K.Peptide inhibitors of angiotensinⅠ-converting enzyme in digests of gelatin by bacterial collagenase[J].Biochim Biophys Acta,1979,566:128-137.
[5]Hata Y,Yamamoto M,Ohm M,et al.A placebo-controlled study of the sour milk on blood pressure in hypertensive subjects[J].Am Jchn Nutr,1996,64:767-771.
[6]梁汉萦,刘成梅,刘伟.食源性ACE抑制肽的研究进展[J].食品研究与开发,2007,28(8):156-158.
[7]黎观红.食物蛋白源血管紧张素转化酶抑制肽的研究[D].无锡:江南大学,2005.
[8]Shin ZI,Ahn CW,Nam HS,et al.Fractionation of angiotensin converting enzyme inhibitory peptide from soybean paste[J].Korean J Food Sci Technol,1995,27:230-234.
[9]Wu J,Ding X.Hypotensive and physiological effect of angitensin conveting enzyme inhibitory peptides derived from soy protein on spontaneously hypertensove rats[J].Agric Food Chem,2001,49:501-506.
[10]Shin ZI,Yu R,Park SA,etal.His-His-Leu an angiotensin I converting enzyme inhibitory peptide derived from Korean soybean paste,exerts antihypertensive activity in vivo[J].Agric Food Chem,2001,49:3004-3009.
[11]Suh HJ,Whang JH.A peptide from corn gluten hydrolysate that is inhibitory toward angiotensin I-converting enzyme[J].Biotechnol Lett,1999,21:1055-1058.
[12]Miyoshi S,Ishikawa H,Laneko T,et al.Structures and activity of angiotensin-converting enzymw inhibitors in α-zein hydrolysate[J].Agric Biol Chem,1991,55:1313-1318.
[13]Yano S,Suzuki K,Funatsu G.Isolation fromα-zein of thermolysin peptides with angiotensin-I-converting enzyme inhibitory activity[J].Biosci Biotech Biochem,1996,60:661-663.
[14]Fujita H,Yokoyama K,Yoshikawa M.Classification and antihypertensive activity of angiotensin I-converting enzyme inhibitory peptides derived from food proteins[J].Food Sci,2000,65:564-569.
[15]Yoshu H,Tachi N,Ohba R,et al.Antihypertensive effect of ACE inhibitoey oligopeptide from chicken egg yolks[J].Comp Biochem Physiol,2001,128:27-33.
[16]Byun HG,Lim SK.Purification and characteization of angiotensin I converting enzyme(ACE) inhibitory peptides from Alaska pollack skin[J].Process Biochem,2001,36:1155-1162.
[17]Kim SK,Byun HG,Park PJ,et al.Angiotensin I converting enzyme inhibitory peptide purified from bovine skin gelatin hydrolysate[J].Agric Food Chem,2001,49:2992-2997.
[18]Byun HG,Kim SK.Structure and activity of angiotensin I converting enzyme inhibitory peptides derived from Alaskan Pollack skin[J].Biochem Mol Biol,2002,35:239-243.
[19]王雪飞.酶法制备米糠分离蛋白的研究[D].哈尔滨:东北农业大学,2003.
