PTEN下调 paxillin的表达抑制胃癌转移
2012-03-09于红刚
邹 荣,于红刚,周 巍
武汉大学人民医院消化内科,湖北武汉430060
胃癌是消化道最常见的恶性肿瘤,其浸润和转移是影响患者疗效及预后并导致死亡的重要因素,因此,探讨胃癌的侵袭和转移是目前研究工作的一个重要方面。与张力蛋白同源的第10号染色体丢失的磷酸酶基因PTEN是一种具有双重磷酸酶活性的抑癌基因,PTEN基因的突变、缺失、失活在原发性和转移性肿瘤中发生率较高,失活是因为启动子甲基化沉默导致的[1]。Paxillin是一种黏着斑信号蛋白,作为一种接头蛋白在细胞内发挥作用,主要参与肿瘤的侵袭和转移[2-3]。目前国内外将PTEN与paxillin联合起来研究的文章并不多,且采用免疫印迹和免疫荧光技术探讨PTEN与paxillin的关系更是少见,本文通过此两种研究方法探讨PTEN与paxillin在胃癌发生、发展中的作用,为寻求新的临床治疗提供理论依据。
1 材料与方法
1.1 材料及试剂 人胃癌细胞株BGC823(购于上海中科院),胎牛血清(GIBCO公司),1640(GIBCO公司),RIPA裂解液(碧云天生物技术有限公司),小鼠抗人paxillin单克隆抗体(购于ABcom公司),小鼠抗人PTEN单克隆抗体(购于美国Santa Cruz公司),兔抗人β-actin单克隆抗体(购于美国Santa Cruz公司),辣根过氧化物酶标记的羊抗兔IgG或羊抗鼠IgG(购于美国Santa Cruz公司),质粒抽提试剂盒(OMEGA公司),碧云天BCA蛋白浓度测定试剂盒(增强型)。质粒pEAK8和pEAK8-PTEN由李宏宇教授(沈阳军区总医院消化科)惠赠。
1.2 方法
1.2.1 瞬时转染质粒pEAK8及pEAK8-PTEN:以大肠杆菌E.coli为载体扩增质粒,按照质粒抽提试剂盒说明书提取质粒,于紫外分光光度计下测定质粒浓度,细胞饥饿12 h后,利用脂质体介导法将质粒和脂质体(LipofectamineTM2000,购于invitrogen公司)按说明书操作加入到培养瓶,细胞培养48 h后提蛋白。
1.2.2 Western blot检测PTEN、paxillin及actin(内参)蛋白水平的表达:BCA法测定蛋白浓度。加入上样缓冲液后煮沸蛋白使蛋白变性;10 μg体积的蛋白样品经SDS-PAGE凝胶电泳,将蛋白湿转至硝酸纤维素膜上;10%脱脂牛奶封闭;一抗(小鼠抗人PTEN单克隆抗体1∶750稀释、小鼠抗人paxillin单克隆抗体1∶1 000稀释、兔抗人β-actin单克隆抗体1∶1 000稀释)4℃孵育过夜;TBST洗5 min,3次;二抗(HRP-偶联的羊抗兔IgG或羊抗鼠IgG)孵育1 h(1∶1 500稀释);TBST洗3次,每次10 min;化学发光法定影显影后用数码成像系统对胶片进行扫描,利用Quanity One软件对条带的灰度值进行分析。
1.2.3 免疫荧光检测paxillin在细胞内的定位:将瞬转pEAK8和pEAK8-PTEN质粒的BGC细胞以3×105种入置有盖玻片的六孔板内培养至细胞融合达60%~70%,4%多聚甲醛固定30 min后去固定液,PBS洗涤3次;加入0.2%Triton 100(透膜)静置10 min,PBS洗涤3次;5%BSA封闭30 min;一抗(小鼠抗人paxillin单克隆抗体1∶100稀释)4℃孵育过夜;PBS洗3次;二抗(TexRed荧光标记,购自Santa Cruz公司)孵育1 h;PBS洗5 min,3次;DAPI(Santa Cruz公司)染色2 min;PBS洗5 min,3次。荧光显微镜下观察。
1.3 统计学分析 采用SPSS 13.0统计软件对数据进行处理,不同组间灰度值差异可用单因素方差分析检验,PTEN与paxillin的相关关系用Spearman秩相关进行分析,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 W estern blot检测 如图1所示,胃癌细胞中实验组[pEAK8-PTEN-BGC823(pE-P-B)]与对照组[空白对照BGC823(BGC823)、阴性对照pEAK8-BGC823 (pE-B)]相比,PTEN蛋白水平的表达明显升高,而paxillin蛋白的表达明显受到抑制。表1中各组数据以均数±标准差(±s)表示,实验组与对照组差异均有统计学意义(P<0.05),空白对照与阴性对照组中PTEN与 paxillin的表达差异无统计学意义(P>0.05)。PTEN与paxillin两者呈负相关(r=-0.12,P<0.05)。actin用于显示上样量一致。
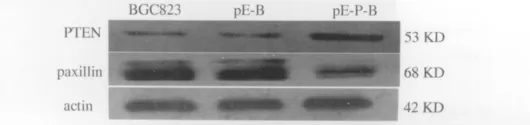
图1 W estern blot检测PTEN、paxillin、actin蛋白的表达Fig 1 The protein expression of PTEN,paxillin and actin detected by W estern blot
表1 PTEN和paxillin蛋白的表达(±s)Tab 1 The protein expression of PTEN and paxillin(±s)
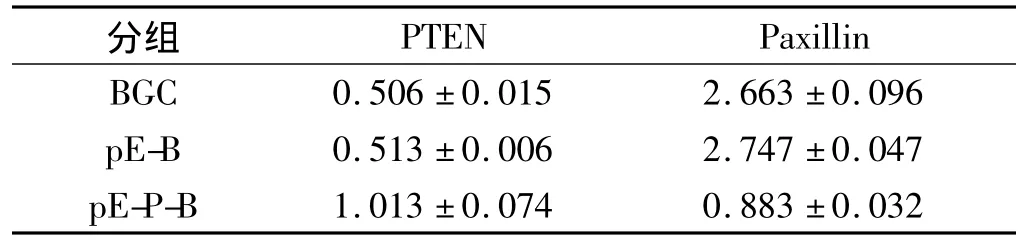
表1 PTEN和paxillin蛋白的表达(±s)Tab 1 The protein expression of PTEN and paxillin(±s)
分组PTEN Paxillin BGC 0.506±0.015 2.663±0.096 pE-B 0.513±0.006 2.747±0.047 pE-P-B 1.013±0.074 0.883±0.032
2.2 免疫荧光 如图2所示:胃癌细胞核呈蓝色,paxillin位于细胞膜上呈红色(箭头所示),在细胞伸出伪足处聚集。
3 讨论
PTEN(phosphatase and tensin homolog deleted on chromosome 10)基因是1997年发现并命名的一个抑癌基因,定位于染色体10q23,具有脂质磷酸酶活性和蛋白磷酸酶活性。其主要功能是通过脂质磷酸酶活性调控磷脂酰肌醇3-激酶/蛋白激酶B(phosphoinositide 3-kinase/AKT,PI3K/AKT)通路活性,而PI3K/AKT信号传导通路的激活被认为是肿瘤细胞抗凋亡的主要机制之一。其蛋白磷酸酶活性可使粘着斑激酶(focal adhesional kinase,FAK)蛋白去磷酸化继而抑制细胞的运动和侵袭能力[2,4]。PTEN蛋白可通过多种信号途径调控细胞的增殖、凋亡、运动、侵袭、转移等多种生物学行为[5-7]。PTEN基因在多种恶性肿瘤中可发生突变和缺失,导致肿瘤细胞运动、侵袭和转移能力增强[8-10]。在神经胶质瘤、子宫内膜癌、前列腺癌、膀胱癌、肺癌、乳腺癌、胃癌等都有检测到PTEN基因的突变和缺失。本研究结果显示:转染质粒GFP的BGC细胞与空白对照BGC细胞相比,PTEN与paxillin蛋白水平的表达无明显差异,说明GFP质粒对胃癌细胞中的蛋白的生成未产生明显影响,只是使细胞能发出绿色荧光;共转质粒GFP与PTEN的BGC细胞PTEN的表达明显高于阴性对照组GFP-BGC细胞和空白对照组BGC细胞,而paxillin的表达明显低于后两者,表明PTEN可下调胃癌细胞中paxillin的表达,与杨丽敏等[11]研究发现PTEN与paxillin的表达呈负相关结论相同。
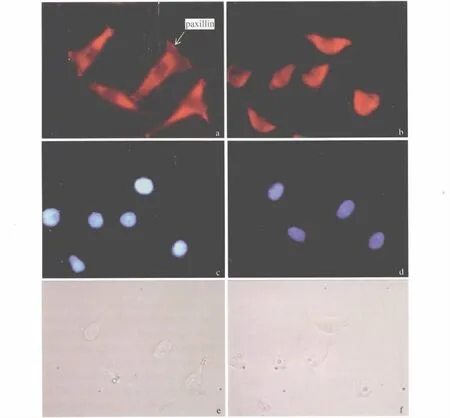
图2 免疫荧光检测paxillin在细胞内的定位(400×)a、c、e:pEAK8-BGC823;:b、d、f:pEAK8-PTEN-BGC823Fig 2 The location of paxillin inside cell detected by immunofluorescence(400×)
paxillin是一个分子量为68 KD的黏着斑信号蛋白,是一种重要的细胞黏附分子,主要定位于黏着斑。paxillin分子中含有多种结构域,包括氨基端起蛋白识别作用的5个LD结构域和富含脯氨酸的SH3结构域;羧基端介导蛋白与蛋白之间的相互作用的4个串联的LIM结构域,这些结构使paxillin能够和一系列的信号蛋白和结构蛋白结合,成为介导细胞信号转导的重要位点。作为一种接头蛋白,paxillin能将信号从细胞外经整合素途径向细胞内传递,是细胞骨架与胞外基质连接不可缺少的联系纽带。paxillin可通过重排肌动蛋白的细胞骨架,以及与整合素相互作用来调节细胞的黏附和运动[12]。细胞的运动是细胞因子或趋化因子引导、肌动蛋白的聚合、新的黏着斑不断形成和尾端黏着斑协调性解聚的多步骤的动态过程[13-14],多项研究表明paxillin可动态调节黏着斑、调节细胞的运动、播散和转移[15-17],从而提高肿瘤细胞的转移和侵袭能力。本研究中,免疫荧光结果显示 paxillin在GFP-BGC细胞伸出伪足处聚集,而在GFP-PTEN-BGC中未见明显表达。伪足能诱导肌动蛋白重组,形成细胞突起,起到黏附和运动作用[18]。paxillin在伪足聚集,更能促进有伪足形成的癌细胞运动。而此结果也说明PTEN可抑制paxillin的表达,进一步抑制胃癌细胞的转移。
正如本研究发现PTEN可以调节paxillin的表达一样,Herlevsen等[19]也提到PTEN与paxillin有一定的作用关系,但具体通过何种途径作用目前仍不是很清楚。也有研究发现在PTEN的共沉淀物中能检测到paxillin的沉着[20]。PTEN可通过蛋白磷酸酶活性调节FAK的去磷酸化,而paxillin可以作为FAK/Src信号通路的下游信号被磷酸化激活[21],因此PTEN通过FAK而间接调节paxillin的表达也是有可能的。研究表明PPARγ激动剂能上调PTEN的磷酸化,进而可能导致 FAK和 paxillin的磷酸化[22]。目前将 PTEN、FAK、paxillin三者一起研究的国内外文献甚少,而PTEN调节作为信号传导重要位点的paxillin的表达可能还存在其他的信号转导途径,但其调节机制仍有待进一步研究。
综上所述,本研究采用了免疫印迹及免疫荧光的方法将PTEN及paxillin联合起来研究,证实了PTEN和paxillin都参与了胃癌的发生和发展,同时过表达PTEN和低表达paxillin影响着胃癌细胞的运动和转移,然而有关PTEN对paxillin蛋白表达的调节机制尚不清楚,具体机制有待下一步的继续研究。
[1]Carnero A,Blanco-Aparicio C,Renner O,et al.The PTEN/PI3K/ AKT signalling pathway in cancer,therapeutic implications[J].Curr Cancer Drug Targets,2008,8(3):187-198.
[2] Gupta A,Dey CS.PTEN and SHIP2 regulates PI3K/Akt pathway through adhesion kinase[J].Mol cell Endocrinol,2009,309(1-2): 55-62.
[3]Verma A,Guha S,Wang H,et al.Tissue transglutaminase regulates focal adhesion kinase/AKT activation by modulating PTEN expression in pancreatic cancer cells[J].Clin Cancer Res,2008,14(7): 1997-2005.
[4]Bahk YY,Cho IH,Kim TS.A cross-talk between oncogenic Ras and tumor suppressor PTEN through FAK Tyr861 phosphorylation in NIH/ 3T3 mouse embryonic fibroblasts[J].Biochem Biophys Res Commun,2008,377(4):1199-1204.
[5]Heo JY,Kim HJ,Kim SM,et al.Embelin suppresses STAT3 signaling,proliferation,and survival of multiple myeloma via the protein tyrosine phosphatase PTEN[J].Cancer Lett,2011,308(1):71-80.
[6]Zhiyong C,Wentong L,Xiaoyang Y,et al.PTEN’s regulation of VEGF and VEGFR1 expression and its clinical significance in myeloid leukemia[J].Med Oncol,2011,[Epub ahead of print].
[7] Arafa el-SA,Zhu Q,Shah ZI,et al.Thymoquinone up-regulates PTEN expression and induces apoptosis in doxorubicin-resistant human breast cancer cells[J].Mutat Res,2011,706(1-2):28-35.
[8]Hou G,Lu Z,Liu M,et al.Mutational analysis of the PTEN gene and its effects in esophageal squamous cell carcinoma[J].Dig Dis Sci,2011,56(5):1315-1322.
[9]Bowen KA,Doan HQ,Zhou BP,et al.PTEN loss induces epithelialmesenchymal transition in human colon cancer cells[J].Anticancer Res,2009,29(11):4439-4449.
[10]Heering J,Erlmann P,Olayioye MA.Simultaneous loss of the DLC1 and PTEN tumor suppressiors enhances breast cancer cell migration[J].Exp Cell Res,2009,315(15):2505-2514.
[11]Yang LM,Wang J.The expression and clinical signification of paxillin,FAK and PTEN in tissue of gastric adenocarcinoma[J].Chin J Gastroenterol,2009,14(12):734-737.
杨丽敏,王进.Paxillin、FAK和PTEN在胃腺癌组织中的表达及临床意义[J].胃肠病学,2009,14(12):734-737.
[12]Nogalski MT,Chan G,Stevenson EV,et al.Human cytomegalovirusregulated paxillin in monocytes links cellular pathogenic motility to the process of viral entry[J].J Virol,2011,85(3):1360-1369.
[13]Pollard TD,Borisy GG.Cellular motility driven by assembly and disassembly of actin filaments[J].Cell,2003,112(4):453-465.
[14]Conway WC,Van der Voort van Zyp J,Thamilselvan V,et al.Paxillin modulates squamous cancer cell adhesion and is important in pressure-augmented adhesion[J].J Cell Biochem,2006,98(6):1507-1516.
[15]Deakin NO,Turner CE.Distinct roles for paxillin and Hic-5 in regulating breast cancer cell morphology,invasion,and metastasis[J].Mol Biol Cell,2011,22(3):327-341.
[16]Metalli D,Lovat F,Tripodi F,et al.The insulin-like growth factor receptor I promotes motility and invasion of bladder cancer cells through Akt-and mitogen-activated protein kinase-dependent activation of paxillin[J].Am J Pathol,2010,176(6):2997-3006.
[17]Schaller MD.Paxillin:a focal adhesion-associated adaptor protein[J].Oncogene,2001,20(44):6459-6472.
[18] Zhou FZ.The developed study of cell pseudopodia in metastasis of cancer[J].Journal of Clinical Cancer Medicine,2007,12(1):77-79.
周方正.细胞伪足与肿瘤转移研究进展[J].临床肿瘤学杂志,2007,12(1):77-79.
[19]Herlevsen M,Oxford G,Ptak C,et al.A novel model to identify interaction partners of the PTEN tumor suppressor gene in human bladder cancer[J].Biochem Biophys Res Commun,2007,352(2): 549-555.
[20]Haier J,Nicolson GL.PTEN regulates tumor cell adhesion of colon carcinoma cells under dynamic conditions of fluid flow[J].Oncogene,2002,21(9):1450-1460.
[21]Van Slambrouck S,Jenkins AR,Romero AE,et al.Reorganization of the integrin alpha2 subunit controls cell adhesion and cancer cell invasion in prostate cancer[J].Int J Oncol,2009,34(6): 1717-1726.
[22]Chen Y,Wang SM,Wu JC,et al.Effects of PPAR gamma agonists on cell survival and focal adhesions in a Chinese thyroid carcinoma cell line[J].J Cell Biochem,2006,98(4):1021-1035.
