生物转化生产D-塔格糖的食品级菌种选育及L-阿拉伯糖异构酶的克隆表达
2012-02-26门燕朱玥明管于平张同存何森健孙媛霞
门燕,朱玥明,管于平,张同存,何森健,孙媛霞
1 天津科技大学生物工程学院,天津 300457
2 中国科学院天津工业生物技术研究所,天津 300308
远在公元前 16世纪,中国就会利用微生物酿酒,微生物发酵方法至今仍应用于食品加工中,如醋、酱油、酸奶等制造业。该类微生物 被 称 为 食 品 级 微 生 物 (Food-grade microorganisms),属于一般公认安全 (Generally recognized as safe,GRAS) 微生物范畴。这类食品级微生物主要有:真菌中的曲霉菌和酵母菌,细菌中的乳酸菌和枯草芽胞杆菌等[1],这些微生物在食品工业中得到了越来越广泛的应用。
D-塔格糖 (D-果糖同分异构体) 是目前被发现的一种新型的低热量的功能性甜味剂[2]。D-塔格糖的味道和口感与蔗糖相似,但是 D-塔格糖的热量值仅有7.3 kJ/g,只占蔗糖能量的30%[3]。对于血糖医学指数的研究表明,D-塔格糖不会引起血液中葡萄糖水平的增加,因此D-塔格糖的使用对于糖尿病患者是安全的[4-5];不同于蔗糖,它不会促进蛀牙生长,并具有抑制龋齿、牙龈炎、消除口臭及洁齿等作用[6-7]。2001年美国食品与药物管理局 (FDA) 确定 D-塔格糖为普遍公认安全食品 (GRAS)[8]。
L-阿拉伯糖异构酶 (L-arabinose isomerase,L-AI) 是一种能够催化 L-阿拉伯糖转化为 L-核酮糖的异构化酶,由于D-半乳糖和L-阿拉伯糖在结构上具有一定的相似性,其在C3、C4的位置上均有一个 L-型顺式羟基结构,因此在体外L-AI能使D-半乳糖转化为D-塔格糖[3,9-11]。由此可见L-AI是实现生物法生产D-塔格糖的重要生物催化剂[12]。
研究发现,L-AI对D-塔格糖的转化率随反应温度的升高而增加,因此以往筛选得到的多来源于嗜热菌,例如嗜热杆菌Thermoanaerobacter mathrani[13],嗜热脂肪芽胞杆菌 Bacillus stearothermophilus US100[14]等。但这些嗜热菌及其来源基因的食品安全性受到质疑,研究学者开始筛选食品级微生物开展转化生产D-塔格糖的研究,Cheetham等[15]利用盖氏乳杆菌Lactobacillus gayonii代谢产生 L-阿拉伯糖异构酶成功转化半乳糖生成塔格糖,第一次提出利用乳酸菌生产塔格糖的设想。Chouayekh,Zhang H等[16-17]利用来自于植物乳杆菌 Lactobacillus plantarum 的L-AI的基因克隆表达进行半乳糖的转化成为塔格糖。Rhimi等[18]在食品级基础上克隆表达了来自于米酒乳杆菌Lactobacillus sakei 23K的耐酸L-AI基因,利用酶法转化生成了塔格糖。还有2011 年来源于发酵乳杆菌 Lactobacillus fermentum[19]等食品级菌株L-AI的应用的报道。
本研究通过食品级菌种的筛选,从各种酸奶泡菜制品中筛选出一株产 L-AI的菌株,将其L-AI基因克隆,构建质粒,并成功表达了具有生物活性的重组L-AI,利用微生物酶法转化生成塔格糖,为更进一步通过定点突变和基因重组的手段研究生物转化法制备 D-塔格糖提供新材料,开拓新途径。
1 材料与方法
1.1 材料
1.1.1 样品采集与培养基
从各种酸奶制品、泡菜以及其他一些食品中采集不同的样品,将上述样品培养在MRS固体培养基平板上,涂布、划线分离。
1) 改良肉汤培养基 (MRS)[20]:蛋白胨l0.0 g;牛肉膏10.0 g;酵母粉5.0 g;乙酸钠5.0 g;柠檬酸三铵 2.0 g;磷酸氢二铵 2.0 g;MgSO4·7H2O:0.58 g;MnSO4·H2O∶0.25 g;吐温-80 1 mL;蒸馏水1000 mL;葡萄糖2%,为避免葡萄糖高温灭菌时发生一定程度的焦化,配制培养基时,单独将其配置成20%的糖溶液。待培养基完全溶解,调pH至6.2~6.6。
2) 平板及斜面培养基:MRS培养基中添加20 g/L琼脂。
1.1.2 菌种与质粒
作为质粒克隆的宿主菌大肠杆菌Escherichia coli DH5α、目的基因表达的宿主菌E. coli BL21为本实验室保存;克隆以及表达载体pET-21a (+)购自Novagen公司。
1.1.3 生化试剂
PCR引物由华大基因合成 (表1);细菌基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、普通质粒小提试剂盒购自天根生化科技有限公司;T4 DNA连接酶、BamHⅠ、Hind Ⅲ限制性内切酶购自于宝生物工程有限公司。

表1 16S rDNA通用引物序列和PCR扩增L-AI的引物序列Table 1 The general primers of 16S rDNA and PCR amplification primers of L-AI gene
1.2 方法
1.2.1 菌种初筛
将筛得的菌株,分别接种到装有100 mL的MRS液体培养基中,37 ℃静置培养12 h,将发酵液等量分装于 2个离心管中,其中一管离心20 min (4 ℃,12 000 r/min) 获得菌体,悬浮于2 mL ddH2O中,超声破碎5 min后,离心去除细胞碎片,取上清液 (即为粗酶液) 进行酶反应。酶促反应条件为:取500 μL粗酶液与500 μL 1%D-半乳糖,35 ℃反应过夜。
另一管未做细胞破碎的菌体离心弃上清后直接进行酶反应。酶反应条件为:加入500 μL 1%D-半乳糖液以及500 μL ddH2O,35 ℃反应过夜。同时进行对照实验。
酶反应结束后,加热至95 ℃、5 min终止反应,采用半胱氨酸-咔唑法[21]进行显色反应。
1.2.2 乳酸菌的生理生化鉴定
将筛得的菌株根据参考文献[22]所列乳酸菌种鉴定方法进行鉴定。
1.2.3 16S rDNA克隆及系统进化树的建立
以基因组DNA为模板,利用16S rDNA基因的通用引物 (Lac-F、Lac-R),进行PCR扩增。将扩增获得的PCR产物进行序。
PCR 扩增条件为:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃延伸5 min,4 ℃保存。
1.2.4 Pediococcus pentosaceus PC-5 L-AI基因序列扩增
根 据 NCBI 基 因 库 中 Pediococcus pentosaceus ATCC 25745 (GenBank Accession No. CP000422.1) 菌中的L-AI基因序列设计引物(PPAI-F、PPAI-R),上下游引物 5'端分别引入BamHⅠ和Hind Ⅲ酶切位点。
PCR扩增条件为:94 ℃预变性10 min;94 ℃变性30 s,55 ℃退火60 s,72 ℃延伸90 s,30个循环,72 ℃延伸5 min,4 ℃保存。
1.2.5 Pediococcus pentosaceus PC-5 L-AI基因表达质粒的构建
纯化后的L-AI的PCR基因片段和表达载体pET-21a (+) 用限制性内切酶BamHⅠ和Hind Ⅲ分别进行双酶切反应。回收后的目的片段与载体用T4 DNA连接酶在4 ℃连接过夜,连接产物转化至E. coli DH5α感受态中进行克隆,PCR筛选阳性克隆,双酶切鉴定,挑取阳性转化子转入E. coli BL21进行诱导表达,并将重组质粒送华大基因测序。
1.2.6 重组L-AI的诱导表达
挑取阳性菌落E. coli BL21 (pET-PPLAI)接入 3 mL LB-Amp培养基 (Amp终浓度为100 mg/L) 中,37 ℃、200 r/min培养过夜,将上一步活化的菌接种至 100 mL LB-Amp培养基(Amp终浓度为100 mg/L) 中,37 ℃培养3~4 h至OD600约0.6~0.8,即细菌生长对数期,加入IPTG (终浓度0.5 mmol/ L) 诱导表达,分别以37 ℃、200 r/min培养3 h,30 ℃、150 r/min培养6 h,20 ℃、100 r/min培养过夜。
收集诱导后的菌体,4 ℃、12 000 r/min离心10 min,弃去上清,并用ddH2O洗涤菌体2次,4 ℃、12 000 r/min离心10 min,弃去上清,用2 mL ddH2O悬浮,并在冰上超声破碎细胞,离心20 min,取上清液50 μL,加入50 μL 2×SDS上样缓冲液,用于SDS-PAGE检测。同时将只含有pET-21a (+) 的E. coli BL21进行以上实验操作作为对照。
1.2.7 重组L-AI粗酶的酶活检测
L-AI的活性通过D-塔格糖生成的含量来测定。在标准条件下,反应体系包括:1%D-半乳糖,0.5 mmol/L CoCl2,1 mmol/L MnCl2,300 μL粗酶,用 ddH2O补足至 1 mL (对照反应不加MnCl2测酶活力)。酶促反应在30 ℃、40 ℃恒温下过夜,在100 ℃水浴中处理5 min灭活酶的活性停止反应。生成的D-塔格糖的含量采用HPLC高效液相色谱法。安捷伦高效液相色谱仪1200,分析柱:Waters Sugar Pak1,流动相:去离子水,柱温80 ℃,流速0.5 mL/min,进样量20 μL,检测器:示差检测器。
2 结果与分析
2.1 菌种初筛结果
采用半胱氨酸-咔唑法,对筛出的20株菌株进行显色反应。对于菌体超声破碎获得的上清液进行的酶反应,通过颜色比较,显色结果并不理想,但在分光光度计测出在560 nm下有一株菌显示较小的吸光值,显示出弱的L-AI活性,将其初步确定为具有产塔格糖能力的菌株,命名为PC-5菌株;对于所有用全细胞进行的酶促反应来说,均没有检测到酶活。
2.2 菌株的细胞形态及生理生化鉴定
菌株在液体MRS培养基中37 ℃静置培养12 h,细菌生长状况良好,菌体呈白色,并沉降在培养基的底部。菌体在固体 MRS培养基中37 ℃倒置培养48 h,菌落圆形,白色扁平,边缘圆整。由革兰氏染色结果可知,该PC-5菌株为革兰氏阳性菌,细胞形状呈球形,呈片状排列,直径0.8~1.0 μm。同时,在表2中也比较了PC-5菌株与相关菌株的生理生化特性,其结果显示PC-5菌株与P. pentosaceus[22]的相关生理生化特征较为相似,接触酶均为阴性;不能水解淀粉;明胶液化实验结果均为阴性;均可利用葡萄糖、麦芽糖、乳糖、果糖、半乳糖、阿拉伯糖、柳醇作为碳源。据此鉴定PC-5菌株属于片球菌属。
2.3 菌株16S rDNA基因测序及系统进化树
通过分析测定获得该片段序列,利用BLAST软件将该序列与美国国家生物信息中心(NCBI) 收录的DNA序列进行比对,基于相关菌株16S rDNA序列构建系统发育树 (图1)。结果表明,PC-5菌株16S rDNA序列与Pediococcus pentosaceus属的相似性最高。根据16S rDNA序列分析结果,结合其形态和生理生化特性,该菌被鉴定为Pediococcus pentosaceus,并将该菌株命名为Pediococcus pentosaceus PC-5。
2.4 PC-5菌L-AI基因的扩增
从 NCBI上查得 Pediococcus pentosaceus ATCC 25745 (GenBank Accession No. CP000422.1) 此菌株含有表达L-AI的基因序列,根据该序列设计引物,则以PC-5菌基因组为模板,PCR扩增L-AI基因。从PC-5菌中扩增出大小约为1 400 bp的DNA片段,与L-AI基因的已知大小相符。

表2 PC-5菌株及相关菌株的特征比较Table 2 Comparison of the phenotypic characteristics of strain PC-5 and the related strains
2.5 L-AI基因表达质粒的构建与验证
重组质粒经 BamHⅠ和 Hind Ⅲ双酶切验证与菌落 PCR验证,结果均获得目的基因片段1 400 bp左右 (图2、3),表明含L-AI基因的原核表达质粒构建成功。测序结果显示,Pediococcus pentosaceus PC-5菌株的L-AI序列结果显示目的基因片段的大小为1 426 bp,与预期结果一致。将该基因序列提交至GenBank,获取登录号为:JN377428。
2.6 重组L-AI基因的诱导表达结果
将重组质粒pET-PPLAI转入表达载体E. coli BL21,选取阳性菌落加入IPTG进行诱导表达,同时,利用相同条件培养含有 pET-21a (+) 的E. oli BL21作为对照。
实验结果表明,E. coli BL21 (pET-PPLAI)培养液在加入IPTG后,20 ℃、100 r/min过夜培养为最佳诱导表达条件,由 SDS-PAGE可知(图4),重组蛋白粗提物在58 kDa 附近有一明显的特异性条带,对照菌的蛋白粗提物在该位置无明显条带。在此条件下重组蛋白以可溶性形式存在,几乎没有包涵体的生成。利用DNAMAN软件计算出实际PPLAI理论值为54 kDa,与预期结果几乎为一致。
2.7 重组L-AI粗酶的酶活
将重组L-AI进行酶促反应后,由HPLC检测反应结果,在1% D-半乳糖,300 μL粗酶提取物的反应体系下,未加Mn2+的反应体系结果在 16.49 min没有峰出现 (D-塔格糖的保留时间),该结果与以往多数文献报道中指出“在没有金属离子存在的情况下,L-AI一般是没有或者极低地显示出异构化 D-半乳糖的活性[23]”,“L-AI多数依赖Co2+、Mn2+作为辅因子增强其酶活力及热稳定性[14]”的结果一致,金属离子Mn2+的摄入对于重组L-AI的酶促反应的进行是必需的。由色谱图分析可见 (图 5),从Pediococcus pentosaceus PC-5获得的L-AI具有催化D-半乳糖转化为D-塔格糖的能力,且转化率随反应温度的增加而提高,30 ℃、40 ℃反应过夜 12 h,底物 1%D-半乳糖转化率分别约为30%和33%。
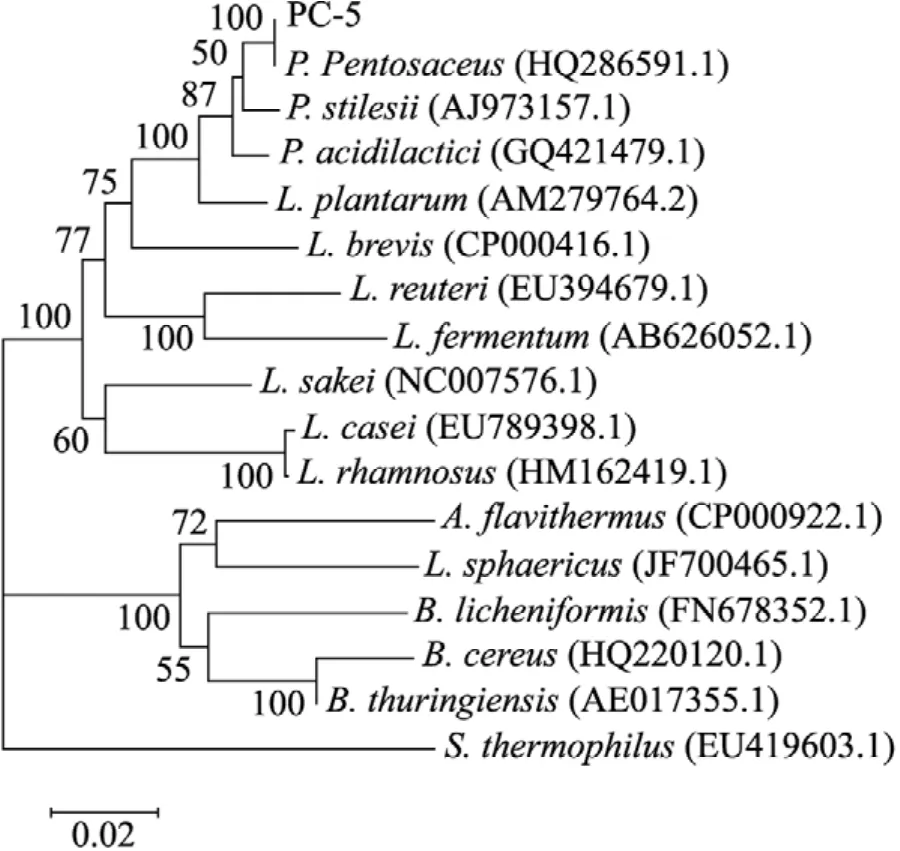
图1 PC-5菌株与其他细菌的系统进化树Fig. 1 Phylogennetic relationships of 16S rDNA gene of PC-5 and related species.

图2 重组pET-PPLAI的酶切验证Fig. 2 Identification of positive plasmid of pET-PPLAI by enzyme digestion. M: DNA marker; 1: L-AI; 2: pETPPLAI; 3: pET-21a (+).

图3 重组pET-PPLAI的PCR验证Fig. 3 Identification of positive plasmid of pET-PPLAI by PCR. M: DNA marker; 1: PCR product of pET-PPLAI; 2: PCR product of pET-21a (+).

图4 重组质粒pET-PPLAI在E. coli BL21中的表达Fig. 4 SDS-PAGE analysis of recombinant proteins expressed in E. coli BL21. M: protein markers; 1: total cell (pET-21a (+) without IPTG); 2: total cell (pET-21a (+) with IPTG); 3: supernatant (pET-21a (+)); 4: precipitation (pET-21a (+)); 5: total cell (pET-PPLAI without IPTG); 6: total cell (pET-PPLAI with IPTG); 7: supernatant (pET-PPLAI); 8: precipitation (pET- PPLAI).
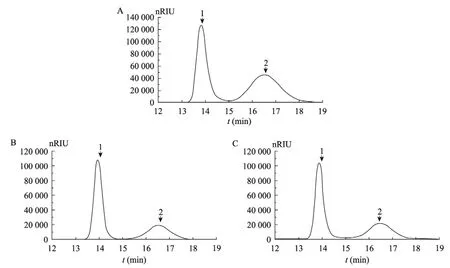
图5 HPLC分析D-塔格糖的产量Fig. 5 HPLC analysis of the D-tagatose production. (A) Standard solution of D-galactose and D-tagatose at 10 g/L. (B) Isomerization products after 12 h of reaction at 30 °C. (C) Isomerization products after 12 h of reaction at 40 °C. 1: D-Galactose with a retention time of 13.81 min; 2: D-tagatose with a retention time of 16.49 min.
3 结论
本研究采用了半胱氨酸咔唑法初步筛选出具有转化生产塔格糖能力的食品级菌株,确定为戊糖片球菌,并将其L-AI基因在E. coli BL21异源表达。经 IPTG 诱导表达后, 约在58 kDa处明显出现目的蛋白条带,与预期结果几乎相符,由SDS-PAGE电泳结果可知,在此条件下重组蛋白以可溶性形式存在,几乎没有包涵体的生成。在温度40 ℃,1%底物、300 μL粗酶的条件下反应过夜,以半乳糖为底物转化为塔格糖,转化率可以达到33%。目前,利用食品级菌株微生物酶法将半乳糖转化为塔格糖,在食品工业上广泛应用。对此,我们将由戊糖片球菌获得的重组酶的纯化以及提高塔格糖的产率作为下一步工作的重点方向。
[1] Wu K. Food-grade Microorganism. Beijing: Chemical Industry Press (CIP), 2008.吴坤. 食品微生物. 北京: 化学工业出版社, 2008.
[2] Levin GV. Tagatose, the new GRAS sweetener and health product. J Med Food, 2002, 5(1): 23−36.
[3] Levin GV, Zehner LR, Saunders JP, et al. Sugar substitutes: their energy values, bulk characteristics, and potential health benefits. Am J Clin Nutr, 1995, 62(Suppl 5): 1161S−1168S.
[4] Donner TW, Wilber JF, Ostrowski D. D-tagatose, anove1 hexose: acute effects on carbohydrate tolerance in subjects with and without type 2 diabetes. Diabetes Obes Metab, 1999, 1: 285–291. [5] Seri K, Sanai K, Negishi S, et al. Prophylactic and remedial preparation for diseases attendant on hyperglycemia, and wholesome food: EP, 0560284, 1997-09-07.
[6] Iida T, Ichihara T, Izumori K, et al. Noncarious material and anticarious gent containing rare sugar: EP, 2098227, 2009-09-09.
[7] Lu Y, Levin GV, Donner TW. Tagatose, a new antidiabetic and obesity control drug. Diabetes Obes Metab, 2008, 10(2): 109−134.
[8] FDA. Food labeling: health claims; D-tagatose and dentalcaries. Final rule. Fed Regist, 2003, 68(128): 39831−39833.
[9] Yoon SH, Kim P, Oh DK. Properties of L-arabinose isomerase from Escherichia coli as biocatalyst for tagatose production. World J Microbiol Biotechnol, 2003, 19(1): 47−51.
[10] Kim BC, Lee YH, Lee HS, et al. Cloning, expression and characterization of L-arabinose isomerase from Thermotoga neapolitana: bioconversion of D-galactose to D-tagatose using the enzyme. FEMS Microbiol Lett, 2002, 212(1): 121−126.
[11] Kim HJ, Ryu SA, Kim P, et al. A feasible enzymatic process for D-tagatose production by an immobilized thermostable L-arabinose isomerase in a packed-bed bioreactor. Biotechnol Prog, 2003, 19(2): 400−404.
[12] Roh HJ, Yoon SH, Kim P. Preparation of L-arabinose isomerase originated from Escherichia coli as a biocatalyst for D-tagatose production. Biotechnol Lett, 2000, 22(3): 197–199.
[13] Jørgensen F, Hansen OC, Stougaard P. Enzymatic conversion of D-galactose to D-tagatose: heterologous expression and characterisation of a thermostable L-arabinose isomerase from Thermoanaerobacter mathranii. Appl Microbiol Biotechnol, 2004, 64(6): 816−822.
[14] Rhimi M, Bejar S. Cloning, purification and biochemical characterization of metallic-ions independent and thermoactive L-arabinose isomerase from the Bacillus stearothermophilus US100 strain. Biochim Biophys Acta, 2006, 1760(2): 191−199.
[15] Cheetham PSJ, Wootton AN. Bioconversion of D-galactose into D-tagatose. Enzyme Microb Technol, 1993, 15(2): 105−108.
[16] Chouayekh H, Bejar W, Rhimi M, et al. Characterization of an L-arabinose isomerase from the Lactobacillus plantarum NC8 strain showing pronounced stability at acidic pH. FEMS Microbiol Lett, 2007, 277(2): 260−267.
[17] Zhang H, Jiang B, Pan BB. Purifcation and characterization of L-arabinose isomerase from Lactobacillus plantarum producing D-tagatose. World J Microbiol Biotechnol, 2007, 23: 641−646.
[18] Rhimi M, Ilhammami R, Bajic G, et al. The acid tolerant L-arabinose isomerase from the food grade Lactobacillus sakei 23K is an attractive D-tagatose producer. Bioresour Technol, 2010, 101(23): 9171−9177.
[19] Xu Z, Qing YJ, Li S, et al. A novel L-arabinose isomerase from Lactobacillus fermentum CGMCC2921 for D-tagatose production: gene cloning, purification and characterization. J Mol Catal B: Enzym, 2011, 70(1/2): 1−7.
[20] Wang FR, Xu H, Li S, et al. Screening and identification of two D-tagatose-producing strains. Food Ferment Ind, 2009, 35(8): 15−19.汪芙蓉, 徐虹, 李莎, 等. 产 D-塔格糖菌株的筛选与鉴定. 食品与发酵工业, 2009, 35(8): 15−19.
[21] Dische Z, Borenfreund E. A new spectrophotometric method for the detection and determination of keto sugars and trioses. J Biol Chem, 1951, 192(2): 583−587.
[22] Buchana RE, Gibbons NE. Bergey's Manual of Systematic Bacteriology. 8th ed. Beijing: Science Press, 1984. RE 布坎南, NE 吉本斯. 伯杰细菌鉴定手册. 8版. 北京: 科学出版社, 1984.
[23] Oh DK. Tagatose: properties, applications, and biotechnological processes. Appl Microbiol Biotechnol, 2007, 76(1): 1−8.