茶尺蠖核型多角体病毒多角体蛋白单克隆抗体的制备
2012-02-26杜军利张传溪付建玉陈正贤肖强
杜军利,张传溪,付建玉,陈正贤,肖强
1 中国农业科学院茶叶研究所,浙江 杭州 310008
2 浙江大学昆虫科学研究所,浙江 杭州 310058
3 甘肃农业大学草业学院,甘肃 兰州 730070
茶尺蠖Ectropis obliqua Prout属鳞翅目尺蛾科,是我国主要茶树害虫之一,广泛分布于长江中下游茶区,其中浙江、江苏、安徽3省发生尤为严重。其幼虫咬食嫩叶和芽头,严重发生时常将整片茶园茶树啃成光杆,对茶叶生产影响大。
茶尺蠖核型多角体病毒 (Ectropis obliqua nucleopolyhedrovirus,EoNPV) 于1977年在我国首次发现[1],属杆状病毒科,核型多角体病毒属。EoNPV是自然条件下控制茶尺蠖种群的主要病原性天敌因子,它通过幼虫取食后侵入虫体并迅速增殖,使其感染发病而死亡,进而在种群中造成病毒流行病。我国较早开展了EoNPV的生物学及应用基础研究,目前该病毒制剂已获批农药登记许可,广泛应用于浙江省及周边省区茶园。传统的EoNPV的检测依赖LT50和LC50两个生物测定参数;作者前期研究利用荧光定量 PCR方法测定茶尺蠖核型多角体病毒拷贝数,为病毒的深入研究和病毒制剂的定量检测提供了方法依据[2];进一步研究建立快速定性、定量检测EoNPV的技术对茶园昆虫病毒研发与大面积推广应用具有重要的作用。本研究通过制备获得EoNPV的单克隆抗体,该抗体能特异地与EoNPV病毒粒子蛋白结合,并建立了基于此单抗的ELISA检测方法,从而为EoNPV的准确快速检测提供技术支持。
1 材料与方法
1.1 材料
BALB/c小鼠及其饲料购自上海医科大学;茶尺蠖野生型种群采自中国农业科学院茶叶所试验茶园,并经室内继代饲养;茶尺蠖核型多角体病毒 (EoNPV) 由中国农业科学院茶叶研究所保存。弗氏完全佐剂、弗氏不完全佐剂、辣根过氧物酶标记的山羊抗鼠为 Sigma公司产品;RPMI-1640、HAT、HT培养基、PEG6000购自Gibco公司;牛血清蛋白 (BSA) 购自杭州四季青生物工程材料有限公司;其他常规试剂均为国产分析纯。小鼠骨髓瘤细胞株SP2/0引自浙江大学农业与生物技术学院生物技术研究所,用高糖的DMEM培养基传代培养。
1.2 EoNPV病毒粒子的分离纯化
收集感染EoNPV而死亡的茶尺蠖幼虫作为试虫,将其磨碎;用5层粗棉布过滤其中较大颗粒后,反复3 000~5 000 r/min离心,用1×PBS反复洗涤纯化的多角体,至乳白色为止;加入适量新配制的裂解液0.1 mol/L Na2CO3,0.05 mol/L NaCl (pH 10.3) 裂解多角体1~2 h;用50%的HCl中和碱液,3 000 r/min离心5 min,去除其中未裂解的多角体;在160 000 r/min、1.5 h超速离心,沉淀EoNPV病毒粒子;使用PBS悬浮纯化的病毒粒子,存于4 ℃冰箱待用[3-4]。
1.3 小鼠免疫
将经超速离心纯化后的茶尺蠖核型多角体病毒粒子作为抗原与等量福氏完全佐剂充分混合,经皮下多点注射BALB/c小鼠,每只200 µL,间隔14 d用含等量的福氏不完全佐剂的蛋白抗原相同剂量作第2、3次免疫,14 d后,腹腔注射不加佐剂的蛋白抗原,每只200 µL,3 d后取脾细胞用于细胞融合[5-7]。
1.4 细胞融合和克隆
在加强免疫后3 d左右获取小鼠脾细胞,将其与正处于对数生长期的骨髓瘤细胞进行融合,每次融合后,将细胞接种于96孔培养板,用含HAT的1640完全培养基选择培养10 d左右,然后将HAT改为HT培养1周[8-9]。待细胞长至显微镜视野的1/4,取培养上清用ELISA法检测抗体,将原免疫用抗原 EoNPV病毒粒子稀释100倍作为包被抗原[10-11],使用间接 ELISA方法检测获得阳性细胞;再以阴性对照 (包括 Bt生物制剂、菜青虫颗粒体病毒) 作为包被抗原对所选阳性细胞进行再筛选,最终获得的阳性细胞株只对 EoNPV病毒多角体蛋白表现阳性反应;选择最终的阳性细胞以有限稀释法进行克隆[12-14]。
1.5 阳性单克隆抗体细胞株的筛选
对克隆后检测为阳性的单克隆细胞株进行规律传代培养,并且每一代检测它们的抗体分泌情况,最终获得稳定分泌抗体的EoNPV单克隆抗体细胞株。
1.6 小鼠腹水抗体制备及效价测定
将最后筛选出的阳性单克隆杂交瘤细胞株进行扩大培养,并向小鼠腹部注射降植烷。1周后,使用生理盐水将细胞沉淀悬浮,接种于小鼠腹腔,待小鼠腹腔明显鼓胀,抽取腹水测定其抗体效价并保存于−20 ℃,用于检测[15]。
培养上清或腹水经稀释后,加到包被原包被的酶标板中,孵育、洗涤后,再加入 HRP标记的羊抗鼠IgG,底物显色。阳性对照为小鼠阳性血清,同时分别以同等稀释的Sp2/0培养上清,或无免疫小鼠血清为阴性对照,空白对照为PBS[16]。
1.7 单抗的稳定性
将分泌抗体的杂交瘤细胞株体外连续传代,或置液氮中冻存 3个月后复苏,用间接 ELISA方法检查该细胞株分泌单抗的稳定性[17]。
1.8 ph基因的克隆与原核表达
根据 EoNPV 基因组序列 (GenBank Accession No. NC_008586.1) 的ph基因[18-21],设计了一对特异性引物,EoNPV ph F:5'-GGATCCatgtatactcgttaca-3'和 EoNPV ph R:5'-CTCGAGttaatacgcaggtcct-3',扩增ph基因,PCR反应采用25 µL体系,PCR扩增程序如下:94 ℃预变性3 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s;30个循环;最后72℃延伸10 min。PCR产物用琼脂糖凝胶电泳鉴定,预测片段大小约741 bp。
扩增的产物克隆至pMD18-T克隆载体,连接产物转化TG1感受态细胞,提取质粒,经BamHⅠ和XhoⅠ双酶切的表达载体质粒pGEX-4T2,提取质粒并通过 PCR鉴定,最后得到与谷胱甘肽融合表达的载体质粒pGEX- 4T-2-ph。
将 pGEX-4T-2-ph转化至表达菌株 E. coli BL21 (DE3) 中表达,挑取单菌落于37 ℃、200 r/min条件下振荡培养过夜。次日转接5%培养液于新鲜5 mL LB培养基中,培养至OD600为0.4~0.6 (2~3 h),加入IPTG,37 ℃继续诱导培养5~8 h,分别收集菌体,用适量PBS稀释后,加入2×SDS-PAGE上样缓冲液,沸水浴5 min后,12 000 r/min离心10 min去除不溶物,取10 µL进行SDS-PAGE检测及Western blotting分析。同时,以BL21菌液和转化pGEX-4T2的诱导菌液作为对照。
1.9 Western blotting分析
多角体蛋白 (Polyhedrin,PH)、EoNPV病毒粒子、PGEX-4T-2载体蛋白样品经SDS-PAGE电泳后,分离胶及与胶相同大小的PVDF膜和3层滤纸在转移缓冲液中平衡15~20 min;将3层滤纸、分离胶、PVDF膜和3层滤纸依次装入转移夹中,以Bio-Rad转印槽半干转移,转移条件为恒电压15V 15 min;PVDF膜用封闭液 (4%脱脂奶粉) 室温封闭 1 h;加入小鼠腹水于洗涤液中稀释1 000倍,室温反应1 h或4 ℃反应过夜;PBST洗涤3~5次,每次5 min;HRP酶标的羊抗鼠二抗于洗涤液中室温反应1 h;洗涤3~5次,每次5 min;加入10 mL HRP反应底物DAB溶液覆盖于PVDF膜上显色,待阳性条带显示后,用ddH2O终止反应[22-24]。
1.10 最适工作浓度的确定
把浓度为1.5 g/L的纯化病毒从1∶100开始依次倍比稀释,稀释至1∶204 800。由左至右依次加入96孔板,置于4℃包被过夜或者37 ℃包被2 h。使用间接ELISA进行检测,当需加入一抗时,将单克隆抗体从1∶1 500开始依次倍比稀释,稀释至 1∶192 000,由上而下依次加入 96孔板。显色后置于酶标仪上读板[25-26]。
1.11 检测灵敏度的测定
感染EoNPV的虫体汁液按1∶10~1∶327 680倍比稀释,把纯化后的EoNPV病毒粒子 (1.5 g/L)使用包被液从1∶10~1∶5 120倍比稀释后,分别作为抗原,设置3个重复,并以未感染病毒的茶尺蠖虫体汁液作为阴性对照。再将上述稀释液加入反应孔中,4 ℃包被过夜,使用间接ELISA方法进行灵敏度检测[27-28]。
1.12 样品检测
获取涂抹EoNPV的叶片饲喂的茶尺蠖和健康叶片饲喂茶尺蠖各 30头,称取虫体重量。磨碎后,根据体重分别稀释10倍,进行ELISA检测。用提纯的EoNPV作阳性对照,包被液作阴性对照。
2 结果与分析
2.1 杂交瘤细胞株的建立
杂交瘤细胞培养上清的间接 ELISA的检测结果表明:以细胞培养上清对EoNPV抗原OD492值,与正常BALB/c小鼠血清对EoNPV抗原的OD450值之比大于 2.1,且杂交瘤细胞上清对 Bt的检测结果为阴性,判为阳性杂交瘤细胞。经过筛选和有限稀释法亚克隆,获得了1株阳性杂交瘤细胞,命名为7D3。
2.2 单抗的稳定性
经过连续传代冻存2个月后,将杂交瘤细胞复苏,该细胞株仍能分泌抗体,间接 ELISA检测效价和原来效价无差别,表明该杂交瘤细胞分泌抗体的稳定性较好。
2.3 杂交瘤细胞腹水效价测定
把杂交瘤细胞注射进入小鼠腹部后,获得该杂交瘤细胞的腹水。腹水先稀释100倍,而后再依次倍比系列稀释,最后使用间接 ELISA法测定OD450值,同时设立阳性阴性血清对照。杂交瘤细胞腹水的OD450值之比大于2.1时的最大稀释度即为其 ELISA效价,经检测得知该杂交瘤细胞的效价为106(图1)。

图1 细胞株7D3的抗体效价测定Fig. 1 The titres of ascitic of cell line 7D3.
2.4 用制备的单抗对病毒进行 Western blotting检测
把EoNPV进行SDS-PAGE后转移到PVDF膜,用制备的单抗为一抗,进行Western blotting检测。结果显示,在约28 kDa处有强阳性条带(图2),与SDS-PAGE上出现的多角体蛋白条带大小相近,推测所获得的单抗应是一种多角体蛋白 (PH蛋白) 单抗。
2.5 ph基因原核表达质粒的构建
为了确认获得的单抗是一种多角体蛋白单抗,进一步克隆表达多角体蛋白基因ph。首先用引物ph F、ph R从EoNPV基因组DNA中扩增出长度741 bp的ph基因,连接至pMD18-T克隆载体,测序结果与预期结果相符,使用BamHⅠ和XhoⅠ双酶切鉴定,回收片段,将其定向克隆至由 BamHⅠ和 XhoⅠ酶切过的 pGEX-4T-2载体,PCR鉴定,结果显示获得表达质粒pGEX-4T-2-ph (图3)。

图2 EoNPV的Western blotting分析Fig. 2 Western blotting analysis of EoNPV. M: protein marker; 1: virus of EoNPV.
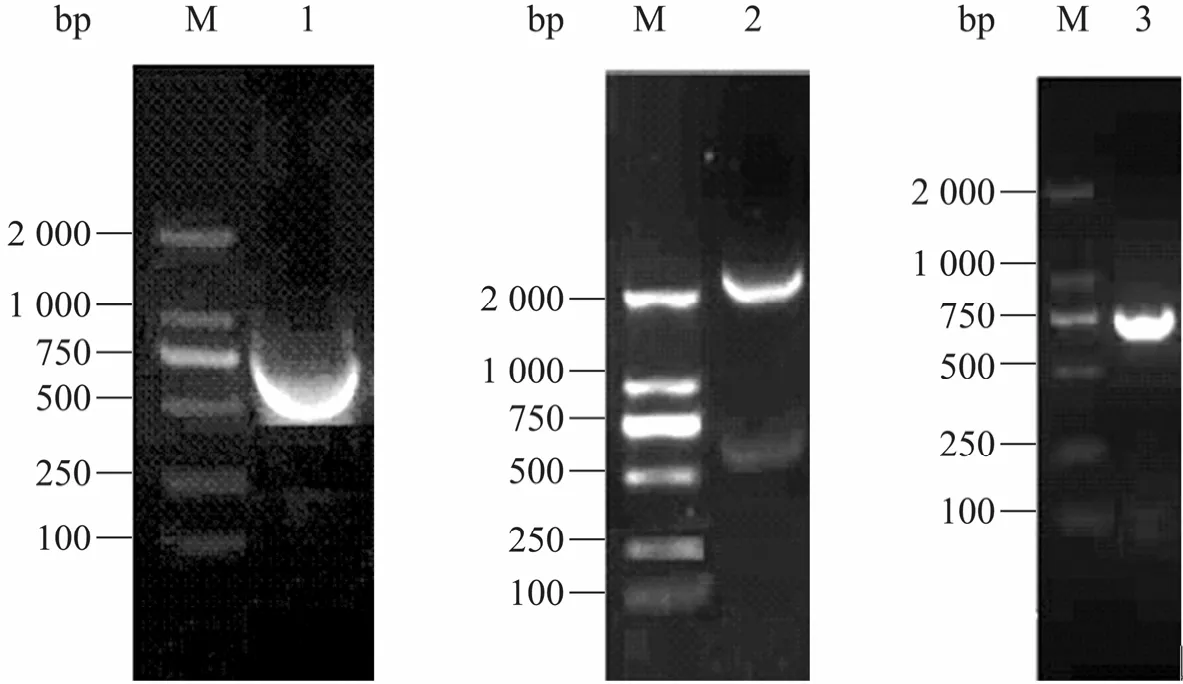
图3 ph基因原核表达质粒的构建Fig. 3 Construction of ph gene prokaryotic expression-vector plasmid. 1: PCR product of ph gene; 2: recombinant pMD18-T vector was identified by double enzyme digestion with BamH I and Xho I; 3: pGEX-4T-2-ph was identified by PCR.
2.6 ph基因的表达和Western blotting分析
表达质粒 pGEX-4T-2-ph转化大肠杆菌BL21,收集经IPTG诱导的菌体进行SDS-PAGE检测,结果表明,大约54 kDa处有明显的特异性条带 (图4),与GST和polyhedrin融合表达产物大小相符。然后使用已制备的EoNPV的单抗进行 Western blotting分析,发现该抗体与EoNPV病毒粒子和 ph基因原核表达蛋白均有特异性条带,而且蛋白大小与预期一致,同时显示阳性的还有一条分子量约为 40 kDa的条带,可能是ph基因不完全表达产物或表达产物的降解产物。而作为阴性对照的空 PGEX-4T-2载体表达产物与杂交瘤细胞的腹水无明显的条带出现 (图4)。
2.7 工作浓度的确定
检测用的EoNPV单抗腹水倍比稀释后进行间接ELISA检测,单抗在1∶192 000范围内均可用于检测,与在此范围内的阴性对照的OD值非常低,P/N值大于>8,但是在实际应用时要求有较高的灵敏度,因此我们选择单抗腹水稀释倍数为1∶6 000作为间接ELISA的最适工作浓度,另外二抗的最适浓度为1∶5 000。
2.8 检测灵敏度的确定
把感染病毒的病虫体液倍比稀释后经间接ELISA检测,从1∶10到1∶20 480都是较理想的稀释度,当稀释度为1∶10 240时,P/N<2.1,所以其检测极限为1∶5 120。纯化后的EoNPV粒子 (1.5 g/L) 及未感染的茶尺蠖虫体液倍比稀释后,进行间接 ELISA检测,7D3细胞株所得单抗对纯化的EoNPV粒子有较高的灵敏度,灵敏度可达到6 ng (图5)。由此可建立了一条标准曲线,方程为y=−0.4144x+3.0742 (R2=0.9929,图6)。该标准曲线可计算未知样品的稀释倍数 x,病毒浓度 (g/L) 即为1.5÷ (2x×100)。一般实验中都以多角体个数为病毒的单位,即 PIB/mL,通过实验得知多角体数量与g/L的换算关系为1 g/L=2.75×108PIB/mL。因此在使用图6所示公式计算出病毒的浓度后,再换算成多角体个数。

图4 SDS-PAGE和Western blotting分析结果Fig. 4 SDS-PAGE and Western blotting analysis. M: protein molecular weight marker; 1,2: SDS-PAGE analysis of ph protein, PGEX-4T-2 vector, respectively; 3,4: Western blotting analysis of GST-ph fusion protein, PGEX-4T-2 vector, respectively.

图5 细胞株7D3对纯病毒的检测Fig. 5 Detection of the purified EoNPV with cell line 7D3.

图6 不同浓度梯度的纯化病毒OD450值的标准曲线Fig 6 Standard curve of OD450 value with different concentration of purified EoNPV.
2.9 样品检测
通过间接ELISA检测得知,使用EoNPV的叶片饲喂的茶尺蠖检测率为100%,另外用血清计数法对其进行观察,表明饲喂EoNPV的叶片的茶尺蠖体内确含有EoNPV病毒,而饲喂健康叶片的茶尺蠖检测率为0,使用血清计数法检测未发现EoNPV的多角体。因此间接ELISA方法与血清计数法检出阳性率一致。
3 讨论
单克隆抗体技术是当今生物学领域中一次重大技术突破,杂交瘤细胞既具有大量无限生长的特性,又具有合成和分泌抗体的能力,是由识别单一抗原决定簇的细胞克隆所产生的均一性抗体。与常规多克隆抗体相比,由杂交瘤技术制备的单克隆抗体,具有特异性强,灵敏度高、质地均一,可以大量生产等优点,因此在近20年内得到了快速地发展,而且在生物科学的许多领域得到了广泛的应用,但是用杂交瘤技术制备单抗耗时长,成本也较高,又难获得对某些半抗原和抗原的抗体,因而阻碍了单抗技术应用的进一步发展。在植保科研领域,国内外先后研制出多种植物病毒、真菌、细菌和昆虫病毒等病原微生物的单克隆抗体,并初步开始相关的应用研究,突显出其广阔的应用前景[29]。1982年德国的Robert等首次研制出5株分泌抗苜蓿银纹夜蛾核型多角体病毒 (AcNPV) 单抗杂交瘤细胞株[30],接着加拿大的Hohman等研制出34株抗AcNPV单克隆抗体[31]。随后10年来,相继研发出一些昆虫病毒单克隆抗体。虽然与其他动物病毒相比,昆虫病毒单克隆抗体应用研究起步比较晚,但已初步显示出广泛的应用前景,因此研制昆虫病毒单克隆抗体诊断试剂逐渐取代常规的抗血清已成为大势所趋。
单抗的专一性与选用的抗原有密切的关系,在NPV中多角体蛋白量最大,制备方便,抗原性也很强。在本试验中,利用细胞融合技术制备了能稳定分泌抗EoNPV多角体蛋白的杂交瘤细胞株 (7D3),该细胞株灵敏度较高,效价为105,能够检测EoNPV生物制剂中是否含有EoNPV的多角体,由此建立了快速检测的 ELISA检测方法。由于自然界存在许多种杆状病毒,EoNPV多角体蛋白与其他多种NPV的多角体基因同源性比较高[3],例如茶刺蛾核型多角体病毒、茶毛虫核型多角体病毒、家蚕核型多角体病毒等杆状病毒等,所制备的抗体可能对含有多角体蛋白的其它杆状病毒也能特异性结合,因此有必要作进一步研究,以明确目前所筛选出的是否是只对EoNPV专一性结合的单克隆抗体,进而建立更加完善的定性定量检测EoNPV的方法。
[1] Zhang YM, Wang XL, Zhang SM, et al. Primary studies on the Ultrastructure of Ecotropis obliqua nuclear polyhedrosis virus. Chin Sci Bull, 1985(24): 1918−1920.张益民, 王学兰, 张世敏, 等. 茶尺蠖核型多角体病毒超微结构的初步研究. 科学通报, 1985(24): 1918−1920.
[2] Du JL, Zhang CX, Xiao Q, et al. Development of the fluorescent quantitative PCR for detection of EoNPV in Ectropis oblique. J Tea Sci, 2010, 30(3): 203−207.杜军利, 张传溪, 肖强, 等. 茶尺蠖核型多角体病毒荧光定量 PCR检测方法的建立. 茶叶科学, 2010, 30(3): 203−207.
[3] Liu NC, Meng XL. Analysis of the structural polypeptides of nuclear polyhedrosis virus From Buzura suppressaria guenee. Virol Sin, 1988(1): 48−53.刘年翠, 孟小林. 油桐尺蠖核型多角体病毒结构多肽的分析. 病毒学杂志, 1988(1): 48−53.
[4] Zhang YL, Zhong J, Su DM, et al. Preparation and characterization of monoclonal antibodies against Spodoptera litura nucleopolyhedrovirus. J Fudan Univer: Nat Sci, 2001, 40(5): 504−508.张亚力, 钟江, 苏德明, 等. 斜纹夜蛾核型多角体病毒单克隆抗体的制备和分析. 复旦学报: 自然科学版, 2001, 40(5): 504−508.
[5] Li XJ, Jiang H, Gao HP, et al. Expression and purification of the excision repair crosscomplementing 1 and preparation of its monoclonal antibodies. Chin J Cell Mol Immunol, 2008, 24(11): 1104−1109.李晓杰, 蒋华, 高慧萍, 等. ERCC1的表达纯化及其单克隆抗体的制备. 细胞与分子免疫学杂志, 2008, 24(11): 1104−1109.
[6] Cui SJ, Guo X, Yang HC, et al. Preparation of monoclonal antibodies against hemagglutinin of a subtype H5 avian influenza virus. Chin J Vet Med, 2006, 42(7): 17−19.崔淑鹃, 郭鑫, 杨汉春, 等. H5亚型禽流感病毒单克隆抗体的制备. 中国兽医杂志, 2006, 42(7): 17−19.
[7] Song S, Ling T, Shao JJ, et al. Preparation and characterization of monoclonal antibody against Foot-and-mouth disease virus serotype O. Chin J Prev Vet Med, 2009, 31(4): 325−328.宋帅, 林彤, 邵军军, 等. O型口蹄疫病毒单克隆抗体的制备和鉴定. 中国预防兽医学报, 2009, 31(4): 325−328.
[8] Long M, Yang ZT, Zhang NS, et al. Preparation of monoclonal antibody of danofloxacin. Anim Hus Vet Med, 2008, 40(11): 73−75.龙淼, 杨正涛, 张乃生, 等. 达氟沙星单克隆抗体的制备与鉴定. 畜牧与兽医, 2008, 40(11): 73−75.
[9] Wang YR, Li L, Liu WM, et al. Preparation and identification of monoclonal antibodies against MATSA. J Northwest A & F Univ: Nat Sci Ed, 2009, 37(6): 25−28.王业荣, 李立, 刘文明, 等. 抗MATSA单克隆抗体的制备与鉴定. 西北农林科技大学学报: 自然科学版, 2009, 37(6): 25−28.
[10] Li HY, Xin XG, Tian GB, et al. Optimum for indirect enzyme linked immunosorbent assay for detection of antibodies to avian influenza virus in chicken. Chin J Anim Poul Infect Dis, 1998, 20(4): 233−235.李海燕, 辛晓光, 田国斌, 等. 间接酶联免疫吸附试验检测禽流感抗体的最佳工作条件. 中国畜禽传染病, 1998, 20(4): 233−235.
[11] Martyn JC, Gould AR, Eaton BT. High level expression of the major core protein VP7 and the non-structural protein NS3 of bluetongue virus in yeast: use of expressed VP7 as a diagnostic, group-reactive antigen in a blocking ELISA. Virus Res, 1991, 18(2/3): 165−178.
[12] Zhao YL, Wang JH, Wang ZL, et al. Preparation of monoclonal antibody and development of ciELISA kit for rapid detection of enrofloxacin. J Northwest A & F Univ: Nat Sci Ed, 2009, 37(2): 33−39.赵银丽, 王建华, 王自良, 等. 恩诺沙星单克隆抗体的制备及ciELISA试剂盒的研制. 西北农林科技大学学报: 自然科学版, 2009, 37(2): 33−39.
[13] Zeng J, Yang CY, Pang W, et al. Preparation of monoclonal antibodies against tomato Ringspot virus. J Microbiol, 2007, 27(3): 35−37.曾洁, 杨翠云, 潘卫, 等. 番茄环斑病毒单克隆抗体的制备. 微生物学杂志, 2007, 27(3): 35−37.
[14] Köhler G, Milstein C. Derivation of specific antibody-producing tissue culture and tumor lines by cell fusion. Eur J Immunol, 1976, 6(7): 511−519.
[15] Lian XW, Du XH, Li KS, et al. Development and identification of monoclonal antibodies against H5N1 subtype avian influenza virus. J Gansu Agri Univ, 2007, 42(2): 26−29.连晓雯, 杜惠芬, 李克生, 等. 抗H5N1型禽流感病毒单克隆抗体的制备与鉴定. 甘肃农业大学学报, 2007, 42(2): 26−29.
[16] Pang HZ, Huang X, Yao XY, et al. Preparation and characterization of monoclonal antibodies against RalB. J Sichuan Univ: Med Sci Edi, 2008, 39(4): 651−653.潘华政, 黄湘, 姚小艳, 等. 抗 RalB单克隆抗体的制备及初步应用. 四川大学学报: 医学版, 2008, 39(4): 651−653.
[17] Guo YJ, Yang JX, Hua QY, et al. Preparation and characterization of monoclonal antibodies against epizootic hemorrhagic disease virus. Progress Vet Mede, 2009, 30(3): 14−17.郭莹洁, 杨俊兴, 花群义, 等. 鹿流行性出血病病毒单克隆抗体的制备与鉴定. 动物医学进展, 2009, 30(3): 14−17.
[18] Su JQ, Qiu MS, Wang HL, et al. Generation and characterization of monoclonal antibodies against canine distemper virus. J Jilin Agric Univ, 2009, 31(1): 88−92.苏建青, 岳妙姝, 王化磊, 等. 犬瘟热病毒单克隆抗体的制备及特性鉴定. 吉林农业大学学报, 2009, 31(1): 88−92.
[19] Ma XC, Shang JY, Yang ZN, et al. Genome sequence and organization of a nucleopolyhedrovirus that infects the tea looper caterpillar, Ectropis obliqua. Virology, 2007, 360(1), 235−246.
[20] Chen SW, Wei YJ, Long QX, et al. Research advances on structures and functions of baculovirus p10 genes and proteins. Virol Sin, 1998, 13(3): 185−191.陈尚武, 魏永杰, 龙綮新, 等. 杆状病毒p10基因及蛋白结构与功能的研究进展. 中国病毒学, 1998, 13(3): 185−191.
[21] Wang LZ, Xiao Q, Zhang CX. Preparation of the antibody against EupsNPV polyhedrin and its utilization in detection of the viral pesticide. J Tea Sci, 2008, 28(4): 260−266.王礼中, 肖强, 张传溪. 茶毛虫核型多角体病毒ph基因抗体的制备与利用. 茶叶科学, 2008, 28(4): 260−266.
[22] Wang JK, Cheng SP, Yan XJ, et al. Preparation and biological characteristic of monoclonal antibodies against mink enteritis virus. Chin Vet Sci, 2009, 39(3): 227−232.王建科, 程世鹏, 闫喜军, 等. 抗水貂肠炎病毒单克隆抗体的制备及其生物学特性鉴定. 中国兽医科学, 2009, 39(3): 227−232.
[23] Chen XQ, Xu GL, Wang JL, et al. Primary studies and application of monoclonal antibody against respiratory syncytial virus. Chin J Immunol, 2007, 23(11): 1015−1018.陈晓琦, 徐葛林, 王继麟, 等. 呼吸道合胞病毒单克隆抗体的制备及鉴定. 中国免疫学杂志, 2007, 23(11): 1015−1018.
[24] Wang Q, Luo JL, Jiang WH, et al. Preparation and identification of monoclonal antibody against Newcastle disease virus. J South China Agri Univ, 2009, 30(2): 112−114.王琴, 罗晶璐, 蒋文鸿, 等. 新城疫病毒单克隆抗体的制备及鉴定. 华南农业大学学报, 2009, 30(2): 112−114.
[25] Shi ML, Wu JX, Guo W, et al. Preparation of monoclonal antibodies to Turnip Mosaic Virus and its application for the virus detection. Acta Microbiol Sin, 2004, 44(2): 186−188.施曼玲, 吴建祥, 郭维, 等. 芜菁花叶病毒单克隆抗体的制备及检测应用. 微生物学报, 2004, 44(2): 186−188.
[26] Wang Y, Zhang L, Rao X, et al. Establishment of McAb-based competitive ELISA for detection of Chloramphenicol. Chin J Lab Diagn, 2007, 11(11): 1530−1533.王颖, 张磊, 饶星, 等. 氯霉素单克隆抗体ELISA检测方法的建立. 中国实验诊断学, 2007, 11(11): 1530−1533.
[27] Wang GZ, Zhou YJ, Chen ZX, et al. Production of monoclonal antibodies to Rice stripe virus and application in virus detection. Acta Phytopathol Sin, 2004, 34(4): 302−306.王贵珍, 周益军, 陈正贤, 等. 水稻条纹病毒单克隆抗体的制备及检测应用. 植物病理学报, 2004, 34(4): 302−306.
[28] Meng CM, Wu JX, Xie L, et al. Production of monoclonal antibodies to Cymbidium mosaic virus and application in Orchids virus detection. Acta Microbiol Sin, 2007, 47(5): 928−931.孟春梅, 吴建祥, 谢礼, 等. 建兰花叶病毒单克隆抗体的制备及检测应用. 微生物学报, 2007, 47(5): 928−931.
[29] Hu GJ, Lu ZQ, Hang SB, et al. Applications of monoclonal antibody technique in the studies of insect baculoviruses. Chin J Biol Control, 1993, 9(2): 76−79.胡广淦, 陆自强, 杭三保, 等. 单克隆抗体技术在昆虫病毒研究中的应用. 生物防治通报, 1993, 9(2): 76−79.
[30] Roberts PL, Naser W. Characterization of monoclonal antibodies to the Autographa californica nuclear polyhedrosis virus. Virology, 1982, 122(2): 424−430.
[31] Hohman AW, Faulkner P. Monoclonal antibodies to baculovirus structural proteins: determination of specificities by Western blot analysis. Virology, 125(2): 432−444.