番茄黄化曲叶病毒的系统发育分析及多重PCR快速检测
2012-02-24薛东齐李景富许向阳姜景彬
薛东齐 李景富 许向阳 姜景彬
(东北农业大学园艺学院,黑龙江哈尔滨 150030)
番茄(Lycopersicon esculentumMill.)是世界上重要的蔬菜作物,品种多、营养丰富、产量高、用途广泛。病毒病严重威胁着番茄的安全生产,其中番茄黄化曲叶病毒病(Tomato yellow leaf curl disease,TYLCD)发展迅速。TYLCD 首先在以色列发生(Czosnek & Laterrot,1997),而后蔓延到西班牙、意大利等地中海周边国家(Wu et al.,2006),以及非洲、亚洲和澳洲(Tesoriero &Azzopardi,2006)的大部分国家和地区。19世纪90年代后期,TYLCD 首次由旧世界双生病毒(Old WorldBegomoviruses)传播到新世界双生病毒(New WorldBegomoviruses),并在中美和北美严重危害番茄生产(Noris et al.,1994;Polston et al.,1999)。1998年我国广西南宁首次发现番茄黄化曲叶病毒,经分子生物学及血清学鉴定,该病毒为双生病毒的一个新种——中国番茄黄化曲叶病毒(刘玉乐 等,1998)。近年来,我国浙江、福建、广东、广西、云南、江苏、安徽、山东、河南、河北、山西、新疆等番茄主产区相继发现番茄黄化曲叶病毒病,并造成巨大损失(李桂新 等,2003;徐幼平和周雪平,2006;何自福 等,2007;余文贵 等,2009;周莹 等,2010)。
目前,不同地区的TYLCV 全序列已被大量报道(Fauquet et al.,2008),且都具有较高的相似性(Duffy et al.,2007;Owor et al.,2007),突变和基因重组是TYLCV 群体遗传多样性的根本动力(Sanz et al.,2000;Kitamura et al.,2004;Fauquet et al.,2005;Font et al.,2007;Owor et al.,2007)。笔者对TYLCV 中国分离物进行了系统发育分析,以明确TYLCV 不同株系在我国的分布和传播途径。与此同时,通过基因多态性分析,针对TYLCV 的严格保守区设计出3 对引物,建立了以多重PCR 技术为基础的快速、高效、特异性检测TYLCV 的方法,从而降低了试验成本,加速了试验进程,可应用于工厂化育苗的带毒性检测、蔬菜大规模生产中植株发病情况的检测及抗病育种,为蔬菜的安全可持续生产提供有力支撑。
1 材料与方法
1.1 材料
1.1.1 病毒样品 2010年9月分别在上海、浙江、山东采集8份具有皱缩、褪绿、黄化、卷曲症状的番茄上部叶片,分别命名为SH-1,SH-2;ZJ-HZ,ZJ-JX,ZJ-NB;SD-SG,SD-WF,SD-LC。来自于GenBank 的41份去除冗余序列的TYLCV 分离物全基因组序列和1份WDV 分离物全序列见表1。
1.1.2 主要试剂 TPS 缓冲液;琼脂糖凝胶 DNA 快速纯化回收试剂盒(TaKaRa);2xTaq MasterMix、RNase-Free Water(北京康为世纪生物科技有限公司);pMD19-T Vector(TaKaRa);氨苄青霉(Amp);LB(Luria-Bertani)固体/液体培养基;大肠杆菌(Escherichia coli)DH5α为东北农业大学番茄课题组自备。
1.2 方法
1.2.1 番茄黄化曲叶病毒的系统发育分析 DNA 序列相似性采用DNAMAN 6.0 软件(Lynnon Biosoft,Quebec,Canada)进行处理和分析。多序列比对采用ClustalX2 软件,系统进化树的构建采用MEGA5 的邻接法(Neighbor-joining)。DNA 序列核苷酸多态性分析采用DnaSP version 5软件(Universitat de Barcelona,Spain)。多重PCR 引物采用Primer premier 6.0 设计,并由Oligo 7.0进行验证,被用于比对和系统发育分析的TYLCV 分离物见表1。
1.2.2 多重PCR快速检测方法的建立 取30 mm2的感病番茄叶片于1.5 mL 离心管中,吸取1 mL液氮于离心管中,并用1 mL 枪头研磨叶片,加入150 μL TPS 缓冲液(100 mmol·L-1Tris-HCl,pH 8.0,1 mol·L-1KCl,10 mmol·L-1EDTA)(Higgins et al.,2000),沸水浴10 min,冰上冷却2 min,12 000 r·min-1、4℃离心5 min,上清液即可作为多重PCR 的模板。
参照表1中TYLCV 各分离物DNA-A 序列,根据其序列保守区,利用Primer Premier 6.0 设计3 对能完整克隆病毒CP、Rep、TrAP 3个片段的多重PCR 引物(表2),并通过Oligo 7.0 分别对这3 对引物与双生病毒科菜豆金色花叶病毒属中的其他60余种病毒进行验证,设计出的3对引物均不能与菜豆金色花叶病毒属中的其他病毒特异性匹配,因此较以往的只通过通用引物PA/PB 来验证菜豆金色花叶病毒属的TYLCV 具有较高的特异性,引物由北京六合华大基因科技股份有限公司合成。

表1 番茄黄化曲叶病毒GenBank 登录号

表2 番茄黄化曲叶病毒多重PCR 引物
PCR 反应体系:10.9 μL RNase-Free Water,10.9 μL 2xTaq MasterMix,上下游引物各0.5 μL,基因组DNA 0.2 μL。充分混匀后于PCR(Bio-Rad,USA)仪上进行扩增。扩增程序:94℃预变性4 min;94℃变性40 s,53℃退火40 s,72℃延伸45 s,30个循环;72℃延伸10 min。反应完毕后用1.2%的琼脂糖凝胶电泳检测扩增产物。扩增产物切胶后用TaKaRa 公司的琼脂糖凝胶DNA 快速纯化回收试剂盒进行DNA 回收纯化。
PCR 回收产物被克隆进pMD19-T Vector,连接转化感受态大肠杆菌,涂布在具氨苄青霉素(Amp)抗性的LB(Luria-Bertani)固体培养基(Amp 浓度为50 μg·mL-1)平板上,37℃培养16 h。挑取单菌落于Amp 浓度为50 μg·mL-1的LB 液体培养基中,摇床培养过夜。提取质粒进行PCR 阳性鉴定后测序,测序由北京六合华大基因科技股份有限公司完成。
2 结果与分析
2.1 田间感病番茄植株症状表现
样品采集地田间感病番茄植株症状与番茄黄化曲叶病毒病的典型症状极为相似,即表现为:植株中上部叶片叶缘黄化、上卷,叶片变小、变厚,植株生长变缓或停滞,节间缩短并明显矮化;植株下部叶片稍卷曲、黄化,并出现黄绿不均匀斑块;后期果实小而少、畸形、成熟慢,产量和品质严重下降。
2.2 番茄黄化曲叶病毒的系统发育分析
2.2.1 番茄黄化曲叶病毒在我国的区域分布及系统发育分析 TYLCV 在自然条件下只能由烟粉虱传播,近年来在我国许多地区Q型烟粉虱已完全取代了B型烟粉虱,成为番茄黄化曲叶病毒病的主要传毒介体,且B型和Q型烟粉虱在入侵过程中没有明显的瓶颈效应,不同种群间存在着显著的遗传分化和基因交流(龚一帆 等,2009)。李刚等(2010)对番茄大棚定植初期番茄黄化曲叶病毒病病株和棚内烟粉虱进行了抽样调查,结果表明番茄黄化曲叶病毒病病株和烟粉虱在空间分布型上一致,均呈聚集分布。传毒特性研究发现,低密度的带毒烟粉虱即可导致TYLCV的暴发流行。因此,虽然世界各地的番茄黄化曲叶病毒名称一样,但病毒的基因组成相差很大。根据国际病毒分类委员会规定,双生病毒科病毒全基因组核苷酸序列相似性小于89%则被定名为不同病毒,大于89%则被认为是同一病毒的不同株系(Deng et al.,1994)。对表1中的TYLCV全序列采用MEGA5 的邻接法(Neighbor-joining)构建系统进化树(自举值为1 000)(图1)。
从图1可知,在我国番茄主产区均已发现番茄黄化曲叶病毒,且主要为2种病毒所侵染,一种为番茄黄化曲叶中国病毒(TYLCCNV)及其株系,侵染省份主要为我国西南部和西部的广西、云南、四川、新疆等地,其与番茄黄化曲叶泰国病毒(TYLCTHV)具有78.20%~83.49%的相似性,并与欧洲的TYLCMalV 和TYLCSV 也具有较远的亲缘关系,说明TYLCCNV 是一个单独的进化分支(Cluster Ⅱ)(刘玉乐 等,1998);另一种为番茄黄化曲叶以色列病毒(TYLCV-IL)及其株系,侵染省份主要为我国中东部和东南沿海地区的河北、河南、安徽、山东、江苏、浙江、上海等地,主要分为两大分支,浙江、山东等地与日本的Haruno株系形成一个分支,并与其具有99.64%的相似性,江苏、北京的分离物与日本的Tomigusuku株系、美国的California株系、墨西哥的Culiacan株系和Sinaloa株系形成一个分支(Cluster Ⅳ),并具有98.56%~99.17%的相似性,说明侵染我国的TYLCV-IL 很有可能来源于日本和中北美洲西部沿海地区。

图1 基于DNA-A 全序列构建的番茄黄化曲叶病毒分子进化树
2.2.2 番茄黄化曲叶病毒CP基因序列测定和相似性分析 对图2、3 中的CP 核苷酸和氨基酸序列比对分析,发现图2、3 中的ClusterⅢ分支均独立于其余各分支,且与各分支间具有72.76%~73.41%的相似性;而其余各分支间具有较近的亲缘关系,相似性均在97.04%以上,这也进一步证明了图1所揭示的结果,即侵染我国番茄主产区的TYLCV 主要分为两大群,一为TYLCV-IL及其株系,二为TYLCCNV 及其株系。本试验所测定的8个CP 序列均与TYLCV 以色列病毒具有97.56%(核苷酸)/98.27%(氨基酸)以上的相似性。由于在CP基因上发生的任何遗传突变,只要影响到病毒的包装、病毒粒体的结构及稳定性,或是病毒粒体表面结构,均可造成传毒能力的丧失或传毒效率的降低,而CP相对比较保守,且可作为病毒颗粒结构蛋白,由此可知这8个样品也属于TYLCV 以色列病毒。进一步研究发现,CP N 端的134、152位的氨基酸残基发生突变,突变体能侵染但不能被烟粉虱传播(Noris et al.,1998)。由此可见,CP的稳定性是保证TYLCV能够侵染和流行的关键因素。山东、浙江、上海地区分离物的CP具有极高的相似性,说明同一年度不同的省份内有相同的株系暴发流行,这可能与烟粉虱极强的迁飞性有关。同时,3 省份暴发流行的TYLCV 也可能是由单基因型造成的多个传播链引起的,且无明显的时间和地理分布倾向。说明不同省份有多个不同TYLCV 基因型引起的持续传播,同时不同省份也存在相同病毒的传播链。

图2 49份番茄黄化曲叶病毒核苷酸序列相似性比较结果
2.3 番茄黄化曲叶病毒的基因多态性分析

图3 49份番茄黄化曲叶病毒CP 氨基酸序列相似性结果
通过对表1中的核苷酸全序列比对,表明TYLCV 各分离物具有96.0%~99.7%的相似性。为了评估TYLCV 各分离物核苷酸序列突变的程度,采用DnaSP V5 软件对核苷酸序列多态性进行分析。通过统计33个分离物各基因组每个核苷酸位点的突变频率,得到病毒核苷酸序列各位点的突变指数分布(图4)。多态性最高区域为IR 区;与此同时还存在另外2个多态性较高的区域,一个在AV1ORF 内,另一个在AC2与AC3的ORF 重叠区域内;最保守区域在AV1与AV2的ORF 重叠区;另外2个次级保守区分别是AV1与AC3的ORF 重叠区、AC2与AC3的部分ORF 重叠区。
由TYLCV 的系统发育分析可知,除云南、广西、四川、新疆等地占主导地位的是TYLCCNV 外,我国其他地区的病毒分离物均与世界范围流行的TYLCV-IL 有较高的相似性(Zubiaur et al.,1996;Navas-Castillo et al.,1999;Duffy et al.,2007),说明TYLCV 在进化上具有较强的保守性,而且核苷酸突变位点在染色体上的分布具有不稳定性。
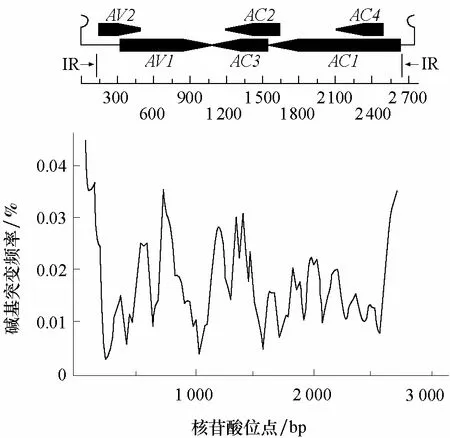
图4 番茄黄化曲叶病毒的核苷酸序列多态性(Pi)分析结果
2.4 番茄黄化曲叶病毒的多重PCR检测
利用表2中的3 对引物对样品进行多重PCR 扩增,1.2%琼脂糖电泳检测,8个样品均扩增出大小约400、780、1 100 bp 的特异性条带(图5)。对780 bp 左右的特异性条带(CP条带)进行回收,克隆进pMD19-T 载体,测序后提交到GenBank(JQ768337-JQ768344)。核苷酸和氨基酸序列相似性检验结果显示,8个样品均与北京、江苏等地的TYLCV 分离物具有较近的亲缘关系。

图5 番茄黄化曲叶病毒的多重PCR检测结果
3 结论与讨论
近年来由TYLCV 引起的番茄黄化曲叶病毒病已成为世界许多地区番茄生产的重要限制因素,以往都是发生在热带和亚热带地区,而今却在温带地区的中国大面积发生,且主要为TYLCV-IL和TYLCCNV 各分离物所侵染,并已逐步形成由南向北、由沿海向内陆蔓延的格局。从发病蔓延趋势来看,该病由点、片发生向面式暴发递进,并已经蔓延到国内各大番茄主产区,对番茄生产造成了严重危害。造成该病在我国大面积暴发的原因有:① 全球气候变暖,使得B型、Q型烟粉虱能够在北方越冬;② 温室、大棚等保护地设施的大规模使用,也使得B型、Q型烟粉虱成为春茬栽培番茄的病毒侵染源;③ 番茄主产区栽培品种的单一化也为黄化曲叶病毒的爆发创造了有利条件(Zhang et al.,2009)。常用的检测番茄黄化曲叶病毒的方法有PCR检测法和ELISA 检测法,由于TYLCV 主要存在于寄主植物的韧皮组织,且其浓度较低,因此应用ELISA检测感病植株体内的TYLCV 需要较好质量的抗血清。本试验建立的DNA 快速提取方法较SDS法(Guillemaut & Marechal-Drouard,1992)、快速一步法(ROSE)(方宣钧 等,1997)、改良CTAB法(陈绍宁和崔继哲,2004)而言,步骤简单、方便,可在短时间内完成大量样品的DNA 制备。与此同时,根据TYLCV 的全序列设计出3 对特异性引物,建立了快速、准确的TYLCV 检测体系,可应用于工厂化育苗的带毒性检测、蔬菜大规模生产中植株发病情况的检测及抗病育种,为蔬菜的安全可持续生产提供有力支撑。
本试验中,从病毒DNA-A 序列多态性分布可知IR 区、AC2区、AC3区均具有较高的多态性。其中AC2编码转录激活蛋白(TrAP),其突变可能增加该蛋白的活性,并促进DNA-A 链晚期基因AV1的转录,从而翻译出大量病毒外壳蛋白。AC3基因编码复制增强蛋白(REn)能够大大增加病毒DNA 在体内的复制,从而导致病毒颗粒大量累积,造成严重的系统性侵染。AC1具有较高的保守性,这也进一步验证了其编码的复制相关蛋白(Rep)是病毒DNA 复制的唯一病毒蛋白,而AC1和AC2编码区的突变则妨碍病毒的侵染。
从CP 核苷酸和氨基酸序列系统发育分析中不难看出,核苷酸序列的相似性和氨基酸序列的相似性基本上是一致的,核苷酸的突变可能并不导致氨基酸的变异,不会影响蛋白质的结构和功能,但少数位点的核苷酸突变可能会引起氨基酸的较大变异。虽然在我国中东部番茄主产区暴发流行的是TYLCV 以色列株系,其彼此间的遗传距离较小,但随着时间的推移,TYLCV 局部地区优势株系易与双生病毒科其他种之间发生基因重组,产生新的病毒或者株系,新病毒或株系与原来的病毒复合侵染极易引起病害的大流行。因此,应监测不同国家,甚至是同一国家不同地区所暴发流行的TYLCV株系分布和病毒分子特征,来确定病毒的来源和传播路径,提供TYLCV 的防治策略,科学的阻断其传播。
陈绍宁,崔继哲.2004.快速提取番茄总DNA 应用于规模化PCR检测.北方园艺,(3):46-47.
方宣钧,孔巍,金芜军.1997.快速一步法(ROSE 法)提取DNA 应用与RAPD-PCR 扩增.高技术通讯,7(10):40-43.
龚一帆,杜永臣,谢丙炎,张友军.2009.威胁番茄生产的新病害——番茄黄化曲叶病毒病.中国蔬菜,(21):1-4.
何自福,虞皓,毛明杰,罗方芳,林奕韩,王穗涛.2007.中国台湾番茄曲叶病毒侵染引起广东番茄黄化曲叶病.农业生物技术学报,15(1):119-123.
李桂新,范三微,李正和,谢艳,周雪平.2003.侵染云南白肋烟的中国番茄黄化曲叶病毒及伴随卫星DNA 分子的基因组特征.农业生物技术学报,11(5):525-530.
刘玉乐,蔡健和,李冬玲,秦碧霞,田波.1998.中国番茄黄化曲叶病毒——双生病毒的一个新种.中国科学:C 辑,28(2):148-153.
李刚,吴永汉,陈文华,都林娜,许方程.2010.番茄黄化曲叶病病株及传毒介体烟粉虱的空间分布型.浙江农业科学,22(6):779-783.
徐幼平,周雪平.2006.侵染广西烟草的中国番茄黄化曲叶病毒及其伴随的卫星DNA 分子的基因组特征.微生物学报,46(3):358-362.
余文贵,赵统敏,杨玛丽,赵丽萍,季英华,周益均.2009.山东、安徽两省栽培番茄烟粉虱传双生病毒的PCR检测及序列分析.江苏农业学报,25(4):747-751.
周莹,李兴红,刘建华,姜京宇,王曙峰,燕继晔.2010.河北省番茄黄化曲叶病毒病的分子鉴定初报.植物保护,36(1):60-64.
Czosnek H,Laterrot H.1997.A world wide survey ofTomato yellow leaf curl viruses.Arch Viro,1142:1391-1406.
Deng D,Mcgrath P F,Robinson D J,Harrison B D.1994.Detection and differentiation of whitefly-transmittedgeminivirus in plant and vector insects by polymerase chain reaction with degenerate primers.Annals of Applied Biology,125(2):327-336.
Duffy S,Holmes E C.2007.Multiple introductions of the old word begomovirusTomato yellow leaf curl virusinto the new world.Applied and Environmental Microbiology,73(21):7114-7117.
Fauquet C M,Sawyer S,Idris A M,Brown J K.2005.Sequence analysis and classification of apparent recombinant begomoviruses infecting tomato in the nile and Mediterranean Basins.Virology,95(5):549-555.
Fauquet C M,Briddon R W,Brown J K,Moriones E,Stanley J,Zerbini M,Zhou X.2008.Geminivirusstrain demarcation and nomenclature.Arch Virol,153:783-821.
Font M I,Rubio L,Martínez-Culebras P V,Jordá C.2007.Genetic structure and evolution of natural populations of viruses causing theTomato yellow leaf curl diseasein Spain.Virus Research,128(1-2):43-51.
Guillenmaut P,Marechal-Drouard L.1992.Isolation of plant DNA:a fast,inexpensive,and reliable method.Plant Molecular Biology Reporter,10(1):60-65.
Higgins C M,Hall R M,Campbell P R,Dietzgen G.2000.PCR rescue and analysis of transgene directly from crude extracts of transgenic embryos and plants.Plant Molecular Biology Reporter,18(3):285.
Kitamura K,Murayama A,Ikegami M.2004.Evidence for recombination among isolates ofTobacco leaf curl JapanandHoneysuckle yellow vein mosaic virus.Archives of Virology,149:1221-1229.
Navas-Castillo J,Sánchez-Campos S,Diaz J A,Sáez-Alonso E,Moriones E.1999.Tomato yellow leaf curl virus-IScauses a novel disease of common bean and severe epidemics in tomato in Spain.Plant Disease,83(1):29-32.
Noris E,Hidalgo E,Accotto G P,Moriones E.1994.High similarity among thetomato yellow leaf curl virusisolates from the west mediterranean basin- the nucleotide-sequence of an infectious clone from Spain.Archives of Virology,135:165-170.
Noris E,Vaira A M,Caciagli P,Masenga V,Gronenborn B,Accotto G P.1998.Amino acids in the capsid protein ofTomato yellow leaf curl virusthat are crucial for systemic infection,particle formation,and insect transmission.Journal of Virology,72(12):10050-10057.
Owor B E,Martin D P,Shepherd D N,Edema R,Monjane A L,Rybicki E P,Thomson J A,Varsani A.2007.Genetic analysis ofMaize streak virusisolates from Uganda reveals widespread distribution of a recombinant variant.Journal of General Virology,88(11):3154-3165.
Polston J E,McGovern R J,Brown L G.1999.Introduction ofTomato yellow leaf curl virusin Florida and implications for the spread of this and othergeminivirusesof tomato.Plant Dis Rep,83:984-988.
Sanz A I,Fraile A,García-Arenal F,Zhou X P,Robinson D J,Khalid S,Butt T,Harrison B.2000.Multiple infection,recombination and genome relationships among begomovirus isolates found in cotton and other plants in Pakistan.Journal of General Virology,81(7):1839-1849.
Tesoriero L,Azzopardi S.2006.Tomato yellow leaf curl virusin Australia.Primefact,220:1-2.
Wu J B,Dai F M,Zhou X P.2006.First report ofTomato yellow leaf curl virusin China.Plant Disease,90:1359.
Zhang H,Gong H R,Zhou X P.2009.Molecular characterization and pathogenicity ofTomato yellow leaf curl virusin China.Virus Genes,39:249-255.
Zubiaur Y M,Zabalgogeazcoa I,de Blas C,Sanchez F,Peralta E L,Romero J,Ponz F.1996.Geminiviruses associated with diseased tomatoes in Cuba.Journal of Phytopathology,144(5):277-279.
