佐剂诱导关节炎大鼠模型的建立及成纤维样滑膜细胞的分离
2012-02-06张巍王芳王博张瑾张晓郡阎瑾琦徐元基王启宇于继云
张巍,王芳,王博,张瑾,张晓郡,阎瑾琦,徐元基,王启宇,于继云
(军事医学科学院基础医学研究所转化医学研究室,北京 100850)
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎为特征的自身免疫性疾病,主要侵犯活动关节的滑膜,导致滑膜过度增殖以及软骨和骨破坏,致残率高,严重影响病人的生活质量和预期寿命,一直是世界范围内的研究热点[1]。目前关于RA 致病因素及发病机制有很多假说,但尚未完全清楚,为更好地研究RA 发病机制及筛选有效治疗药物,制备发病率高且稳定的RA 动物模型至关重要。国际上应用较多的RA 动物模型主要为胶原诱导关节炎(collagen-induced arthritis,CIA)和佐剂诱导关节炎(adjuvant-induced arthritis,AIA)。CIA 是以II 型胶原作为抗原进行免疫,诱发动物机体针对关节软骨的主要化学成分II 型胶原进行自身免疫攻击,从而产生关节炎,此模型最常用的易感动物为DBA/1J 小鼠[2]。由于DBA/1J 小鼠国内不易获得,因此我们选择AIA 模型进行研究。AIA 模型最常用的易感动物为Lewis 大鼠,来源方便有保证,其发病原理为分子模拟理论。结核杆菌的一个蛋白分子与关节滑膜上的一个糖蛋白分子结构相似,可以被同一株T 细胞克隆所识别,从而诱发针对关节的免疫反应[3]。我们根据近几年国际上出现的改良方法,对AIA 模型造模方法进行了改进,以制备发病率高且稳定的RA 动物模型。
成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)增殖是RA 的主要病理特征,过度增殖的FLS分泌细胞因子、趋化因子、粘附分子和蛋白酶等,在关节破坏的发病机制中发挥重要作用[4,5],FLS 因而成为近年来RA 治疗研究的新热点。FLS 是炎性滑膜组织中数量最多的细胞类型,在炎性条件下FLS类似肿瘤细胞样疯狂增长促进滑膜组织异常增生是RA 炎症最重要的病理表现。从滑膜组织中分离培养FLS 因而成为RA 信号机制及治疗研究的理想的体外细胞模型。由于商业化FLS 价格昂贵,而且只能培养8~10 代,之后便失去增殖能力,因而我们尝试从AIA 炎性关节滑膜中分离并培养FLS。为今后的RA 治疗药物评价及作用机制研究提供良好的体内动物模型和体外细胞模型。
1 材料和方法
1.1 大鼠佐剂诱导关节炎动物模型制备
无菌条件下充分研磨热灭活结核杆菌H37Ra菌株(购于Difco 公司),使其颜色由灰变白,并继续研磨数分钟,分3 次加入矿物油(购于Sigma 公司),充分研磨使悬液成糊状,制备成终浓度为5 mg/mL的混悬液;用玻璃注射器吸取混悬液,连接于三通管,并在三通管另一端插入另外一支注射器,来回推打两只注射器使混悬液得到充分混匀从而完成佐剂制备。于Lewis 大鼠尾根部上方1~2 cm 的中心部位皮下注射上述佐剂制备液,每只220 μL。SPF 级Lewis 大鼠,6 周龄,体重(110 ±10)g,雌性,购于北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】。动物饲养和实验在军事医学科学院实验动物中心SPF 级屏障动物实验设施进行【SYXK(军)2007-004】,实验经军事医学科学院实验动物伦理委员会审核批准,符合中国动物实验的福利伦理准则,并按实验动物使用的3R 原则给予人道的关怀。
1.2 关节指数评分
按照0~4 分评分方法反映关节炎的严重程度:0 分,没有红肿(正常关节);1 分,趾或指关节红肿;2 分,踝或腕关节轻度肿胀;3 分,踝或腕关节中度红肿,但还可以弯曲和行走;4 分,踝或腕关节重度红肿,不能弯曲和行走即发生残疾。对四肢都进行评分,每只动物最高关节指数为16 分。
1.3 关节病理学检查
处死动物后,切取后肢踝关节,用4% 甲醛固定,进行脱钙处理后纵向切开,进行石蜡包埋(每个关节可制作两个腊块),制作冰冻组织切片,分别进行苏木精& 伊红(H&E)染色和番红O(safranin O)染色,显微镜下观察组织学病理变化。H&E 染色按照常规方法操作。番红O 染色方法为:0.02%固绿水溶液染片3 min,1%冰醋酸洗涤去除残留固绿;以0.1%番红O 染色3min,脱水、二甲苯透明、封片,显微镜观察。固绿和番红O 染料均购于Sigma 公司。
1.4 成纤维样滑膜细胞(FLS)的分离培养
造模免疫的第30 天左右,牺牲动物,分离严重肿胀的后踝关节,无菌条件下剥离关节滑膜组织,浸泡于盛有Ⅰ型胶原酶(2.5 mg/mL,购于Sigma 公司)的无血清DMEM 培养液中,剪碎成尽可能小的组织块,移至培养瓶中消化培养过夜;次日将培养液用200 目不锈钢筛网过滤,弃杂质,用离心管收集滤液,1500 r/ min 离心10 min,小心去除上清,加入DMEM 细胞培养液(含20% FBS、100 U/mL 青霉素、100 mg/L 链霉素)悬浮细胞,按每毫升1 ×106个细胞接种于25 cm2细胞培养瓶中培养过夜,次日弃去未贴壁细胞,贴壁细胞即为原代成纤维样滑膜细胞。长满瓶底后传代培养。
1.5 流式分析
培养的第3 代FLS 经0.25% 胰酶消化,离心,去上清,收集细胞分别与PE 标记的小鼠抗大鼠VCAM-1 抗体及同型对照小鼠IgG(阴性对照)在4℃避光条件下孵育30 min,洗涤细胞,流式细胞仪检测滑膜细胞VCAM-1 表达情况。以上抗体均购于Biolegend 公司。
1.6 统计学分析
对关节指数、踝关节厚度和体重等指标使用的统计学分析方法为“具有一个重复测量的两因素设计定量资料方差分析”,使用9.1.3 版本的SAS 专业软件进行统计分析。
2 结果
2.1 AIA 模型的临床表现
用热杀死分支结核杆菌与矿物油混合制备佐剂,尾根部皮内单次免疫Lewis 大鼠进行动物造模,成功诱导了关节炎的产生:炎症可发生在四肢,包括掌指关节、跖趾关节趾/指间关节、踝/腕关节;严重的症状主要发生在后肢,涉及整个爪尤其是踝关节,如不给予有效治疗,踝关节将在免疫后的第20 天左右变成残疾,即不能弯曲和行走,而且这种损坏是不可逆的。见图1(彩插11)。
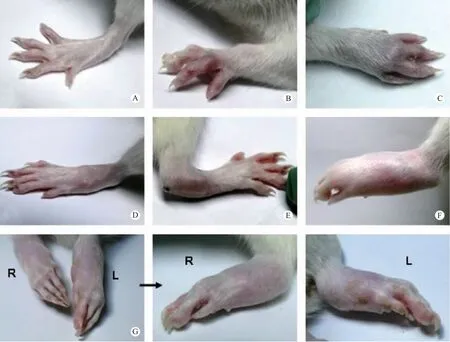
图1 大鼠佐剂诱导关节炎的临床表现Note: A.Normal hind limb;B.Redness and swelling of the toe joints;C.Redness and swelling of the wrist joint;D.Mild redness and swelling of the ankle joint;E.Moderate redness and swelling of the ankle joint;F.Severe redness and swelling of the ankle joint;G.Severe redness and swelling of both hind limbs(R, right hind limb;L, left hind limb).Fig.1 The clinical signs of rats with adjuvant-induced arthritis
2.2 AIA 模型的临床指标观察和检测
尽管大鼠关节炎的严重症状主要出现在后肢,我们依然采用国际标准的评分方法4 分法(0~4分)对大鼠的四肢进行了评分(每只最大得分为16分),这样更能全面的评价全身的炎症发展情况和严重程度。从免疫后第9 天开始观察,每两天检测一次,直至佐剂造模免疫后的第25 天。动物发病率为100%,并且发病时间均在免疫后的第11 或12天,第15~19 天时发病达到高峰,在此之后,前肢包括指关节和腕关节的红肿可有一定程度消退或者完全消退,但后爪尤其是踝关节的肿胀依旧维持,大部分会发生残疾即不能弯曲和行走(见图2A)。为了能更客观的评价炎症的严重程度,我们应用电子游标卡尺对左右两侧踝关节的厚度进行了定量测量,将左右数值相加作为踝关节厚度指标数值。检测时间为造模第1、4、7、11、14、17、21 和26 天。结果表明从第14 天开始,AIA 组的踝关节厚度明显高于正常组(P<0.05,见图2B),与关节指数和临床表现相一致。此外,我们还通过监测大鼠体重来反映动物的精神和生活状况。AIA 组大鼠体重从第11 天开始明显低于正常组,表明炎症对食欲、活动等具有一定程度影响(图2C)。对以上结果我们进行了多次验证。通过以上实验,我们建立了良好的关节炎动物模型,其发病率为100%且发病时间集中稳定。
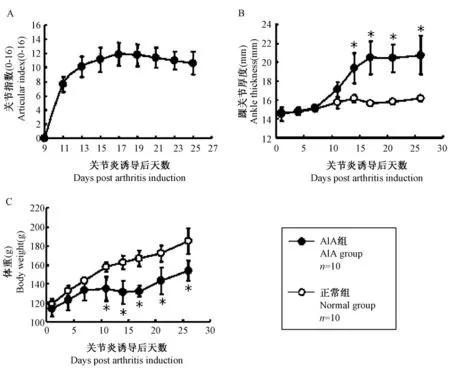
图2 AIA 模型的临床指标测量(* P<0.05)Fig.2 Measurements of clinical indexes of the rat AIA models(* P<0.05)
2.3 AIA 大鼠踝关节的病理学改变
分离大鼠后踝关节,脱钙处理后,纵向切开,石蜡包埋,每个关节制作两个腊块,制作组织切片,H&E 染色,显微镜下观察,主要观察滑膜增生和炎性细胞浸润等组织学表现。正常关节滑膜平滑完整,关节腔清晰无杂质,未见滑膜组织增生和炎性细胞浸润;而AIA 关节结构粗糙,明显受到破坏,细胞增生明显且排列不规则,血管翳大量生成,大量增生的滑膜细胞侵入关节腔使关节间隙变狭小,并侵蚀关节软骨和骨,增生的滑膜组织中可见大量炎性细胞浸润(图3,彩插11)。除了对关节炎症包括滑膜增生和炎性细胞浸润等指标进行观察外,观察了关节软骨的蛋白聚糖含量(蛋白聚糖是关节软骨的主要成分,可被Safranin O 染成橘红色),用以反映关节软骨的完整性或被破坏的程度[6]。结果表明,正常大鼠关节软骨染色明亮清晰,关节软骨结构光滑完整;而AIA 关节软骨色彩暗淡,结构明显遭到破坏(图4,彩插12)。以上结果表明,AIA 处理组大鼠踝关节发生了明显的病理学改变,这些变化与RA的病理学特征相似,是一个良好的RA 实验模型。
2.4 成纤维样滑膜细胞的分离培养
成纤维样滑膜细胞是滑膜组织中的主要细胞类型,在RA 发病机制及关节破坏过程中发挥关键作用,因而具有重要的研究意义。鉴于该细胞商业价格昂贵,我们利用胶原酶消化法,从患关节炎大鼠的滑膜组织中分离培养了成纤维样滑膜细胞。原代细胞生长较缓慢,约一周时间扩展成片,细胞形态呈现梭型,并呈放射样生长(图5A);第二代细胞生长较原代细胞快,约5d 即铺满瓶底,细胞形态也比原代的均一,呈长梭形(图5B);第三代细胞生长速度明显加快,很快便会成片生长,约两天即可长满瓶底(图5C),荧光显微镜下观察转染了绿色荧光蛋白(GFP)的第三代FLS,可清晰观察到细胞形态呈纺锤形,两极细胞突细长,细胞核呈卵圆形(图5D)。从第八代开始,FLS 生长明显缓慢,第十代时基本丧失分裂增殖能力。图5 见彩插12。
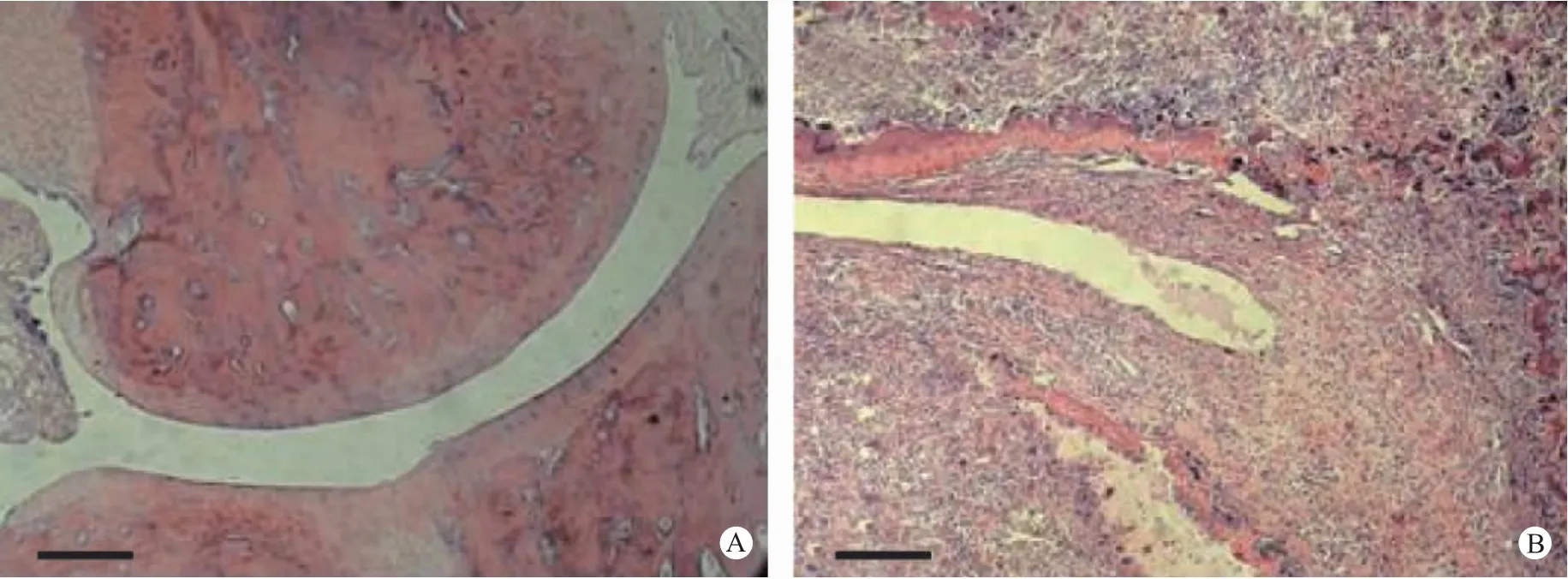
图3 踝关节的H&E 染色组织学观察Note: A.Normal ankle joint;B.Ankle joint of AIA.Fig.3 Histological appearance of the ankle joints.HE staining
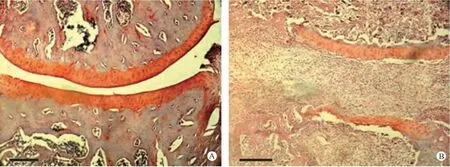
图4 番红O 染色观察关节软骨完整性Note: A.Normal ankle joint;B.AIA ankle joint.Fig.4 Joint cartilage integrity of the ankle joints.Safranin O staining
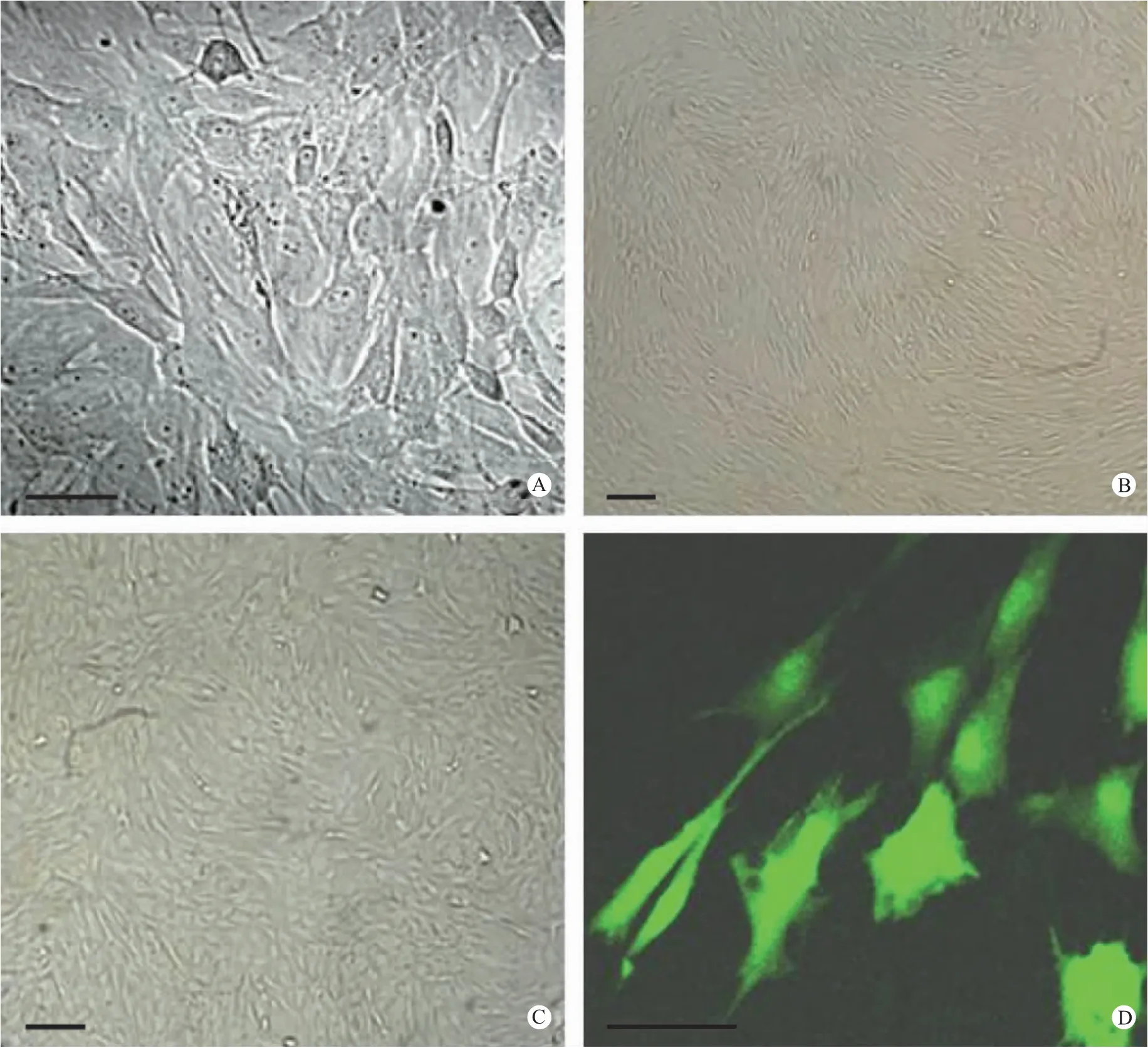
图5 大鼠AIA 成纤维样滑膜细胞(FLS)的分离培养(标尺: 50 μm)Note: A.Primary FLS;B.FLS of passage 2;C.FLS of passage 3;D.Transfection with GFP of FLS of passage 3.Fig.5 Isolation and culture of fibroblast-like synoviocytes(FLS)from AIA rats(scale bar: 50 μm)
2.5 成纤维样滑膜细胞的鉴定
成纤维样滑膜细胞(FLS)表达血管细胞黏附分子-1(VCAM-1),后者是目前常用的鉴定FLS 的特异标记物[7]。应用流式细胞术对本研究中培养的第3 代FLS 的VCAM-1 表达率进行检测,结果显示第3 代 AIA 大鼠 FLS 的 VCAM-1 表达率为90.18%,表明所培养的滑膜细胞主要为FLS,纯度较高(图6)。
3 讨论
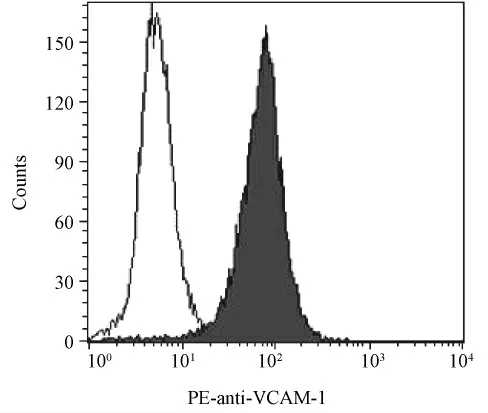
图6 成纤维样滑膜细胞VCAM-1 的表达Fig.6 Expression of VCAM-1 by the fibroblast-like synoviocytes
传统的佐剂诱导关节炎(AIA)又被称为弗氏佐剂关节炎,通过皮下注射完全弗氏佐剂而诱导动物关节炎的发生,该方法的常用动物是对关节炎易感的Lewis 大鼠[8]。AIA 模型已被广泛应用于治疗类风湿关节炎(RA)的药物筛选及药效机制的研究工作中。近年来出现了改良的AIA 诱导方法,我们对该方法进行了尝试:采用热灭活结核杆菌H37Ra 菌株与矿物油充分研磨混合,制成终浓度为5 mg/mL的溶液,一次性尾根部皮下注射0.2 mL,发现从免疫后的第11 天,炎症开始出现在四肢,包括跖趾/掌指关节、趾/指间关节、踝关节和腕关节等;免疫后17~19 d 炎症达到高峰,以踝关节重度肿胀为主,关节出现畸形并丧失运动功能;在关节炎症发展过程中同时伴有毛色暗淡、易脱毛和体重减轻等表现。我们应用这种方法已经免疫近60 余只大鼠,发病率为100%,发病时间基本为免疫第11 天,极少数在免疫第12~14 天时发病(占5%),仅有一只在观察快结束时(第25 天)发病,这些都是存在的个体差异表现。总体上该方法操作简便、重复性好,是一个良好的RA 造模方法,而且其病理表现也与RA 相似。在此之前我们曾应用胶原诱导的方法对Lewis大鼠进行造模(II 型胶原加不完全弗氏佐剂,尾根部四点皮内注射,第7 天加强免疫一次),发病率不及60%,其中的原因我们也在进一步探讨,但是我们认为应用Lewis 大鼠使用佐剂诱导关节炎的方法可能好于胶原诱导(胶原诱导关节炎大部分使用的动物为DBA/1J 小鼠)。
最近研究认为,滑膜增厚的主要原因是由于成纤维样滑膜细胞(FLS)的过度增殖。通过阻止FLS的增生和活化,对控制RA 病情发展具有重要意义,FLS 也因而成为RA 治疗的新型靶细胞[9,10]。从滑膜组织中分离获得FLS 将为RA 研究提供良好的体外细胞模型。由于FLS 较难获得,而且不能无限传代(一般8~10 代以后增殖能力就明显降低),使得市售的FLS 价格昂贵,因而限制了其在研究中的应用。我们从上述诱导的AIA 大鼠炎性关节中剥离滑膜组织,应用酶消化法分离并培养FLS,并通过流式检测进行了验证。本研究分离的FLS 可以传至10 代,之后便很难再扩大培养,表明失去了增殖能力,因此使用3~8 代细胞进行相应研究较为合适,并可冻存3~6 代细胞作为备用细胞。为使分离的FLS 纯度较高,建议在剥离滑膜时尽可能地去除附着的结缔组织,并充分将滑膜组织剪碎。以上RA动物模型的建立及FLS 的分离和培养,为我们今后探讨RA 可能的发病机制、研究和开发新的治疗方案或药物提供了良好的工具。
(本文图1,3 见彩插11,图4,5 见彩插12)
[1]Oslen NJ,Stein CM.New drugs for rheumatoid arthritis[J].N Engl J Med,2004,350(21):2167-2179.
[2]Park KS,Park MJ,Cho ML,et al.Type II collagen oral tolerance;mechanism and role in collagen-induced arthritis and rheumatoid arthritis[J].Mod Rheumatol,2009,19(6):581-589.
[3]Van Eden W,Waksman BH.Immune regulation in adjuvant-induced arthritis:possible implications for innovative therapeutic strategies in arthritis[J].Arthritis Rheum,2003,48(7):1788-1796.
[4]Harris ED Jr.Rhrumatoid arthritis:pathophysiology and implications for therapy[J].N Engl J Med,1990,322(18):1277-1289.
[5]Firestein GS.Invasive fibroblast-like synoviocytes in rheumatoid arthritis.Passive responders or transformed aggressors?[J].Arthritis rheum,1996,39(11):1781-1790.
[6]Van Holten J,Reedquist K,Sattonet-Roche P,et al.Treatment with recombinant interferon-beta reduces inflammation and slows cartilage destruction in the collagen-induced arthritis model of rheumatoid arthritis[J].Arthritis Res Ther,2004,6:R239.
[7]Mullan RH,Bresnihan B,Golden-Mason L,et al.Acute-phase serum amyloid A stimulation of angiogenesis,leukocyte recruitment,and matrix degradation in rheumatoid arthritis through an NF-kappaB-dependent signal transduction pathway[J].Arthritis Rheum,2006,54(1):105-114.
[8]刘元刚,刘树滔,饶平凡.类风湿性关节炎啮齿动物模型的研究进展[J].中国实验动物学报,2007,15(6):470-473.
[9]Bartok B,Firestein GS.Fibroblast-like synoviocytes:key effector cells in rheumatoid arthritis[J].Immunol Rev,2010,233(1):233-255.
[10]Okamoto H,Shidara K,Hoshi D,et al.Anti-arthritis effects of vitamin K(2)(menaquinone-4)- a new potential therapeutic strategy for rheumatoid arthritis[J].FEBS J,2007,274(17):4588-4594.
