替米沙坦改善糖尿病大鼠肾脏功能机制研究
2012-02-06张茜肖新华黎明李文慧李伟于淼张化冰平凡孙晓方茅李莉杨国华
张茜,肖新华,黎明,李文慧,李伟,于淼,张化冰,平凡,孙晓方,茅李莉,杨国华
(中国医学科学院,北京协和医学院北京协和医院内分泌科,卫生部内分泌重点实验室,北京100730)
替米沙坦(Telmisartan)是一种血管紧张素受体阻断剂(ARB)类降压药,其还具有PPAR-γ 部分激动剂的功能。近年研究发现替米沙坦能保护2 型糖尿病患者肾脏功能。Benndorf 等[1]发现替米沙坦能改善正常蛋白尿的2 型糖尿病患者内皮细胞功能。Bakris 等[2]发现替米沙坦能减少大量蛋白尿2 型糖尿病患者尿蛋白。但是,有关替米沙坦改善糖尿病患者肾脏功能机制的研究,体内实验方面寥寥无几。基因芯片技术作为一种先进的高通量检测技术,具有灵敏、准确、高信息量等优点,可以对个体生物的大量基因表达信息进行高速、并行采集和分析。本研究旨在观察替米沙坦对糖尿病大鼠24 h 尿蛋白、肌酐清除率(Ccr)、血肌酐和血尿素氮(BUN)的影响,并且使用基因芯片技术来探讨替米沙坦改善糖尿病大鼠肾功能的机制。
1 材料与方法
1.1 动物分组及处理
SPF 级雄性Sprague-Dawley 大鼠,体重(230.7 ±11.2)g,购自北京华阜康生物科技股份有限公司【SCXK(京)2011-0010】,饲养于北京协和医院动物中心屏障动物实验设施【SYXK(京)2010-0028】。适应72 h 后,10 只大鼠为正常对照组(给予等体积生理盐水),另20 只大鼠尾静脉注射链脲佐菌素(STZ,60 mg/kg,Sigma 公司,美国)。注射1 周后,测随机血糖高于16.7 mmol/L 者入选。将糖尿病造模成功的16只大鼠随机分为替米沙坦治疗组(每日给予10 mg/kg/d 替米沙坦溶液,柏林格殷格汉药厂,德国)和糖尿病模型组(给予等体积生理盐水),每组8 只。每天灌胃一次,每次每只灌胃1.5 mL,持续12 周。
1.2 相关指标测定
于开始灌胃当天,喂药后4、8、12 周测量大鼠体重、空腹血糖(FBG,禁食4 h 尾部取血,葡萄糖氧化酶法)。灌胃后12 周末留取大鼠24 h 尿,磺柳酸法测定24 h 尿蛋白,酶法测定尿肌酐。而后,禁食4 h,处死,摘眼球取血,酶法测定血肌酐和血尿素氮(BUN)。计算肌酐清除率(Ccr),Ccr =(尿肌酐 ×每分钟产生的尿体积)/(血肌酐 × 体重)。
1.3 大鼠肾脏基因芯片实验
1.3.1 肾脏组织总RNA 抽提处死大鼠后,立即取肾脏组织置液氮冻存备用。替米沙坦组和糖尿病模型组各取3 个样本。TRIZOL 法提取RNA。紫外吸收测定法和变性琼脂糖凝胶电泳对RNA 含量和质量进行鉴定。
1.3.2 合成cDNA
总RNA 逆转录得到单链cDNA。
1.3.3 大鼠基因表达谱芯片
本研究应用大鼠基因芯片(Illumina RatRef-12表达谱芯片,美国),其包括22 524 个探针,覆盖22 228个大鼠基因。该芯片广泛应用于基因功能研究,疾病与正常的基因表达差异研究,发病机制研究,药物靶点研究等方面。具有低样本输入量(仅需50~200 ng RNA),高重复性,高特异性,高准确性等特点。将cDNA 稀释后加入芯片杂交(58℃,18.5h),随后,洗涤,Cy3-链霉亲和素染色。使用Illumina 芯片扫描仪读取数据。
1.4 Real time PCR
为验证基因芯片的结果,选取3 个基因进行real time PCR 试验。引物见表1。设置程序如下:30 min 48℃,15 min 95℃,15 sec 95℃(40 个循环),1 min 55℃。ΔCt(cycle threshold)法[3]计算结果,具体如下:计算替米沙坦组和糖尿病模型组中的每个基因的ΔCt 值,相减得到每个基因的ΔΔCt 值。通过2-ΔΔCt计算两组对应基因的表达差异。管家基因为Gapdh。Fold-change 值的绝对值>2,而且P 值<0.05 的基因为具有显著差异。

表1 Real-time PCR 引物设计Tab.1 Oligonucleotide sequences for primers used in the real-time PCR analysis
1.5 统计学处理
2 结果
2.1 替米沙坦对糖尿病大鼠体重、FBG、24 h 尿蛋白、血肌酐、Ccr 和BUN 的影响
在给予替米沙坦前(0 周)正常对照组、糖尿病模型组和替米沙坦组体重无显著差异。给予替米沙坦4、8 和12 周,替米沙坦组和糖尿病模型组较正常对照组体重显著降低(其中4 周P<0.05,8、12 周P<0.01)。替米沙坦组较糖尿病模型组体重无显著差异(表2)。在给予替米沙坦前(0 周)及给予替米沙坦4、8 和12 周替米沙坦组和糖尿病模型组FBG较正常对照组持续显著升高(P<0.01)。替米沙坦组较糖尿病模型组FBG 无显著差异(表3)。提示替米沙坦不能改善糖尿病大鼠体重和血糖。给予替米沙坦12 周后,糖尿病模型组24 h 尿蛋白、血肌酐和BUN 水平较正常对照组显著升高(其中血肌酐P<0.05,24 h 尿蛋白和BUN P<0.01),Ccr 水平显著降低(P<0.01)。替米沙坦组24 h 尿蛋白、血肌酐和BUN 水平较糖尿病模型组显著降低(其中血肌酐P<0.05,24 h 尿蛋白和BUN P<0.01),Ccr 水平显著升高(P<0.05,表4)。提示替米沙坦具有改善糖尿病大鼠肾脏功能的作用。
表2 替米沙坦治疗12 周大鼠体重(g,±s)Tab.2 Effects of telmisartan on the rat body weight(g,±s)

表2 替米沙坦治疗12 周大鼠体重(g,±s)Tab.2 Effects of telmisartan on the rat body weight(g,±s)
注:与正常对照组比较,* P<0.05,**P<0.01。Note:Compared with the control group,* P<0.05,**P<0.01.
组别Groups0 周0 week4 周4 weeks8 周8 weeks12 周12 weeks正常对照组(n =10)Control246.6 ±18.3262.4 ±17.0273.4 ±10.1292.6 ±19.9糖尿病模型组(n =8)Diabetic250.0 ±12.8255.8 ±12.4*252.8 ±10.0**259.2 ±12.7**替米沙坦组(n =8)Telmisartan257.6 ±14.9261.2 ±12.1*255.9 ±11.6**260.8 ±12.4**
表3 替米沙坦治疗12 周大鼠空腹血糖(mmol/L,±s)Tab.3 Effects of telmisartan on fast blood glucose in the rats(mmol/L,±s)

表3 替米沙坦治疗12 周大鼠空腹血糖(mmol/L,±s)Tab.3 Effects of telmisartan on fast blood glucose in the rats(mmol/L,±s)
注:与正常对照组比较,**P<0.01。Note:Compared with the control group,**P<0.01.
组别Groups0 周0 week4 周4 weeks8 周8 weeks12 周12 weeks正常对照组(n =10)Control6.5 ±0.66.3 ±0.76.4 ±0.56.7 ±0.3糖尿病模型组(n =8)Diabetic19.6 ±3.4**18.9 ±4.1**19.2 ±5.3**19.4 ±6.0**替米沙坦组(n =8)Telmisartan19.9 ±3.7**18.7 ±3.4**18.5 ±4.9**19.2 ±4.6**
表4 替米沙坦干预12 周后24 h 尿蛋白、血肌酐、肌酐清除率和尿素氮比较(±s)Tab.4 Effects of telmisartan on 24 h urinary albumin,blood creatinine,Ccr and BUN(±s)

表4 替米沙坦干预12 周后24 h 尿蛋白、血肌酐、肌酐清除率和尿素氮比较(±s)Tab.4 Effects of telmisartan on 24 h urinary albumin,blood creatinine,Ccr and BUN(±s)
注:与正常对照组比较,* P<0.05,**P<0.01;与糖尿病模型组比较,# P<0.05,##P<0.01。Note:Compared with the control group,* P<0.05,** P<0.01;Compared with the diabetic group,# P<0.05,## P<0.01.
组别Groups 24 h 尿蛋白24 h Urinary albumin(mg /d)血肌酐Blood creatinine(μmol/L)肌酐清除率Ccr(mL/min x per kg)尿素氮BUN(mmol/L)正常对照组Control(n =10)24.9 ±3.949.4 ±3.53.93 ±0.237.65 ±0.74糖尿病模型组Diabetic(n =8)72.6 ±5.4**81.0 ±7.8*1.07 ±0.12**20.29 ±2.57**替米沙坦组Telmisartan(n =8)38.4 ±2.5*##60.5 ±6.2*#2.51 ±0.11*#10.95 ±1.15*##
2.2 基因芯片结果
替米沙坦组较糖尿病模型组有1541 个基因发生显著改变,其中554 个上调,987 个下调。差异基因功能富集分析发现7 个显著改变的通路,包括:核糖体通路、氧化磷酸化通路、帕金森症通路、三羧酸循环通路、丙酮酸代谢通路、PPAR 信号通路和糖酵解/糖异生通路(见表5)。
2.3 real time PCR 结果
替米沙坦组较糖尿病模型组ATP 合成酶β 亚基(Atp5b)、细胞色素c 氧化酶亚基Ⅵc(Cox6c)和NADH 脱氢酶(辅酶Q)铁硫蛋白3(Ndufs3)分别下调1.257 倍,6.053 倍和2.109 倍(P<0.05),结果与基因芯片结果一致(见表6)。ATP5B,COX6C 和NDUFS3 是线粒体氧化磷酸化通路上的重要蛋白。可见,替米沙坦能抑制糖尿病大鼠线粒体氧化磷酸化。

表5 差异基因富集通路(FDR<0.001,倍比值>2.0)Tab.5 KEGG pathway(false discovery rate<0.001,fold enrichment >2.0)
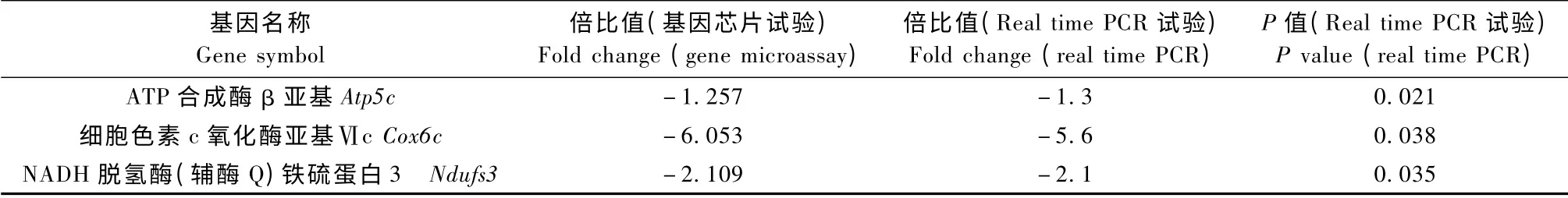
表6 Real time PCR 结果与基因芯片结果比较Tab.6 Comparison of the gene expression measured by real-time PCR and gene microarray analysis
3 讨论
研究发现替米沙坦能显著降低糖尿病大鼠24 h尿蛋白、血肌酐和BUN,显著升高Ccr。揭示替米沙坦能改善糖尿病大鼠肾脏功能。这与之前替米沙坦在其他2 型糖尿病患者中观察到的疗效是一致的[4,5]。
基因芯片结果发现替米沙坦组氧化磷酸化通路显著改变。Real-time PCR 试验发现替米沙坦组Atp5b,Cox6c 和Nduf3 显著下调。ATP5B,COX6C 和NDUFS3 是线粒体氧化磷酸化通路上的重要蛋白。可见,替米沙坦能抑制糖尿病大鼠线粒体氧化磷酸化。线粒体是真核细胞生存和发挥功能的重要细胞器,它通过氧化磷酸化途径产生机体内大部分ATP,在形态上通过不断的分裂和融合,从而维持动力学平衡,并且是机体内活性氧(ROS)生成的主要来源,在细胞凋亡及机体生长和衰老等过程中起着十分关键的作用[6]。以往大量的研究表明,高糖引起的肾脏损害主要通过4 条生化途径,即糖基化终末产物形成增加,蛋白激酶C 激活,多元醇通路活性增高和己糖胺途径激活。然而这些途径间的相互联系和诱发因素尚不清楚[7]。Brownlee 等[8]提出了“统一理论”:认为高糖环境下线粒体呼吸链过量产生的ROS 是糖尿病并发症发生的启动因子,ROS 引起DNA 链断裂,激活与DNA 修复有关的酶PARP(ADP-核糖多聚酶);PARP 通过改变修饰GAPDH抑制其活性,从而激活上述4 条生化途径,而这些途径也可进一步引起ROS 的积聚,激活血管内皮损伤通路,导致细胞的损伤和凋亡,从而造成多个器官的损伤。本研究提示替米沙坦可能通过抑制线粒体氧化磷酸化通路改善糖尿病大鼠肾脏功能。
另外,基因芯片结果发现替米沙坦组PPAR 信号通路显著改变。替米沙坦是PPARγ 部分激动剂。Nakamura 等[3]发现替米沙坦能通过激活PPARγ 受体,上调血管紧张素(1-7)受体MAS 表达,从而改善STZ 诱导的糖尿病大鼠氧化应激和肾脏纤维化。另外,Yao 等[9]发现替米沙坦能通过激活PPARγ,抑制TGF-β1 诱导的平滑肌中ACTIN 的表达和肾小球系膜细胞COLLAGEN-Ⅳ分泌。本研究揭示激活PPARγ 受体可能是替米沙坦改善糖尿病大鼠肾脏功能的机制之一。
总之,本研究观察到替米沙坦能有效改善糖尿病大鼠肾功能。替米沙坦对糖尿病大鼠肾脏功能的调节机制是多通路的,包括抑制线粒体氧化磷酸化通路,激活PPARγ 受体等。本研究尝试使用基因表达谱芯片来探讨这些复杂的机制。并且,本研究选用替米沙坦治疗后的糖尿病大鼠的肾脏作为实验材料,为替米沙坦改善糖尿病大鼠肾脏功能的机制研究提供了体内实验的数据。当然,这些结果还需要进一步证实。
[1]Benndorf RA,Appel D,Maas R,et al.Telmisartan improves endothelial function in patients with essential hypertension[J].J Cardiovasc Pharmacol,2007,50(4):367-371.
[2]Bakris G,Burgess E,Weir M,et al.Telmisartan is more effective than losartan in reducing proteinuria in patients with diabetic nephropathy[J].Kidney Int,2008,74(3):364-369.
[3]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(- delta delta C(T))Method[J].Methods,2011,25(4):402-408.
[4]Nakamura T,Fujiwara N,Sato E,et al.Renoprotective effects of various angiotensin II receptor blockers in patients with earlystage diabetic nephropathy[J].Kidney Blood Pressure Res,2010,33(3):213-220.
[5]Makino H,Haneda M,Babazono T,et al.Microalbuminuria reduction with telmisartan in normotensive and hypertensive Japanese patients with type 2 diabetes:a post-hoc analysis of The Incipient to Overt:Angiotensin II Blocker,Telmisartan,Investigation on Type 2 Diabetic Nephropathy(INNOVATION)study[J].Hypertension Res 2008,31(4):657-664.
[6]Westermann B.Mitochondrial fusion and fission in cell life and death[J].Nat Rev Mol Cell Biol,2010,1l(12):872-884.
[7]肖力,孙林,刘伏友.糖尿病肾脏疾病蛋白尿形成机制新进展[J].中华肾脏病杂志,2010,26(6):478-480.
[8]Brownlee M.The pathobiology of diabetic complications:a unifying mechanism[J].Diabetes,2005,54(6):1615-1625.
[9]Yao Y,Zou R,Liu X,et al.Telmisartan but not valsartan inhibits TGF-β mediated accumulation of extracellular matrix via activation of PPARγ[J].J Huazhong Univ Sci Technol(Med Sci),2008,28(5):543-548.
