激活素A和卵泡抑素对大鼠心肌成纤维细胞增殖及胶原沉积的影响
2012-02-01李焕明顾乃刚天津医科大学第四中心临床学院天津300140
魏 群 李焕明 刘 勇 顾乃刚 张 寰 (天津医科大学第四中心临床学院,天津 300140)
激活素A和卵泡抑素对大鼠心肌成纤维细胞增殖及胶原沉积的影响
魏 群 李焕明 刘 勇 顾乃刚 张 寰 (天津医科大学第四中心临床学院,天津 300140)
目的探讨激活素A(Activin A)和卵泡抑素(FS)对体外培养的原代大鼠心肌成纤维细胞增殖及胶原沉积的影响。方法取出生24 h内Wistar乳鼠心肌成纤维细胞进行体外培养,分别向培养液中加入Activin A或FS+Activin A。应用MTT法检测细胞增殖情况,应用化学比色法检测培养液上清羟脯氨酸含量,RT-PCR法检测培养细胞Ⅰ型胶原(Col-Ⅰ)和Ⅲ型胶原(Col-Ⅲ)mRNA表达。结果与对照组相比,不同浓度Activin A组心肌成纤维细胞的OD值及羟脯氨酸含量明显增高(P<0.05~0.01),Col-Ⅰ及Col-ⅢmRNA表达水平明显升高。不同浓度FS组可降低心肌成纤维细胞的OD值及羟脯氨酸含量(P<0.05~0.01),下调Col-Ⅰ及Col-ⅢmRNA表达水平。结论Activin A能够促进心肌成纤维细胞增殖及胶原沉积,提示Activin A可能在心肌间质纤维化的发生发展中起重要作用,FS能够拮抗Activin A诱导的心肌间质纤维化。
激活素A;卵泡抑素;心肌成纤维细胞;心肌间质纤维化
激活素A(Activin A)属于转化生长因子-β(TGF-β)超家族成员之一,与急性期应答以及纤维化形成有关〔1〕。一定程度的Activin A表达有助于损伤修复过程正常进行,但其过度表达则可能与器官纤维化及某些慢性纤维化疾病的形成有关。卵泡抑素(FS)作为激活素特异结合蛋白,与Activin A有高度的亲和力,可以阻断激活素的生物学作用。Activin A与FS形成Activin A-FS系统共同参与调节成纤维细胞。本实验通过观察Activin A对体外培养原代大鼠心肌成纤维细胞增殖和胶原沉积的影响,探讨Activin A和FS在心肌间质纤维化中的作用,阐明心肌间质纤维化的可能发病机制,为防治心肌纤维化提供新的思路。
1 材料与方法
1.1 材料
1.1.1 动物 出生24 h内的Wistar乳鼠,购自天津医科大学实验动物中心。
1.1.2 主要试剂及仪器 DMEM/F12培养基(DF,Hyclone公司),重组人Activin A、FS(美国Peprotech公司),胎牛血清(杭州四季青公司),青霉素、链霉素(华北制药厂),四甲基耦氮唑盐(MTT,Amersha公司),Trizol RNA提取液、RT-PCR试剂盒(Takara公司),羟脯氨酸测定试剂盒由南京建成提供。
1.2 方法
1.2.1 细胞培养 取出生24 h内的Wistar乳鼠10只,75%酒精消毒皮肤,无菌开胸剪取心脏,将心脏放入盛有预冷D-Hank液的平皿中,剔除心耳及大血管,冷D-Hank液冲洗心室3次,将心室肌剪成1mm3大小的碎块,加10ml0.08%胰酶,35℃ ~37℃反复消化,每次5 min,收集历次的消化上清,加入小牛血清终止消化,离心2次,1 200 r/min,5 min,细胞沉淀用20%血清DMEM培养液混悬,37℃、5%CO2培养60 min后弃上清,瓶内贴壁细胞即为心肌成纤维细胞。后以10%血清DMEM培养液培养,待细胞80%长满时,吸弃培养液,加入0.25%胰酶消化,血清终止,1 200 r/min,5 min离心洗去胰酶,加入培养液重悬,1∶2传代。后应用抗波形蛋白单克隆抗体免疫细胞化学染色鉴定心肌成纤维细胞纯度达98%。试验采用2~3代的心肌成纤维细胞。
1.2.2 Activin A和FS对原代大鼠心肌成纤维细胞增殖和羟脯氨酸分泌的影响 取对数生长期细胞,调节细胞密度至1×105个/m l,接种于96孔板,0.1 ml/孔,培养24 h后更换10%血清DMEM培养24 h,随后将细胞分为:(1)control组;(2)A组:Activin A 10 ng/ml;(3)B组:Activin A 30 ng/ml;(4)C组:Activin A 50 ng/m l;(5)D组:Activin A 100 ng/m l;(6)E组:FS 10 ng/ml+Activin A 10 ng/m l;(7)F组:FS 30 ng/m l+Activin A 30 ng/m l;(8)G组:FS 50 ng/ml+Activin A 50 ng/ml;(9)H组:FS 100 ng/m l+Activin A 100 ng/ml。每组6复孔,各组细胞加药后继续培养24 h,用药后第24小时各孔吸取培养液,用于测定羟脯氨酸含量,后加入15μl5 mg/mlMTT,4 h后各孔加入100μl二甲基亚砜(DMSO),振荡混匀 10 min,酶标仪570 nm处测定吸光度。
1.2.3 RT-PCR法检测心肌成纤维细胞Col-Ⅰ和Col-Ⅲ mRNA表达 细胞培养及分组同上,加入药品后再继续培养24 h。实验结束后应用TRIzol试剂盒抽提细胞总RNA,取总RNA 1μg行逆转录后取5μl进行PCR扩增。以β-肌动蛋白(β-actin)为内参照,对 Col-Ⅰ 及Col-Ⅲ mRNA表达进行半定量检测。引物序列由上海生物工程技术有限公司合成。β-actin正义引物序列:5'-GCTCGTCGTCGACAACGGCTC-3',反义引物序列:5'-CAAACATGATCTGGGTCATCTTCTC-3',片段长度359 bp;Col-Ⅰ正义引物序列:5'-AGGGTCATCGTGGCTTCTC-3',反义引物序列:5'-ACCTTCGCTTCCATACTCG-3',片段长度361 bp;Col-Ⅲ正义引物序列:5'-CTCAAGAGCGGAGAATACTGG-3',反义引物序 列:5'-TGCCACCATCATAGACTAGATTC-3',片 段 长 度704 bp。PCR反应:取3μl逆转录产物分别进行PCR扩增。PCR 反应条件:95℃预变性90 s,94℃变性30 s,56℃退火30 s,72℃延伸50 s,循环32次,最后72℃延伸10 min。取5μl PCR反应产物进行1.5%琼脂糖电泳,光密度扫描后图片经Image J软件分析,结果以检测蛋白/β-actin的光密度比值表示。
1.3 统计学处理 应用SPSS11.0统计软件进行分析,实验数据以±s表示,采用方差分析进行检验。
2 结果
2.1 Activin A对原代大鼠心肌成纤维细胞增殖的影响 与Control组相比,Activin A对心肌成纤维细胞增殖有明显的促进作用,在50 ng/m l以内呈剂量依赖性。当其浓度达100 ng/ml时,仍有促进心肌成纤维细胞增殖的作用,高于对照组(P<0.01),但增殖效应减弱。FS能拮抗Activin A对心肌成纤维细胞增殖的促进作用,呈剂量依赖性(P<0.05~0.01)。见表1。
2.2 Activin A促进原代大鼠心肌成纤维细胞羟脯氨酸分泌的影响 与Control组相比,不同剂量Activin A组的羟脯氨酸含量明显增加(P<0.05~0.01),表明给予Activin A后可引起心肌成纤维细胞增殖并促进胶原分泌;与不同剂量Activin A组相比,FS 10、30、50、100 ng/ml能降低心肌成纤维细胞羟脯氨酸含量(P<0.05~0.01)。见表1。
表1 Activin A及FS对心肌成纤维细胞增殖及羟脯氨酸分泌的影响(±s,n=6)
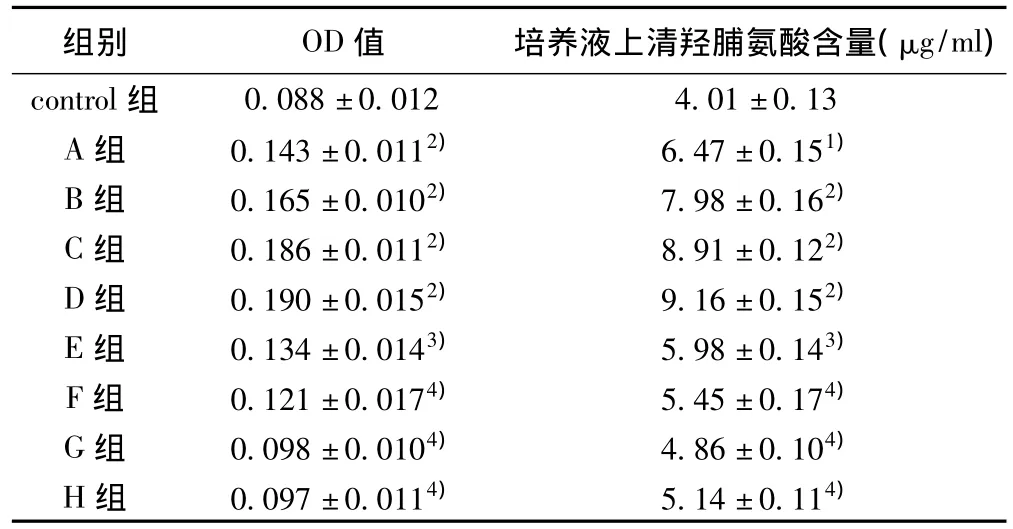
表1 Activin A及FS对心肌成纤维细胞增殖及羟脯氨酸分泌的影响(±s,n=6)
与control组比较:1)P<0.05,2)P<0.01;与A组比较:3)P<0.05,4)P<0.01
组别 OD值 培养液上清羟脯氨酸含量(μg/ml)control组0.088±0.012 4.01±0.13 A组 0.143±0.0112) 6.47±0.151)B组 0.165±0.0102) 7.98±0.162)C组 0.186±0.0112) 8.91±0.122)D组 0.190±0.0152) 9.16±0.152)E组 0.134±0.0143) 5.98±0.143)F组 0.121±0.0174) 5.45±0.174)G组 0.098±0.0104) 4.86±0.104)H组 0.097±0.0114) 5.14±0.114)

图1 各组心肌细胞Col-Ⅰ及Col-ⅢmRNA的表达
2.3 Activin A对心肌成纤维细胞Col-Ⅰ、Col-Ⅲ mRNA表达水平的影响 如图1所示,与control组相比,不同剂量Activin A组心肌成纤维细胞Col-Ⅰ及Col-Ⅲ mRNA表达水平明显增高,以Activin A 50 ng/ml剂量最显著。与不同剂量Activin A组相比,FS 10、30、50、100 ng/ml能下调心肌成纤维细胞 Col-Ⅰ及Col-Ⅲ mRNA表达。
3 讨论
心室重构是慢性心力衰竭发生发展的主要病理基础。在分子水平上,心室重构既包括心肌细胞的重构,又包括心肌间质的胶原沉积和纤维化〔2〕。其中胶原合成与表达(包括Ⅰ、Ⅲ型胶原)的增多及在心肌间质内聚集是心肌纤维化的重要表现〔3〕。已发现许多细胞因子参与心肌纤维化的发病机制,其中以血管紧张素Ⅱ(AngⅡ)及TGF-β1的作用最强。Activin A属于TGF-β超家族成员,研究表明一定程度的Activin A表达有助于损伤修复过程正常进行,但其过度表达则可能与器官纤维化及某些慢性纤维化疾病的形成有关。Yndestad等〔4〕研究显示心梗后心衰模型左室缺血区及非缺血区Activin A表达水平明显增高,可以诱导与心肌重塑相关的介质如心钠素(ANP)、脑钠素(BNP)、基质金属蛋白酶(MMP)-9等mRNA表达增加,而且上述因子在间质纤维化的发展过程中起重要作用。新近实验证明在心肌缺血/再灌注损伤中心肌组织Activin A表达亦增强〔5〕。这些均提示Activin A在细胞增殖分化、纤维化及损伤修复过程中都具有重要作用,对细胞外基质的合成具有促进作用。FS是Activin A的天然结合蛋白,具有广泛的组织分布,与Activin A有很高的亲和力,而且FS与Activin A之间的结合几乎是不可逆的,从而阻断Activin A的生物活性〔6〕。
本实验向体外培养的大鼠心肌成纤维细胞培养液中加入外源性的Activin A,结果发现Activin A在10~50 ng/ml范围内呈剂量依赖性地刺激心肌成纤维细胞增殖;当Activin A浓度达100 ng/m l时,仍具有刺激成纤维细胞增殖的作用,但作用已减弱,说明在一定的浓度范围内Activin A对心肌成纤维细胞具有刺激增殖作用。另外,本实验还发现在RNA水平,Activin A能够促进心肌成纤维细胞Col-Ⅰ及Col-Ⅲ mRNA表达及羟脯氨酸分泌。说明Activin A能够促进心肌间质胶原沉积,与心肌间质纤维化密切相连,这为阐明心衰的发病机制提供了新的方向。FS能够抑制Activin A诱导的心肌成纤维细胞的增殖、羟脯氨酸的分泌,下调Col-Ⅰ、Col-Ⅲ mRNA水平表达。
总之,Activin A可能通过促进心肌成纤维细胞Col-Ⅰ和Col-ⅢmRNA表达及羟脯氨酸分泌,参与了心肌纤维化进程。Activin A可能是导致心肌间质纤维化的又一重要细胞因子,是改善心衰的新的治疗靶点。而FS通过与Activin A不可逆结合,抑制了Activin A的作用,FS在未来有可能成为改善心衰的新的药物。
1 Werner S,Alzheimer C.Roles of activin in tissue repair,fibrosis,and inflammatory disease〔J〕.Cytokine Growth Factor Rev,2006;17(3):157-71.
2 Zile MR,Brutsaert DL.New concepts in diastolic dysfunction and dias-tolic heart failure:PartⅡ:.causalmechanisms and treatment〔J〕.Circulation,2002;105(2):1503-8.
3 Yang F,Yang XP,Liu YH,et al.Ac-SDKP reverses inflammation and fibrosis in ratswith heart failure aftermyocardial infarction〔J〕.Hypertension,2004;43(2):229-36.
4 Yndestad A,Ueland T,Øie E,et al.Elevated levels of activin a in heart failure:potential role in myocardial remodeling〔J〕.Circulation,2004;109(11):1379-85.
5 Zhang LJ,Huang H,Pan PX,et al.Study on the expression of Activin-A in myocardial ischemia postconditioning〔J〕.Sichuan Da Xue Xue Bao Yi Xue Ban,2009;40(1):97-9.
6 Shimonaka M,Inouye S,Shimasaki S,et al.Follistatin binds to both activin and inhibin through the common subunit〔J〕.Endocrinology,1991;128(6):3313-5.
R542.2+3
A
1005-9202(2012)16-3475-03;
10.3969/j.issn.1005-9202.2012.16.059
天津市卫生局面上基金资助项目(No.2011KY05)
张 寰(1961-),女,主任医师,硕士生导师,主要从事冠心病介入治疗。
魏 群(1970-),女,博士,主治医师,主要从事心力衰竭的发病机制及治疗的相关研究。
〔2012-01-20收稿 2012-04-10修回〕
(编辑 袁左鸣)
