人血浆中氢吗啡酮的LC-MS测定方法及其应用
2012-01-29罗雪梅潘寅兵孙鲁宁饶雅琨何明枫王美青刘存明钱燕宁
罗雪梅,丁 黎*,潘寅兵,孙鲁宁,饶雅琨,何明枫,王美青,刘存明,钱燕宁*
1中国药科大学,南京 210009;2南京医科大学第一附属医院,南京 210029
盐酸氢吗啡酮(Hydromorphone Hydrochloride)是一种阿片类镇痛剂,主要作用于μ受体,镇痛效力为吗啡的8倍,不良反应及依赖潜力同吗啡,但可用更高的浓度,适宜于癌症、术后、软组织创伤等引起的中强度疼痛[1]。
国内外文献中,测定血浆中氢吗啡酮的方法有:放射性免疫法测定(RIA)[2]、高效液相电子俘获检测法(HPLC-ECD)[3-4]和高效液相二级质谱测定法(HPLC-MS/MS)[5-7]。但是,与高效液相二级质谱测定法相比,放射性免疫测定法存在选择性较差,高效液相电子捕获检测法存在灵敏度较低的问题。在已报道的高效液相二级质谱测定法中,LC-MS/MS分析测定方法可分为两类:NP-LC-MS/MS法[5-6]和RP-LC-MS/MS法[7]。NP-LC-MS/MS法:应用正相硅胶柱,色谱柱平衡慢,进样后色谱柱需再平衡10 min,总的分析时间长;色谱柱寿命短,只可保证500次进样,不适用大量样品的分析;代谢产物于氢吗啡酮后出峰,可能会干扰氢吗啡酮的测定。RP-LCMS/MS法:采用经酶水解测定血浆中游离及结合型氢吗啡酮总量的方法评价氢吗啡酮缓释片在犬体内的药动学特征,但灵敏度低,最低定量下限仅为0.8 ng·mL-1;不适用于人血浆中氢吗啡酮的测定。除此之外,临床术后患者的此类测定也鲜有报道。本文建立了术后患者血浆中氢吗啡酮测定的LC-MS方法,定量下限为0.06 ng·mL-1,所建立的HPLC-MS分析方法准确、灵敏、方便、耐用,可用于氢吗啡酮的人体药动学研究。
1 材料与方法
1.1 药品与试剂
盐酸氢吗啡酮注射液(宜昌人福药业有限责任公司生产,批号:100401,规格:2 mg/2 mL);氢吗啡酮对照品(由宜昌人福药业有限公司提供,批号:081201,纯度99.8%);内标纳洛酮对照品(由中国药品生物制品检定所提供,批号:1240-9702,纯度99.7%);甲醇、乙腈为色谱纯(德国Merck公司);醋酸铵、甲酸、乙酸乙酯、碳酸氢钠等试剂均为分析纯(南京化学试剂有限公司);实验用水为去离子纯净水。
1.2 仪器
Agilent 1100液相色谱-质谱联用仪(LC-MS):双高压泵、自动进样器、柱温箱、电喷雾离子化接口、四极杆质谱检测器等;色谱工作站:Agilent Chem Station(A 10.02)。
1.3 对照品溶液的配制
精密称取盐酸氢吗啡酮11.60 mg(相当于氢吗啡酮10.28 mg),置于10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得浓度为1.028 mg· mL-1的氢吗啡酮储备液。取该储备液适量,依次稀释至所需浓度。精密称取盐酸纳洛酮5.98 mg(相当于5.38 mg),置于10 mL量瓶中,加入甲醇溶解并稀释至刻度,摇匀,即得浓度为538 μg·mL-1的纳洛酮储备液。取该储备液适量,依次稀释至所需浓度538 ng·mL-1。
1.4 实验条件
色谱柱:Hedera ODS-2(dp 5 μm,150 mm×2.1 mm I.D.,江苏汉邦科技有限公司);流动相:5 mmol· L-1醋酸铵水溶液(含1%甲酸)-甲醇(88∶12,v/v);流速:0.35 mL·min-1;柱温50℃。选择性离子检测(SIM);电喷雾离子化 (ESI);离子极性:正离子(Positive);检测离子选择:氢吗啡酮,[M+H]+m/z 286.2;内标(纳洛酮),[M+H]+m/z 328.2;传输区电压:160 V;干燥气流量:10 L·min-1;雾化室压力:30 psig;干燥气温度:350℃。
1.5 血浆样品的处理
于10 mL玻璃离心管中,精密加入血浆样品0.5 mL,内标(纳洛酮)对照品溶液(537 μg·mL-1)30 μL,旋涡混匀。加入1 mol·L-1饱和碳酸氢钠溶液0.5 mL,旋涡混匀。加入提取液乙酸乙酯4 mL,旋涡5 min,于4000 r·min-1离心10 min。吸取全部上清液转移至另一10 mL干净玻璃离心管内,于35℃水浴中以氮气流吹干。提取好的血浆样品放置于-80℃冰箱中保存。测定前用120 μL流动相溶液复溶,旋涡3 min,于15600 r·min-1高速离心10 min,吸取上清液转移至自动进样器样品瓶中,进样量20 μL,进行LC-MS分析。
1.6 药代动力学研究
一名男性受试者,体重58 kg,年龄21岁,经体检证明肝、肾功能正常,心电图正常,符合受试者入选条件并签署知情同意书,试验严格遵守《赫尔辛基宣言》有关伦理准则,试验方案经南京医科大学第一附属医院伦理委员会批准。按试验方案将患者术后转入麻醉恢复室,当其恢复意识、肌力及反射后,拔除气管导管。待受试者呼吸稳定以及血液动力学稳定后,单次静脉恒速注射盐酸氢吗啡酮注射液1.5 mg(将规格为2 mg/2 mL的注射剂2支,用生理盐水稀释至40 mL,给药速度:90 mL/9 mg·h-1),输注泵持续泵注时间为10 min。以开始给药(0 h)计时,然后于给药前(0 h)及静脉注射开始后5、10、15、20、30、45 min和1、2、3、4、6、8 h各时间点分别采集受试者给药对侧肘静脉血3 mL,采集的全血立即放入含有稳定剂的肝素钠抗凝管中,3000 r·min-1离心10 min,分离血浆,置-80℃冰箱保存待测。用LC-MS法测定血浆中氢吗啡酮的浓度,计算药动学参数。
2 结 果
2.1 质谱扫描
在电喷雾离子化正离子检测条件 (传输区电压:160 V)下,氢吗啡酮形成的主要离子峰为[M+H]+m/z 286.2,见图1-A;内标(纳洛酮)形成的主要离子峰为[M+H]+m/z 328.2,见图1-B。
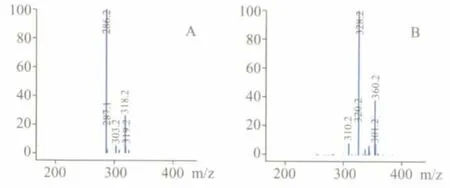
图1 氢吗啡酮(A)和内标纳洛酮(B)的质谱图
2.2 特异性考察
在本试验所采用的色谱条件下(见图2),氢吗啡酮的保留时间为2.4 min左右;内标(纳洛酮)的保留时间为4.3 min左右;氢吗啡酮和内标 (纳洛酮)峰形良好,无杂峰干扰测定;本方法具有较高的特异性,能准确测定血浆中氢吗啡酮的浓度,且灵敏度较高。

图2 血浆中氢吗啡酮的LC-MS图(A)空白血浆;(B)空白血浆加入氢吗啡酮和内标(纳洛酮);(C)受试者静脉注射氢吗啡酮后的血浆样品加内标对照品
2.3 标准曲线制备及定量下限
取10 mL离心管数支,分别精密加入不同量的氢吗啡酮对照品溶液后,以氮气流吹干,加入空白血浆0.5 mL,旋涡混匀,配成含氢吗啡酮浓度分别为 0.06168、0.2570、1.028、3.084、10.28、20.56、41.12、61.68 ng·mL-1的标准含药血浆,按 “血浆样品的处理”项下操作,并同时制备空白血浆样品,进行LCMS分析,记录色谱图,制备标准曲线。计算氢吗啡酮峰面积As和内标峰面积Ai的比值f(f=As/Ai),以峰面积比值f对血药浓度C作权重回归计算,得氢吗啡酮的回归方程:f=5.57×10-2C+7.6×10-4(r= 0.9982),权重系数w=1/C2。结果显示,氢吗啡酮血药浓度在0.06168~61.68 ng·mL-1范围内线性关系良好,最低定量限为0.06168 ng·mL-1,信噪比大于10。
2.4 精密度与准确度试验
制备含氢吗啡酮浓度分别为 0.1542、3.084、51.40 ng·mL-1的标准含药血浆,每个浓度各配制5份样品,按“血浆样品的处理”项下操作,计算样品和内标峰面积的比值f,将f代入随行标准曲线方程,计算各样品的浓度,连续测定3批样品,根据批样品浓度计算本法的准确度与精密度,结果见表1,本方法的准确度与精密度符合生物样品分析要求。
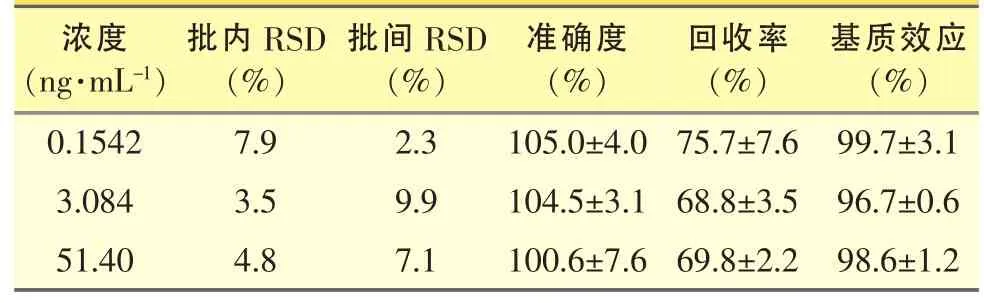
表1 氢吗啡酮的精密度(RSD,n=5)、准确度、回收率和基质效应(n=3)
2.5 提取回收率与基质效应试验
按文献[7]报道方法考察基质效应(ME)和提取回收率,配制并处理含氢吗啡酮浓度分别为0.1542、3.084、51.40 ng·mL-1的标准含药血浆,每个浓度平行5份,作为回收率样品;另取5个不同来源空白血浆同法处理,取上清液,加入氢吗啡酮和内标标准溶液,配制同上3个质量浓度的标准含药血浆,每个浓度平行5份,作为介质效应样品和回收率对照样品;以水代替血浆同法配制并处理同上3个质量浓度的标准液,每个浓度平行3份,作为介质效应对照样品。将上述样品进样,记录色谱图,回收率和介质效应样品峰面积与相应对照品峰面积均值之比即为回收率和介质效应值。测得血浆中内标纳洛酮的回收率为 (80.8±2.9)%(n=15),ME分别为(101.1±2.4)%(n=15),血浆中氢吗啡酮回收率及ME见表1,结果表明,本实验条件下氢吗啡酮和内标的回收率均良好,血浆基质对其离子化及测定无影响。
2.6 稳定性考察
配制含氢吗啡酮浓度分别为 0.1542、3.084、51.40 ng·mL-1的标准含药血浆样品若干份。其中3份按“血浆样品的处理”项下操作处理后,立即进样测定并于进样器中放置,分别于室温下放置7 h、反复冻融及冰冻放置2周条件下的稳定性;同时考察了待测样品溶液于进样器中放置,提取液于室温放置和残渣在冰冻条件下的稳定性。结果见表2,氢吗啡酮血浆样品稳定性良好。
2.7 药代动力学研究
受试者术后静脉恒速输注盐酸氢吗啡酮(1.5 mg)后,测得该受试者氢吗啡酮的血药浓度-时间曲线见图3,采用BAPP软件对受试者的血药浓度-时间数据进行处理,主要药代动力学参数为:Cmax11.76 ng·mL-1,Tmax0.167 h,t1/22.6 h,AUC0-85.472 ng·h·mL-1,AUC0-∞6.046 ng·h·mL-1。
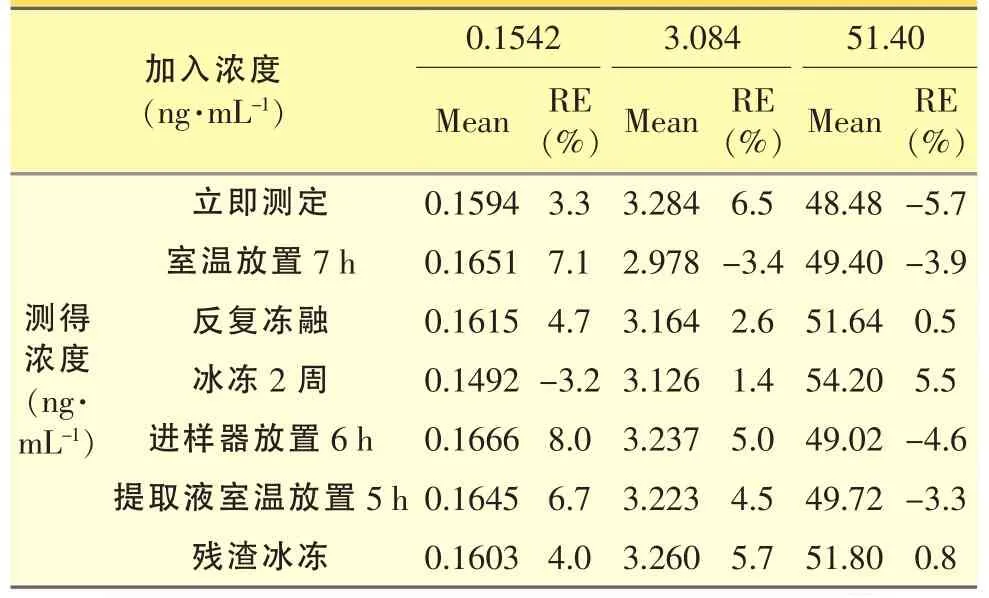
表2 LC-MS法测定血浆中氢吗啡酮的稳定性试验(n=3)
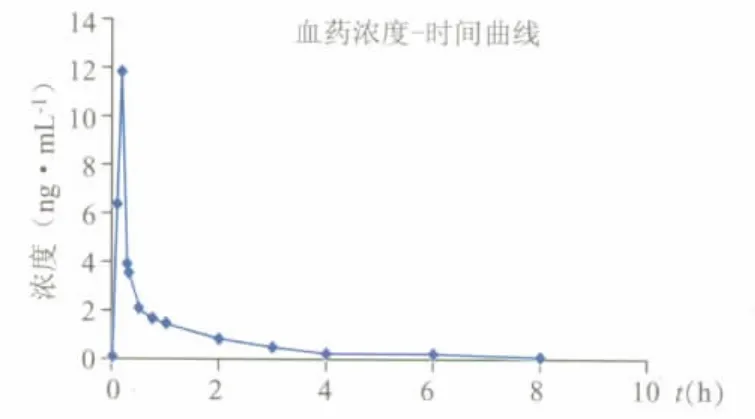
图3 受试者静脉注射氢吗啡酮后氢吗啡酮的血药浓度-时间曲线
3 讨 论
氢吗啡酮是阿片类镇痛药,可导致阿片类的药物依赖性。反复使用会产生精神、躯体依赖性[8],故本试验仅研究患者单次给药的药动学特征。
3.1 色谱柱的选择
氢吗啡酮极性较大,试验初期尝试使用亲水柱(HILIC柱)。但存在如下问题:(1)HILIC柱与反相柱保留机制不同。其中,增加HILIC柱流动相中乙腈的比例,流动相的洗脱能力反而降低,氢吗啡酮在HILIC柱中保留较弱,需增加乙腈的量以提高保留,但在液质联用应用过程中,有机溶剂量大于95%时,离子化效率反而降低,质谱响应降低。同时,酸碱和醋酸铵对保留的影响不大。(2)氢吗啡酮存在介质效应,采用各种方法仍无法避免。(3)氢吗啡酮在体内有95%经葡萄糖醛酸化消除,血浆中氢吗啡酮葡萄糖醛酸化代谢产物的浓度是氢吗啡酮的30倍[9]。氢吗啡酮的二相代谢产物在HILIC柱上色谱峰拖尾严重,在源内发生裂解,于氢吗啡酮样品峰后出峰,增加了样品分析的时间和干扰了样品的测定。(4)HILIC平衡较慢,分析时间长,耐用性不如普通C18柱。因此,选择C18柱分析氢吗啡酮生物样品。
3.2 分析仪器的选择
文献[5-7]中报道的LC-MS/MS方法中所达到的最低定量下限为0.8 ng·mL-1,试验条件摸索时,也尝试了LC-MS/MS的方法,但并不能通过质谱条件的优化来提高待测物的响应。这可能是因为氢吗啡酮的结构属刚性多环,环之间联系紧实,在质谱中不容易被裂解。选用二级质谱中的MRM检测模式时,为了获得合适的子离子,通常要选择较高的碰撞能量,这使得氢吗啡酮在四级杆中的损失增大。而选择母离子到母离子的检测模式时,由于化合物在质谱中通过路径的时间要远长于在单级质谱中的时间,这也使得最终获得的氢吗啡酮的响应降低。最终选择单级质谱LC-MS来分析待测物氢吗啡酮,并获得了较好的灵敏度。
[1]Murray A,Hagen NA.Hydromorphone[J].J Pain Sympt Manage,2005,29(3):5-66.
[2] Lee JW,Pedersen JE,Moravetz TL,et al.Shepard. Sensitive and specific radioimmunoassaysforopiates using commercially available materials.I:Methods for the determinations of morphine and hydromorphone[J].J Pharm Sci,1991,80(3):284-8.
[3] Wetzelsberger N,Lücker PW,Erking W.High-pressure liquid chromatographic method for the determination of hydromorphone in human plasma with electrochemical detection[J].Arzneimittelforschung,1986,36(11):1707-10.
[4] Bouquillon AI,Freeman D,Moulin DE.Simultaneous solid-phase extraction and chromatographic analysis of morphine and hydromorphone in plasma by high-performance liquid chromatography with electrochemical detection[J].J.Chromatogr,1992,577(2):354-7.
[5] Weng ND,Jiang XY,Newland K,et al.Development and validation of a sensitive method for hydromorphone in human plasma by normal phase liquid chromatography-tandem mass spectrometry[J].JPharm Biomed Anal,2000,23(4):697-704.
[6] Chen YL,Hanson GD,Jiang XY,et al.Simultaneous determination ofhydrocodone and hydromorphone in human plasma by liquid chromatography with tandem mass spectrometric detection[J].J Chromatoqr B,2002, 769(1):55-64.
[7] 李晓燕,陈笑艳,涂静华,等.LC-MS/MS法测定毕格犬血浆中氢吗啡酮 [J].质谱学报,2003,24:89-90.
[8] 陈 磊,尹 萍,邱 毅,等.盐酸氢吗啡酮身体依赖性潜力 [J].中国药物依赖性杂志,2008,17(5):344-7.
[9] Hagen N,Thirlwell MP,Dhaliwal HS,et al.Steadystate pharmacokinetics of hydromorphone and hydromorphone-3-glucuronide in cancer patients after immediate and controlled-release hydromorphone[J].J Clin Pharmaco,1995,35(1):37-44.
