苦参素抑制肝纤维化的临床研究
2012-01-20张建荣李丽华范书平张月鹏
张建荣 李丽华 范书平 张月鹏
肝纤维化(hepatic fibrosis)是机体对慢性肝损伤的一种修复反应,是一种渐进的病理过程,是慢性肝病的共有病理变化。肝纤维化的特征改变是肝脏内细胞外基质(extracellular matrix,ECM)的过度增生和异常沉积,严重者的肝纤维化可导致肝硬化,甚至引起肝功能衰竭[1]。目前从肝纤维化发生发展的不同环节入手研制了许多抗纤维化药物,但仍未有十分确定、特效的药物,因此,寻找理想的抗肝纤维化药物及有关肝纤维化发病机制的阐明,具有重要的理论和临床意义。苦参素(Oxymatrine)是从中药苦豆子或苦参根中提取的一种生物碱,研究显—示苦参素有防止肝纤维化的作用[2,3],但其作用机制及调节途径未完全明确。本研究从细胞因子水平进一步探讨苦参素抗肝纤维化的作用机制,为苦参素的临床防治肝纤维化提供指导。
1 资料与方法
1.1 一般资料 选择2010年1月至2011年12月在本院住院的患有慢性肝纤维化的患者100例,随机分为治疗组和对照组。对照组50例,男45例,女5例;年龄28~52岁,平均年龄(40±6)岁;治疗组50例,男44例,女6例;年龄26~55岁,平均年龄(40±8)岁。2组患者在年龄,性别和治疗前肝功能检测比较差异均无统计学意义(P>0.05),有可比性。
1.2 治疗方法 2组患者均给予常规护肝及支持治疗等一般治疗。治疗组在一般治疗的基础上给予苦参素氯化钠注射液0.6 g(100 ml),静脉滴注,1次/d,疗程 8 周,治疗期间均不加用其他抗肝纤维化的药物。
1.3 观察指标
1.3.1 血清学检查:对照组和治疗组所有患者抽取静脉血3 ml,离心后分离血清,送化验室检测。检测项目如下:①肝功能指标检测:利用HF-240全自动生化分析仪检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(ALb)和总胆红素(TBiL)的变化。②血清肝纤维化指标检测:利用放免分析法检测透明质酸(HA)、层黏蛋白(LN)、Ⅲ型前胶原肽(PC-Ⅲ)和Ⅳ型胶原(CⅣ)的变化。③转化生长因子β1(TGF-β1)、白介素10(IL-10)和肿瘤坏死因子α(TNF-α)检测:利用酶联免疫吸附法检测TGF-β1和IL-10;利用双抗体一步夹心法酶联免疫吸附试验检测TNF-α的变化。
1.3.2 肝穿刺后Ⅰ型胶原(CⅠ)和Ⅲ型胶原(CⅢ)检测:对照组和治疗组各10例患者经局部麻醉,在CT的定位和引导下经皮肤穿刺,获取肝脏标本约15 mg。肝组织入4℃裂解液匀浆5 min,4℃离心,取上清,Bradford法测定样本蛋白浓度。样本蛋白经12%SDS-PAGE凝胶电泳分离,转移至PVDF膜,脱脂奶粉室温封闭2 h,1∶300稀释的collagenⅠ,Ⅲ抗体和MMP13抗体4℃过夜,二抗(1∶3 000稀释)与硝酸纤维素膜杂交。将膜置于ECL中1 min,曝光,显影,定影。采用美国Kodak公司ID数码成像分析系统软件对Western blot结果进行定量分析,结果以目的蛋白与β-actin的积分光密度值的比值表示。
1.4 统计学分析应用SPSS 13.0统计软件,计量资料以±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 肝功能指标 对照组与治疗组治疗后ALT、AST和TBiL水平与治疗前相比均显著降低(P <0.05或 <0.01),ALb水平与治疗前相比显著增加(P<0.05);但2组治疗后ALT、AST、TBiL和Alb水平比较差异无统计学意义(P >0.05)。见表1。
表1 2组治疗前后肝功能指标比较n=50,±s
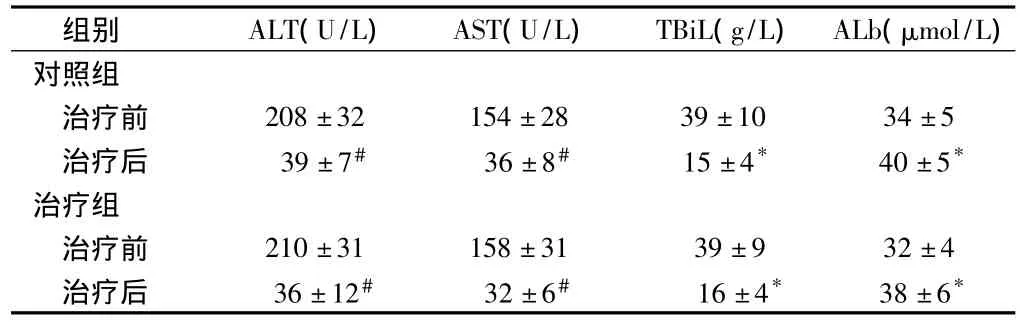
表1 2组治疗前后肝功能指标比较n=50,±s
注:与治疗前比较,*P <0.05,#P <0.01
组别 ALT(U/L) AST(U/L) TBiL(g/L) ALb(μmol/L)对照组治疗前 208±32 154±28 39±10 34±5治疗后 39±7# 36±8# 15±4* 40±5*治疗组治疗前 210±31 158±31 39±9 32±4治疗后 36±12# 32±6# 16±4* 38±6*
2.2 血清肝纤维化指标 对照组治疗后HA、LN、PC-Ⅲ和CⅣ水平较治疗前无统计学差异(P>0.05);治疗组治疗后HA、LN、PC-Ⅲ和CⅣ水平与治疗前相比均显著降低(P <0.01)。治疗组治疗后HA、LN、PC-Ⅲ和CⅣ水平明显低于对照组治疗后,差异有统计学意义(P <0.01)。见表2。
表2 2组治疗前后血清肝纤维化比较n=50,±s
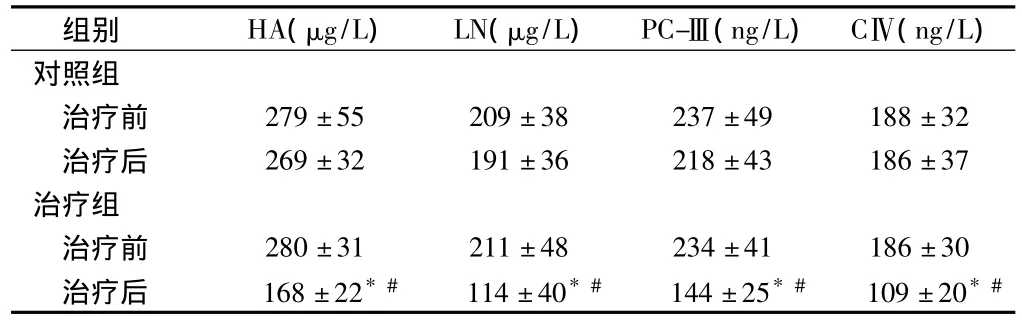
表2 2组治疗前后血清肝纤维化比较n=50,±s
注:与治疗前比较,*P <0.01;与对照组比较,#P <0.01
组别 HA(μg/L) LN(μg/L) PC-Ⅲ(ng/L) CⅣ(ng/L)对照组治疗前 279±55 209±38 237±49 188±32治疗后 269±32 191±36 218±43 186±37治疗组治疗前 280±31 211±48 234±41 186±30治疗后 168±22*# 114±40*# 144±25*# 109±20*#
2.3 TGF-β1、IL-10 和 TNF-α 指标 对照组治疗后 TGF-β1、IL-10和TNF-α水平较治疗前差异无统计学意义(P>0.05);治疗组治疗后HTGF-β1和TNF-α水平与治疗前相比均显著降低(P <0.05或<0.01),而IL-10水平与治疗前相比显著提高(P <0.05)。治疗组治疗后TGF-β1和TNF-α 水平明显低于对照组治疗后(P <0.05或<0.01),而IL-10水平明显高于对照组治疗后(P <0.05)。见表3。
表3 2组治疗前后TGF-β1、IL-10和TNF-α比较n=50,±s

表3 2组治疗前后TGF-β1、IL-10和TNF-α比较n=50,±s
注与治疗前比较,*P <0.05,#P <0.01;与对照组比较,△P <0.05,☆P <0.01
组别 TGF-β1(mg/L) IL-10(μg/L) TNF-α(ng/L)对照组治疗前 144±22 24±5 3.8±0.5治疗后 137±16 22±4 3.7±0.3治疗组治疗前 147±32 25±5 3.9±0.7治疗后 90±11#☆ 38±8*△ 1.7±0.2*△
2.4 Western blot法测CⅠ和CⅢ变化 对照组与治疗组治疗后CⅠ和CⅢ水平与治疗前相比均显著降低(P<0.05或<0.01);治疗组治疗后CⅠ和CⅢ水平明显低于对照组治疗后,差别有统计学意义(P<0.05)。见表4。
3 讨论
本研究通过血清学检测发现,对照组和治疗组治疗后ALT、AST和TBiL水平降低,ALb水平显著增加,提示两种治疗方法均有效的改善了肝功能。肝纤维化指标显示苦参素治疗组HA、LN、PC-Ⅲ和CⅣ水平与治疗前相比均显著降低。而对照组治疗后没有显著改变,暗示苦参素具有改善肝纤维化的功能。细胞因子检测和免疫印迹结果显示苦参素氯化钠注射液降低TGF-β1、TNF-α、Ⅰ型胶原和Ⅲ型胶原,升高IL-10了水平,提示苦参素改善肝纤维化的机制可能通过改变上述物质而发挥作用。
表4 2组治疗前后CⅠ和CⅢ与β-actin比值的比较n=10,±s

表4 2组治疗前后CⅠ和CⅢ与β-actin比值的比较n=10,±s
注:与治疗前比较,*P <0.05,#P <0.01;与对照组比较,△P <0.05
组别 CⅠ CⅢ对照组治疗前 1.9786 ±0.1363 2.3123 ±0.1578治疗后 1.6385 ±0.0876* 1.9543 ±0.1352*治疗组治疗前 1.9689 ±0.1478 2.3476 ±0.1842治疗后 1.3572±0.1476#△ 1.4558±0.3756**△
研究显示,肝星状细胞的激活认为是肝纤维化过程中最重要的一步。HSC激活并转化为肌成纤维细胞样细胞,通过增生和分泌细胞外基质参与肝纤维化的形成,因此各种致纤维化因素均把肝星状细胞作为最终靶细胞,其中TGF-β1和TNF-α是有力的致纤维化因子,调控肝内细胞外基质的合成与降解[3]。因此苦参素可以通过降低TGF-β1和TNF-α的合成而抑制肝星状细胞的激活,起到抑制肝纤维化的作用。
细胞外基质包括胶原、糖蛋白及蛋白多糖等,其中胶原是最主要的成分,在肝脏中有Ⅰ型,Ⅲ型-Ⅵ型共5型,而以Ⅰ型和Ⅲ型为主。肝纤维化早期胶原沉积以Ⅲ型为主,后期以Ⅰ型为主,因此本研究中通过免疫印迹观察到的Ⅰ型胶原和Ⅲ型胶原的降低进一步证实苦参素抑制了肝星状细胞的激活,降低了Ⅰ型胶原和Ⅲ型胶原的合成,缓解了肝纤维化过程。此外,动物研究发现IL-10有抑制Ⅰ型胶原表达,促进胶原酶合成的作用,进而影响细胞外基质沉积,延缓肝纤维化进程[4,5],这与本实验观察到的结果相一致,进一步证实了苦参素的抗肝纤维化作用。
因此,本研究通过临床实验研究发现苦参素作为一种中药提取剂能够抑制肝星状细胞的激活,降低TGF-β1、TNF-α、Ⅰ型胶原和Ⅲ型胶原,升高IL-10了水平,缓解肝纤维化过程,为苦参素的临床防治肝纤维化提供了新的理论依据。
1 Fallowfield J,Hayes P.Pathogenesis and treatment of hepatic fibrosis:is cirrhosis reversible?Clin Med,2011,11:179-183.
2 Liang JX,Qu XF,Zeng WT,et al.Mechanism of oxymatrine in preventing hepatic fibrosis formation in patients with chronic hepatitis B.Nan Fang Yi Ke Da Xue Xue Bao,2010,30:1871-1873.
3 Shi GF,Li Q.Effects of oxymatrine on experimental hepatic fibrosis and its mechanism in vivo.World J Gastroenterol,2005,11:268-271.
4 Mao YM,Zeng MD,Lu LG,et al.Capsule oxymatrine in treatment of hepatic fibrosis due to chronic viral hepatitis:a randomized,double blind,placebo-controlled,multicenter clinical study.World J Gastroenterol,2004,10:3269-3273.
5 Wang SC,Ohata M,Schrum L,et al.Expression of interleukin-10 by in vitro and in vivo activated hepatic stellate cells.J Biol Chem,1998,273:302-308.
