烟草叶片蛋白质组双向电泳实验体系的建立
2012-01-17王绍美罗成刚刘贯山冯全福苏振刚陈雅琼蒋彩虹孙玉合
王绍美,罗成刚,刘贯山,冯全福,苏振刚,陈雅琼,蒋彩虹,孙玉合
(烟草行业烟草遗传育种重点实验室,中国农业科学院烟草研究所,青岛 266101)
蛋白质组学是后基因组时代功能基因组学研究的新兴学科和热点领域。随着各种新研究技术渐趋成熟,蛋白质组的概念于1994年被提出[1-2],它是从整体、动态、网络的水平上对蛋白质进行研究,研究蛋白质组是研究认识复杂生命活动的要求。
蛋白质组学的发展是随着蛋白质研究技术的发展而发展的。双向电泳技术是蛋白质组学研究的核心技术之一。它先后利用蛋白质等电点和分子量的不同在两个方向上分离蛋白质复杂组分,因分辨率和灵敏度较高,是复杂蛋白组分检测和分析强有力的一种生化技术。目前应用的双向凝胶电泳体系是以 1975年 O’Farrell首创的技术方案体系[3]为基础,不断改进应用中出现的问题建立起来的[4-5]。该体系克服了载体两性电解质阴极漂移等缺点,建立起非常稳定的pH梯度,使双向凝胶电泳结果的重复性和分辨率显著提高[6]。
双向电泳技术最初主要适于分析动物组织和微生物细胞全蛋白组分。随着蛋白质组学研究技术的发展和不断完善[7],近年来,植物蛋白质组学研究相继借鉴动物蛋白质组学研究方法,改进措施减少实验中的干扰因素展开研究。如拟南芥[8]等模式植物中已广泛展开;在水稻[9-10]、大豆[11-12]、小麦[13-14]、玉米[15-16]等重要农作物的抗性、品质等方面的蛋白质组研究也取得了一定进展,先后见诸报道。关于烟草蛋白质组学研究可见的英文报道有:Duby 等[17]、Goulet等[18]开展了基础研究;Pineda等[19]、Razavizadeh等[20]等开展了逆境胁迫研究;Kaida等[21]、Chivasa等[22]和 Millar等[23]开展了代谢调控研究;在国内开展的烟草蛋白质组学研究很少。本实验的目的在于建立不同发育时期烟草叶片蛋白质组研究适用的双向电泳实验体系,为进一步开展烟草叶片蛋白质组学研究提供参考体系。
1 材料与方法
1.1 实验材料
本实验选用中国烟草遗传育种研究(北方)中心保存的干旱敏感型栽培烟草品种中烟100[24-25]和感黑胫病栽培烟草品种小黄金 1025[26]作为实验品种,2010年9月种植于中国农业科学院烟草研究所烟草种质资源楼三楼温室。中烟100移栽于装有相同质地、重量营养土的同一规格白色塑料花盆中,旺长后期取样;小黄金1025假植后长到5片左右真叶取样。两个品种各选取6株长相一致的烟株摘取同一部位烟叶,用铝薄纸分别包装、标记、装入小布袋,迅速投入液氮罐中保存备用。
1.2 蛋白质样品制备与定量
1.2.1 中烟100旺长后期叶片蛋白质样品制备与定量 蛋白质的提取参照 Damerval等、Tsugita等及Giavalisco等[27-29]等所记述的TCA/丙酮法稍加改进,提取旺长后期烟草叶片总蛋白质。
称取1 g液氮保存的鲜烟叶样品,按烟叶重量的10%加入PVP,加液氮充分研磨成粉末,转入2 mL离心管。
处理1(除杂质1次):加入1.5 mL -20 ℃预冷丙酮,轻轻摇匀,冰浴,沉淀1 h,14 000 r/min 4 ℃离心30 min,弃上清;
处理2(除杂质2次):将处理1的沉淀重悬于1.5 mL预冷丙酮,重复处理1的操作一次。
沉淀用1.5 mL含10% TCA和1% DTT的丙酮悬浮,混匀,置于-20 ℃冰箱沉淀过夜;14 000 r/min 4 ℃离心30 min,弃上清;加入含0.07% DTT和1 mmol/L PMSF的预冷丙酮1.5 mL,轻摇悬浮之,冰浴,沉淀30 min,12 000 r/min 4 ℃离心30 min,弃上清;加入90%丙酮,12 000 r/min 4 ℃离心30 min,弃上清,重复同样操作,洗涤沉淀一次;室温晾干沉淀。在沉淀中加入250 μL裂解液[8 mol/L尿素,2 mol/L硫脲,0.5%(w/v)CHAPS,2%(w/v)两性电解质,1%DTT,1 mmol/L PMSF],并加入 50 μg/mL DNase I,12 000 r/min 4 ℃离心30 min,取上清用bradford法测定总蛋白质浓度[30],-80 ℃保存准备双向电泳分离蛋白质。
1.2.2 小黄金 1025苗期叶片蛋白质样品制备与定量 蛋白质的提取参照Giavalisco等[29]和Suxia cui等[10]的蛋白质分级抽提法,并结合 Hurkman等[31]的蛋白质酚抽提法和丙酮洗涤蛋白质沉淀,稍加改进,提取苗期烟叶总蛋白质。
取4~5 g液氮中保存的苗期烟叶样品置于研钵中,加液氮研磨至泛白的粉末;将新配制的抽提buffer I [抽提缓冲液Ⅰ储液4 mL(50 mmol/L pH 7.8的 Tris-HCl、10 %甘油、1 mmol/L EDTANa2混溶于100 ml MilliQ H2O,4 ℃保存)、10 mg/mL PMSF 69.6 μL 和 2% β-巯基乙醇 4 μL]加入研钵,充分研磨后,转入10 mL离心管,轻摇几下,置4 ℃冰箱30 min;取出于4 ℃,14 000 r/min离心30 min,上清转入新的15 mL离心管4 ℃保存之;沉淀中加入新配制的抽提 buffer Ⅱ [抽提缓冲液Ⅱ储液2 mL(100 mmol/L pH 7.1的磷酸缓冲液、10%甘油、0.2 mol/L KCl、2 mmol/L MgSO4·7H2O、1 mmol/L EDTANa2溶于 100 mL MilliQ H2O,4 ℃保存)、2%(w/v)CHAPS 40 mg、10 mg/mL PMSF 34.8 μL、2% β-巯基乙醇 2 μL]悬起沉淀,轻轻混匀,静置几分钟,置4 ℃冰箱30 min后取出,按加入抽提buffer Ⅱ的体积为2 mL计算,直接加入7 mol/L尿素,2 mol/L硫脲,30 mmol/L DTT,室温轻轻摇匀30 min;在18 ℃,14 000 r/min,离心30 min,上清混入抽提buffer I抽提得到4 ℃保存的上清中;混合后的上清液4 ℃,14 000 r/min离心30 min,上清转入新的离心管内,并加同上清液等体积的Tris饱和酚,室温摇床混匀30 min,在4 ℃,14 000 r/min离心30 min,取下层酚相转移入新的50 mL离心管中,并加入5倍体积-20 ℃保存的0.1 mol/L乙酸胺(溶于甲醇),轻轻混匀,置于4 ℃冰箱静置过夜;第2天在4 ℃,8000 r/min离心30 min,弃上清,用-20 ℃预冷的冰丙酮2~3 mL(含 150 μL 13 mmol/L DTT)洗涤沉淀,4 ℃,8000 r/min离心15 min,重复洗涤沉淀一次并离心弃上清;去盖,封口膜包口,膜上扎若干小孔,于-40 ℃冷冻干燥成蛋白质冻干粉,转入2 mL离心管用封口膜密封,-80 ℃保存备双向电泳使用。
1.3 蛋白质双向电泳及凝胶扫描图像分析
1.3.1 中烟100旺长后期叶片总蛋白质样品分离及凝胶扫描图像分析 采用的双向电泳技术是在O’Farrell技术方法[3]的基础上稍加改进。
用Bio-Rad的17 cm IPG预制胶条、MultiphorⅡ进行等电聚焦。样品定量后吸取含1 mg总蛋白的样品溶液,用溶胀buffer(8 mol/L尿素,2 mol/L硫脲,0.5%CHAPS,0.52%两性电解质,0.02%溴酚蓝,1% DTT)稀释至 170 μL,将溶胀 buffer泡胀好的预制胶条胶面朝上放入聚焦槽,固定上样杯,加入蛋白质上样溶液进行等电聚焦(表1)。

表1 等电聚焦程序Table 1 Running condition of isoelectric focusing (IEF)
等电聚焦结束,胶条立即置于水化盘中平衡两次:在胶条平衡缓冲液母液(50 mmol/L Tris-HCl pH 8.8,6 mol/L尿素,30%甘油,2%SDS,0.02%溴酚蓝,MilliQ H2O)中加入终浓度2% DTT制成平衡缓冲液 I,水平振荡 15 min,用 MilliQ H2O冲洗胶条;转入由胶条平衡缓冲液母液和终浓度为2.5% IAA制成的平衡缓冲液II,水平振荡15 min,MilliQ H2O冲洗胶条,进行第二向电泳。
平衡后的胶条置于12% SDS-PAGE胶上端,marker放置凝胶一端,用0.5%的琼脂糖封胶,使用Bio-Rad公司的Protean Ⅱ Xi cell电泳系统,电泳仪设置:第1步,15 mA/胶,恒流电泳15 min;第2步,250 V,恒压电泳,待溴酚蓝指示剂达到底部边缘时停止电泳。
电泳结束后,采用胶体考马斯亮兰G-250染色法[32]进行凝胶染色。先用蒸馏水漂洗 3次,5 min/次,加入染色液(10%硫酸铵、10%磷酸、0.12% G250、20%甲醇)过夜,用脱色固定液(3%冰醋酸溶液、12%的无水乙醇和 MilliQ H2O)脱色多次至背景变成透明,蛋白质点变得圆润,最后换成MilliQ H2O洗涤30 min。
凝胶脱色完全后,用美国UMAX公司生产的PowerLook 2100XL图像扫描仪扫描获取.tif格式的凝胶图像:图像与原胶尺寸大小一致、透射模式、300 dpi分辨率。凝胶图像用PDQuest软件进行处理、比对分析,生成比对结果报告。通过比对结果报告筛选我们需要的目标差异蛋白质。
1.3.2 小黄金 1025苗期叶片总蛋白质样品分离及凝胶扫描图像分析 参照Huang等[33]的蛋白质样品再水化方法。称取-80 ℃保存的蛋白质干粉0.8、1.2、1.5、2.0 mg,分别置于2 mL离心管中,加入480 μL样品水化液[7 mol/L尿素、2 mol/L硫脲、4%(w/v)CHAPS、2‰(w/v)溴芬蓝、40 mmol/L DTT、0.5%(v/v)(pH 4-7)IPG buffer],室温下充分溶解,10 000 r/min离心5 min去除未溶杂质,取上清液,以 BSA作为标准对照,用Peterson[34]、Cui等[10]的方法定量蛋白质。
参照Huang等[33]的方法进行等电聚焦。使用Amersham Phamacia Bintech公司的 24 cm(pH 4-7)线性IPG胶条,上样体积为450 μL,水化盘过夜水化上样,用GE公司的Ettan IPGphor 3进行等电聚焦,仪器运行设置为恒温20 ℃(表2)。

表2 等电聚焦仪运行参数Table 2 IEF operation parameters
等电聚焦结束,取出胶条置于平衡管中立即平衡两次:平衡缓冲液I含1%(w/v)的DTT;平衡缓冲液II含2.5%(w/v)的IAA外,其他步骤同1.3.1。
参照 Laemmli[35]方法制备 12.5%的第二向SDS-PAGE凝胶,平衡后的IPG胶条置于上端,用1×电极缓冲液配制0.7%的低熔点琼脂糖(含痕量溴酚蓝)封胶,用GE公司的Ettan DALTsix进行第二向电泳,运行设置恒温15 ℃(表3)。

表3 第二向垂直板电泳运行参数Table 3 2 Vertical board electrophoresis operation parameters
电泳结束后,凝胶用MilliQ H2O漂洗5 min,加考马斯亮蓝 R-250染色液[0.1%(w/v)考马斯亮蓝R-250、45%甲醇、10%(v/v)冰乙酸]染色3 h;加脱色液[20%(v/v)乙醇、8%(v/v)冰乙酸]脱色,更换2~3次,至背景变白,蛋白质斑点清晰鲜明。
凝胶脱色完全后,用ImageScanner Ⅲ扫描仪及ImageScanner Labscan扫描软件扫描图像,设置256阶灰度、300 dpi透射扫描,.mel或者.TIFF格式图像,图像尺寸与原胶一致。凝胶图像用软件ImageMaster 2D Platinum 7.0进行分析比对,生成结果报告,筛选目标差异蛋白质。
2 结 果
2.1 中烟100旺长后期叶片总蛋白质提取条件的初步优化
图1用pH 3-10胶条对TCA/丙酮法提取烟叶总蛋白质进行双向电泳预实验。烟叶样品液氮研磨后,a用预冷丙酮沉淀一次,双向电泳图谱竖条纹较浓,说明提取的总蛋白质中杂质较多;b用预冷丙酮沉淀两次,双向电泳图谱竖条纹明显减弱,背景较清晰。因此,TCA/丙酮法提取烟叶总蛋白质时,用预冷丙酮沉淀研磨后的样品两次,可更好的去除样品中的色素、酚类和醌等次生代谢物,更适合旺长后期烟叶蛋白质双向电泳分析。

图1 液氮研磨后预冷丙酮沉淀的双向电泳图谱Fig.1 2-DE gel image of cold acetone precipitation after grinding leaves of zhongyan 100 with liquid nitrogen
2.2 中烟100旺长后期叶片总蛋白质分离第一向IPG胶条的筛选
图2中,选择pH 3-10、pH 3-10 NL、pH 4-7的17 cm IPG胶条,用优化的TCA/丙酮法提取总蛋白质样品,上样量相同,比较双向电泳凝胶图谱上得到清晰圆润蛋白质点的数量。a胶图清晰圆润的蛋白质点集中分布在pH 4~pH 8,说明集中于这一区域的蛋白质种类和数量较多,但pH 6~pH 7分子量为66 KD左右的蛋白质没有得到很好的分离,且pH<4和pH>8区域蛋白质点很少,轮廓不太清楚,有重叠;b胶图清晰圆润的蛋白质点分布在pH 4~pH 8的区域,点的数量比a大幅减少,而pH 6~pH 7分子量为66 KD左右的蛋白质得到了很好的分离,但pH<4和pH>8的蛋白质点没有得到分离,聚集在一起;c胶图清晰圆润的蛋白质点分布在整张图上,且在 a图中处于 pH 6~pH 7分子量为66 KD左右没有分离的蛋白质得到了很好的分离,整张图的蛋白质点数量明显高于前两张胶图。所以,pH 4-7的IPG胶条更适合 TCA/丙酮法提取的烟叶总蛋白质双向电泳分离。
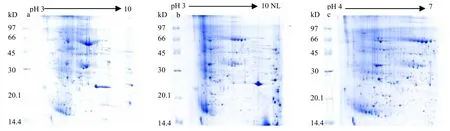
图2 用3种pH胶条获得的双向电泳图谱Fig.2 2-DE gel patterns with three immobilized pH gradient strip
2.3 小黄金1025苗期叶片蛋白质样品不同上样量的比较
分别称取0.8、1.2、1.5、2.0 mg的小黄金1025总蛋白质干粉,选用pH 4-7的IPG胶条,4种蛋白质上样量都获得清晰的双向凝胶电泳图谱,经图像扫描和比对分析,结果表明:在实验条件一致的情况下,蛋白质上样量不同导致凝胶图谱上检测出的蛋白质点数量有差异。4种不同上样量检测出的蛋白质点数量依次为:153、191、228、236个(图3中a、b、c、d)。随着蛋白质上样量的增加检测出的低丰度蛋白质数量也在增加,但是高丰度蛋白质的蛋白质点易发生重叠,所以在此实验条件下,1.5 mg的总蛋白质上样量适合蛋白质双向电泳分离。
3 讨 论
蛋白质组研究的开展不仅是生命科学研究进入后基因组时代的里程碑,也是后基因组时代生命科学研究的核心内容之一。中国烟草基因组计划重大专项的实施,栽培烟草的两个祖先种——绒毛状烟草和林烟草全基因组序列图谱的完成,成为烟草科学发展的一个重要里程碑,标志着烟草研究从此全面进入基因组时代。蛋白质组学技术将为研究烟草功能基因搭建一个良好平台,可以为烟草基因组计划重大专项的基因表达谱研究和分析提供良好的技术支撑。
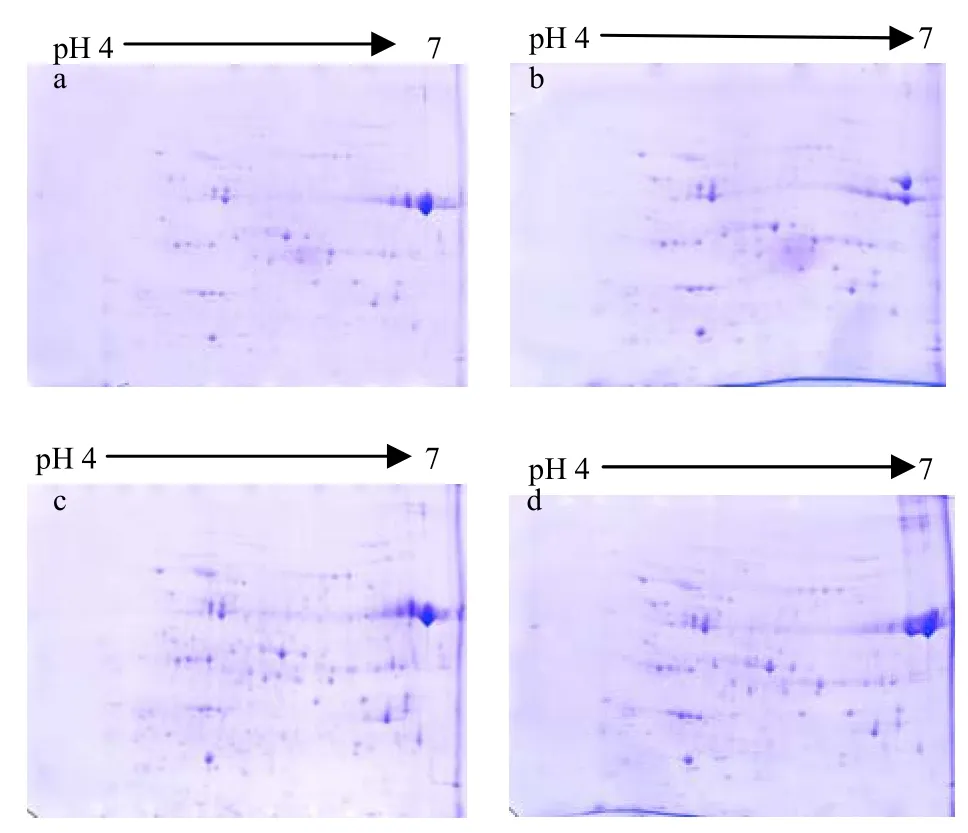
图3 不同蛋白质上样量的双向凝胶电泳图谱Fig.3 2-DE gel patterns with different protein quantities
目前,国内外烟草行业的蛋白质组学研究尚属探索阶段。烟草叶片中色素、酚类和醌等次生代谢物含量较高,在蛋白质样品提取过程中去除不净将影响双向电泳图谱的效果,因此蛋白质样品制备成为双向电泳是否成功的限制因素。通过本研究,旺长后期的烟草叶片蛋白质样品用TCA-丙酮法提取,预冷丙酮沉淀两次,选用Bio-Rad pH 4-7的17 cm IPG预制胶条,用Multiphor Ⅱ进行等电聚焦,上样杯上样,上样量为1 mg,上样体积为170 μL,可以得到重复性较好,蛋白质点清晰的双向电泳图谱;在此基础上苗期烟草叶片总蛋白质样品由蛋白质分级提取、酚抽提及丙酮洗涤相结合的方法获得,选用Amersham Phamacia Bintech公司的24 cm pH 4-7线性IPG胶条,上样量1.5 mg,上样体积450 μL,水化盘过夜(12 h以上)水化上样,同样可得到重复性好,背景干净,蛋白质点清晰的双向电泳图谱。
蛋白质样品制备提取的方法很多,同一种提取方法对不同物种不同器官或组织的蛋白质样品提取效果不同,不同的实验室应针对自身的实验需求及研究材料的特殊性,参考文献中的方法通过大量试验摸索双向电泳最适合的条件[36-37]。本研究对烟草叶片蛋白质的提取仅尝试了文献中的两种方法,并参考了文献中的双向电泳程序,下一步可以对烟草叶片尝试其它蛋白质提取方法,并尝试对双向电泳程序在原有实验的基础上做进一步的优化,以建立起烟草叶片蛋白质组学研究的最佳实验条件。
[1]Swinbanks D.Government backs proteome proposal[J].Nature, 1995, 378: 653.
[2]Wasinger V C, Cordwell S J, Cerpa-Poljak A, et al.Progress with gene-product mapping of the Mollicutes:Mycoplasma genitalium[J].Electrophoresis, 1995,16(7): 1090-1094.
[3]O’Farrell P H.High resolution two-dimensional electrophoresis of proteins[J].J Biol Chem., 1975, 250:4007-4021.
[4]Wildgruber R, Harder A, Obemater C.Towards high resolution: two-dimensional electrophoresis of saccharomyces cerevisiae proteins using overlapping narrow immobilized pH gradients[J].Electrophoresis,2000, 21: 2610-2616.
[5]Görg A, Obermaier C, Boguth G, et al.The current state of two-dimensional electrophoresis with immobilized pH gradients[J].Electrophoresis, 2000, 21: 1037-1053.
[6]Chen Rong-Zhi, Weng Qing-Mei, Huang Zhen, et al.Analysis of resistance-related proteins in rice against brown planthopper by two-dimensional electrophoresis[J].Acta Botanica Sinica, 2002, 44(4):427-432.
[7]Huber L A.Is proteomics heading in the wrong direction?[J].Nature Reviews Molecular Cell Biology,2003, 4(1): 74-80.
[8]Rutschow H, Ytterberg A J, Friso G, et al.Quantitative proteomics of a chloroplast SRP54 sorting mutant and its genetic interactions with CLPC1 in Arabidopsis[J].Plant Physiol., 2008, 148: 156-175.
[9]Kim S T, Kim S G, Kang Y H, et al.Proteomics analysis of rice lesion mimic mutant (sp/1) reveals tightly localized probenazoleinduced protein (PBZ1) in cells undergoing programmed cell death[J].J Proteome Res., 2008, 7: 1750-1760.
[10]Cui S, Huang F, Wang J, et al.A proteomic analysis of cold stress responses in rice seedlings[J].Proteomics,2005, 5(12): 3162-3172.
[11]Natarajan S, Xu C, Caperna T J, et al.Comparison of protein solubilization methods suitable for proteomic analysis of soybean seed proteins[J].Anal Biochem.,2005, 342: 214-220.
[12]曾维英,杨守萍,盖钧镒,等.大豆质核互作雄性不育系NJ CMS1A及其保持系的花药差异蛋白质组学研究[J].中国农业科学,2007,40(12):2679-2687.
[13]Hajheidari M, Eivazi A, Buchanan BB, et al.Proteomics uncovers a role for redox in drought tolerance in wheat[J].J Proteome Res., 2007, 6(4): 1451-1460.
[14]陈蕊红,叶景秀,张改生,等.小麦质核互作型雄性不育系及其保持系花药差异蛋白质组学分析[J].生物化学与生物物理进展,2009,36(4):431-440.
[15]Chang W W, Huang L, Shen M, et al.Patterns of protein synthesis and tolerance of anoxia in root tips of maize seedlings acclimated to a low-oxygen environment,and identification of proteins by mass spectrometry[J].Plant Physiol., 2000, 122(2): 295-318.
[16]许珂,曹墨菊,朱英国,等.玉米C型细胞质雄性不育系 C48-2及其保持系线粒体差异蛋白分析[J].作物学报,2008,34(2):232-237.
[17]Duby G, Degand H, Faber A M, et al.The proteome complement of Nicotiana tabacum Bright-Yellow-2 culture cells[J].Proteomics, 2010, 10, 2545-2550.
[18]Goulet C, Goulet C, Goulet M C, et al.2-DE proteome maps for the leaf apoplast of Nicotiana benthamiana[J].Proteomics, 2010, 10, 2536-2544.
[19]Pineda M, Sajnani C, Baro´n M.Changes induced by the Pepper mild mottle tobamovirus on the chloroplastproteome of Nicotiana benthamiana[J].Photosynth Res., 2010, 103: 31-45.
[20]Razavizadeh R, Ehsanpour A A, Ahsan N, et al.Proteome analysis of tobacco leaves under salt stress[J].Peptides, 2009, 30: 1651-1659.
[21]Kaida R, Serada S, Norioka N, et al.Potential role for purple acid phosphatase in the dephosphorylation of wall proteins in tobacco cell[J].Plant Physiology, 2010,153(7): 603-610.
[22]Chivasa S, Simon W J, Murphy A M, et al.The effects of extracellular adenosine 5´-triphosphate on the tobacco proteome[J].Proteomics, 2010, 10: 235-244.
[23]Millar D J, Whitelegge J P, Bindschedler LV, et al.The cell wall and secretory proteome of a tobacco cell line synthesising secondary wall[J].Proteomics, 2009, 9:2355-2372.
[24]贾兴华,王元英,佟道儒,等.烤烟新品种中烟100(CF965)的选育及其应用评价[J].中国烟草学报,2006,12(2):20-25.
[25]马新蕾,房燕,王玉军,等.十个烤烟品种的抗旱性鉴定[J].中国烟草学报,2005,11(5):26-30.
[26]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23224—2008烟草品种抗病性鉴定[S].北京:中国标准出版社,2009.
[27]Damerval C, de Vienne D, Zivy M, et al.Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seeding proteins[J].Eletrophoresis, 1986, 7:52-54.
[28]Tsugita A, Kamo M, Kawakami T, et al.Two-dimensional electrophoresis of plant proteins and standardization of gel patterns[J].Eletrophoresis, 1996,17(5): 855-865.
[29]Giavalisco P, Nordhoff E, Lehrach H, et al.Extraction of proteins from plant tissues for two-dimensional electrophoresis analysis[J].Electrophoresis, 2003, 24:207-216.
[30]Bradford M M.A rapid and sensitive method for the quantitation of icrogram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem.,1976, 72: 248-254.
[31]Hurkman W J, Tanaka C K.Solubilization of plant membrane proteins for analysis by two-dimensional gel electrophoresis[J].Plant Physiol., 1986, 81:802-806.
[32]Neuhoff V, Arold N, Taube D, et al.Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie brilliant blue G-250 and R-250[J].Electrophoresis, 1988, 9: 255-262.
[33]Huang F, Parmryd I, Nilsson F, et al.Proteomics of Synechocystis sp.strain PCC 6803: identification of plasma membrane proteins[J].Mol Cell Proteomics,2002, 1(12): 956-966.
[34]Peterson G L.A simplification of the protein assay method of Lowry et al.which is more generally applicable[J].Anal Biochem., 1977, 83, 346-356.
[35]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970, 227: 680-685.
[36]刘静,潘映红,徐琴,等.小麦叶片蛋白质组的2D-LC分离及Nano LC-MS/ MS分析[J].中国农业科学,2009,42(3):772-780.
[37]王明娟,季孔庶.珍珠黄杨叶片的蛋白质提取方法探讨[J].基因组学与应用生物学,2009,28(1):105-108.
